首页 > 医疗资讯/ 正文
导读
消化管管壁共分四层,由内向外分别为:黏膜层、黏膜下层、肌层和外膜。其中,黏膜层由内向外又分为上皮、固有层和黏膜肌层。小肠的上皮为单层柱状上皮,细胞排列呈波浪状,向腔内隆起形成绒毛,绒毛底部凹陷处为小肠腺,又称隐窝(见图1)。绒毛部上皮由吸收细胞、杯状细胞和少量内分泌细胞组成;隐窝处除上述细胞外,还有帕内特细胞和干细胞。
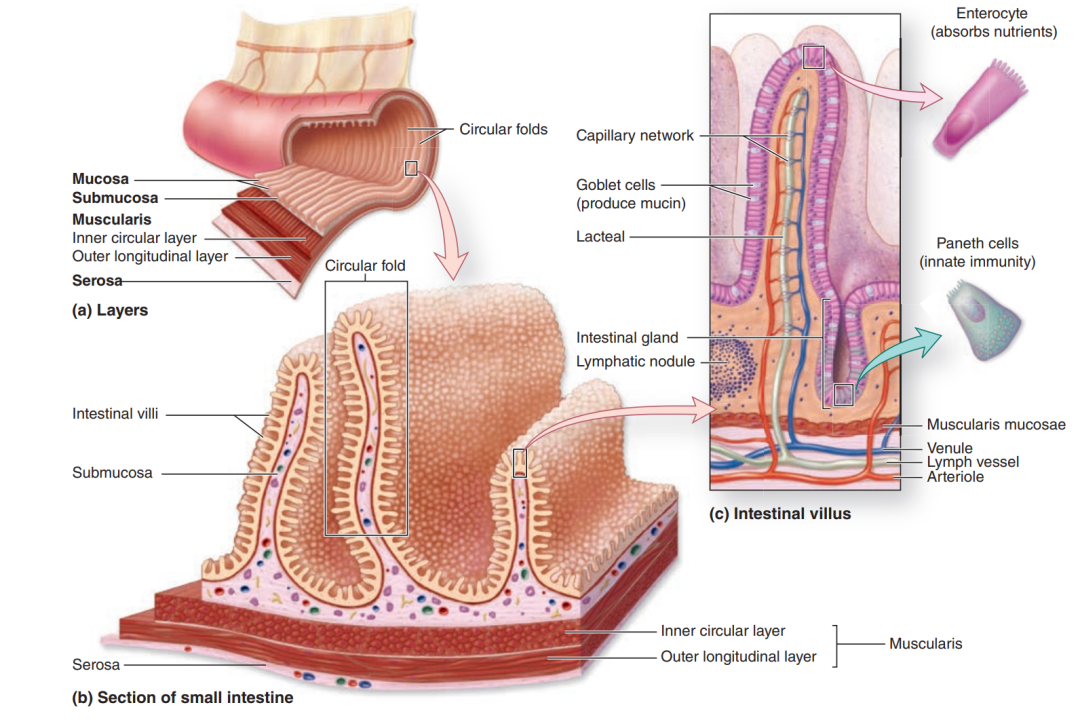
图1:小肠肠壁结构模式图
a.小肠肠壁的四层结构;b.黏膜层和黏膜下层隆起形成环状皱襞;c.紫红色部分为上皮
肠上皮是一支精密的细胞护卫队,日夜守护内部组织,抵御病原体和消化液的侵袭。隐窝中的“新兵”--干细胞沿肠壁向上迁移,在绒毛处成为具有吸收或分泌功能的“专业战士”,完成数天服役后,成熟细胞会启动“退役”程序,有序脱离组织进入肠腔。这种新旧更替既保证了战斗力,又确保了防御屏障始终稳固。传统观点认为,细胞脱离组织的方式是“被挤出”--细胞拥挤导致机械压缩。然而,一项发表于Science的最新研究“Epithelial tension controls intestinal cell extrusion”,揭示了更为核心的调控机制,证实肠上皮细胞的脱落主要由上皮张力调控,而非拥挤压力,这对传统认知提出了挑战。这股张力源于细胞骨架的收缩,并通过细胞连接进行力学整合。就像在上皮细胞层中组织了一场永不停歇的“拔河比赛”,那些相对“力气小”--无法维持足够张力的细胞就会被淘汰出局,从而确保整个组织屏障的力学完整性。

背景:肠上皮的稳态更新与传统“拥挤模型”
肠上皮细胞的更新周期约为3-6天。干细胞位于隐窝底部,不断分裂产生新细胞。这些细胞向上迁移并分化为吸收细胞、杯状细胞等功能细胞,最终在绒毛顶端被挤出至肠腔。
既往研究人员发现,细胞挤出现象沿绒毛干逐渐增加,并在绒毛顶端达到峰值。因此长期以来,人们认为细胞挤出是由于绒毛顶端空间有限,细胞拥挤、机械压缩所致。但有研究发现,细胞密度在隐窝和绒毛基部较高,沿绒毛干降低,并在绒毛顶端恢复至绒毛基部水平。因此,“拥挤模型”似乎不足以解释细胞挤出模式。
核心发现:张力,而非拥挤,主导细胞挤出
1. 细胞挤出发生在张力区域,而非高密度区域
为深入探究细胞挤出的机制,研究团队构建了小鼠肠道类器官模型,该类器官能高度模拟真实肠道的结构和功能。通过追踪类器官中数百个挤出事件,研究人员观察到两种不同的挤出模式:一种在挤出前出现核碎片化,表明是由凋亡驱动的挤出,这种挤出模式主要见于隐窝区,较少发生;另一种显示挤出时核完整,为活细胞挤出,绒毛区域中大多数(92%)挤出是活细胞挤出(见图2)。
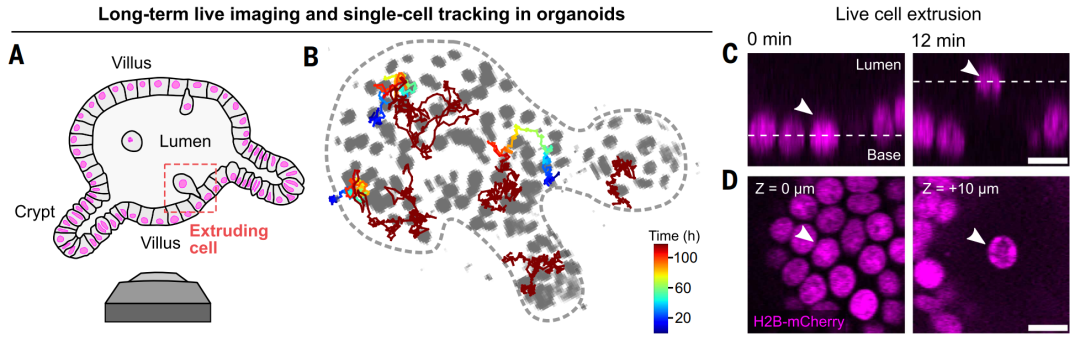
图2:肠道类器官中的细胞挤出
同时,研究人员发现,挤出并非发生在细胞密度最高的区域,相反,挤出多发生于平均细胞密度区或低细胞密度区。进一步在小鼠肠道中进行激光切割实验发现,无论是绒毛干还是绒毛顶端,组织在切割后均向外回弹,表明这些区域处于张力状态,而非压缩状态。因此,这种活细胞发生的细胞挤出并非由拥挤驱动,而是由张力驱动。
2. 基底面肌动蛋白-肌球蛋白网络动态波动,形成“拔河”机制
研究人员发现,肠上皮细胞的基底面存在一个高度动态的肌动蛋白-肌球蛋白网络。该网络会周期性收缩和松弛,导致细胞基底部面积发生脉冲性变化。当一个细胞收缩时,其邻近细胞会扩张,反之亦然。这种相互牵拉的行为类似于“拔河比赛”,细胞通过这种方式不断试探彼此的力学强度。
3. 机械弱势细胞更易被挤出
通过光遗传学增强部分细胞的收缩力后,研究人员发现,那些未被激活、收缩力较弱的细胞更容易被挤出。同样,在类器官中,肌球蛋白功能缺陷的细胞(如Myh9+/−)也更易被挤出。这表明,细胞挤出的决定因素不是“谁占的地方多”,而是“谁的力气大”。
4. 机械损伤或收缩力丧失直接触发挤出
当使用激光破坏单个细胞的基底部细胞骨架时,该细胞会在1小时内被挤出。而若激光仅靶向细胞核,则无此效应。这表明,细胞能否维持基底面张力直接决定了其是否被挤出(见图3)。
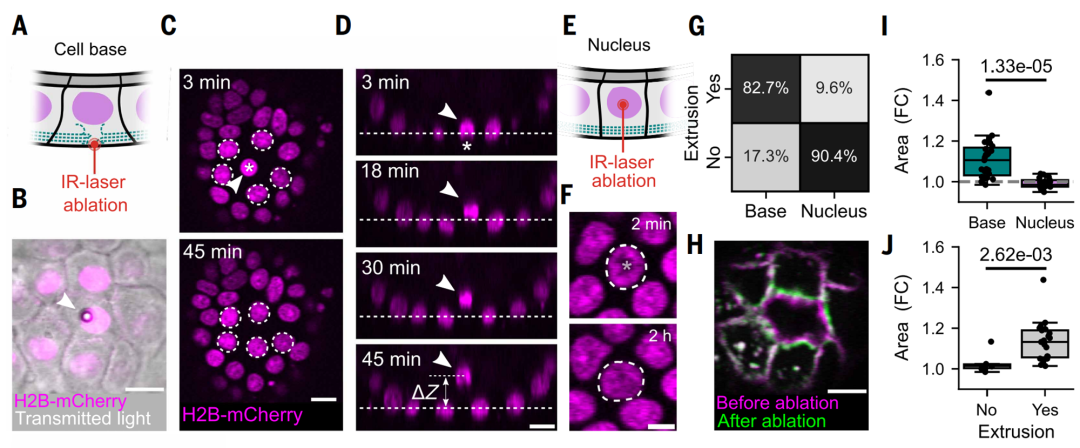
图3:细胞不同部位的机械损伤
5. 细胞挤出是组织水平的协同行为
研究人员还发现,当一个细胞开始挤出时,其周围的细胞也会上调肌球蛋白II,共同收缩,形成一个“收缩环”,推动该细胞向外排出。这表明挤出不是单个细胞的行为,而是整个上皮组织的协同反应。
疾病关联:先天性簇绒肠病中的张力失调
为了验证这一机制在疾病中的作用,研究人员构建了Epcam基因敲除的类器官模型。Epcam是一种上皮细胞粘附分子,其突变会导致先天性簇绒肠病,患者常伴有严重腹泻和肠道屏障功能障碍。
研究发现,Epcam缺失会导致肌球蛋白II过度活化,组织张力升高,挤出率增加。在混合细胞实验中,过度活跃的肌球蛋白II会优先驱动收缩性较弱的野生型细胞被挤出,表明机械性竞争在疾病发生中起关键作用。
意义与展望
这项研究不仅修正了我们对肠道稳态的传统理解,更提出了一个全新的“张力调控挤出”模型。肠上皮不再是被动承受细胞拥挤的“传送带”,而是一个主动进行“力学筛选”的动态系统,通过不断淘汰弱势细胞,维持组织的机械完整性。相关研究方法也可能适用于其他上皮组织,如皮肤、呼吸道等。更重要的是,许多疾病(如炎症性肠病、结肠癌等)都涉及上皮屏障功能的破坏和细胞挤出的异常。靶向调控细胞张力,可能成为未来治疗这些疾病的新策略。
这项研究通过多学科交叉的方法,首次揭示了肠上皮细胞挤出的力学调控机制,不仅回答了基础生物学中的重要问题,也为相关疾病的治疗提供了新的视角。我们正在学习如何与细胞“交流”,而力学,正是这种对话中至关重要的“语言”。
论文信息
Krueger D, Spoelstra WK, Mastebroek DJ, et al. Epithelial tension controls intestinal cell extrusion. Science. 2025;389(6764):eadr8753.
https://doi.org/10.1126/science.adr8753
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)