首页 > 医疗资讯/ 正文
间叶性肿瘤的分类正在迅速扩展,新实体的定义不仅基于传统的形态学参数,还依据驱动肿瘤发生的潜在分子基因变异。本文旨在概述与头颈部病理医师相关的部分近期描述及新兴实体,重点阐述可能提示需进行分子检测的形态学和免疫组化特征。本综述将介绍:1)TIMP3::ALK重排肿瘤;2)梭形细胞/硬化性横纹肌肉瘤(重点关注携带TFCP2重排的肿瘤);3)EWSR1::POU2AF3肉瘤;4)伴EWSR1::PATZ1融合的肉瘤;5)GLI1变异的软组织肿瘤。
炎症性肌纤维母细胞瘤与TIMP3::ALK重排肿瘤
炎症性肌纤维母细胞瘤(IMT)被归类为具有有限恶性潜能的肿瘤(极少转移),其特征为形态温和的梭形细胞(呈肌成纤维细胞形态),伴混合性炎症浸润。超过90%的IMT表达平滑肌肌动蛋白(SMA),约60%表达ALK,这与涉及ALK的驱动融合相关。约15%的经典IMT发生于头颈部,而一种具有TIMP3::ALK融合的形态独特的成纤维细胞肿瘤,则相对特异性地好发于声带。TIMP3::ALK融合也见于子宫的黏液样变程度不一的IMT中,尤其与妊娠相关。
文献报道的发生于声带的TIMP3::ALK融合肿瘤亚群,表现为独特的黏液样成纤维细胞表型。有研究报道了7例TIMP3::ALK融合肿瘤均发生于15-65岁患者的声带,典型临床表现为发声困难和声音嘶哑。Kerr等额外报道了6例(4例位于真声带,1例位于下咽,1例位于口腔),具有相似特征。
据报道,TIMP3::ALK融合肿瘤的组织学特征为:发生于声带表浅软组织的小而无包膜结节,由形态温和的梭形细胞构成,细胞位于黏液样基质中,生长方式杂乱,部分病例呈组织培养样外观,可见疏密不一的区域(图1)。所有肿瘤均有ALK免疫反应性。
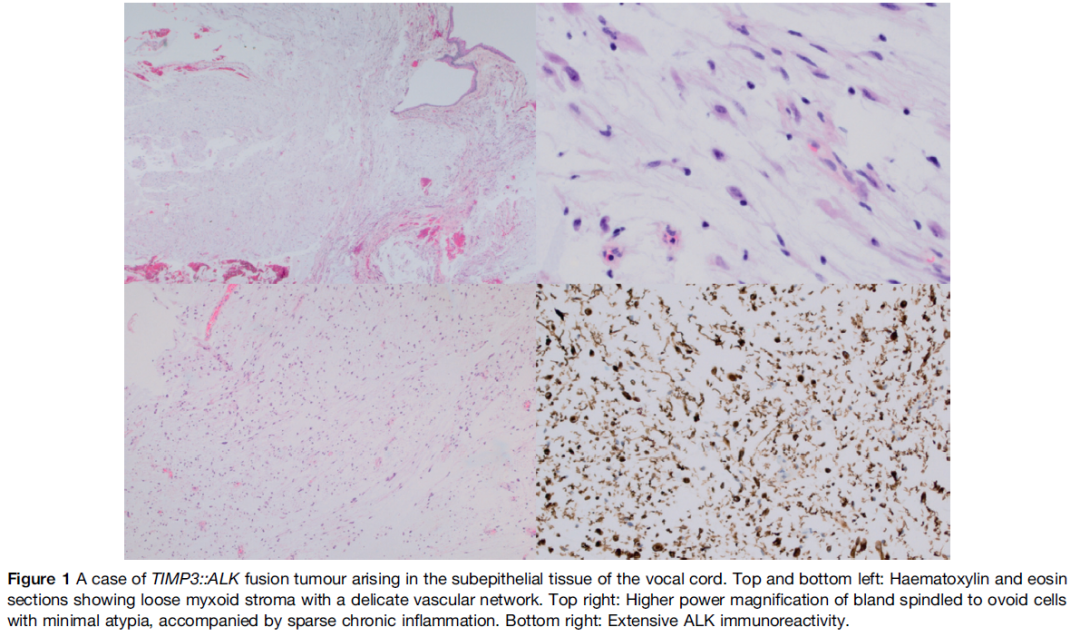
图1
与IMT不同,已报道的TIMP3::ALK融合肿瘤可见明显的异型细胞,表现为核仁突出、核内及胞质内空泡多见。部分病例中可见神经节样细胞——这一特征此前在IMT的形态谱系中被描述过,也可见于其他肌成纤维细胞/成纤维细胞性间叶肿瘤(如增生性筋膜炎)。TIMP3::ALK融合肿瘤还缺乏IMT中典型的显著混合性炎症浸润。大多数肿瘤不表达SMA,这也与IMT不同。
大多数TIMP3::ALK融合为TIMP3的第1外显子与ALK的第12外显子融合,一个系列中少数病例为TIMP3的第3外显子与ALK的第18外显子融合。随访结果显示,肿瘤行为温和,无转移或致死病例,但1例在初始切除后14年出现晚期复发。
梭形细胞/硬化性横纹肌肉瘤(重点关注携带TFCP2重排的肿瘤)
头颈部是成人梭形细胞/硬化性横纹肌肉瘤(SRMS)最常见的发生部位,WHO分类现已根据分子特征将其分为三个主要亚型。 先天性/婴儿型SRMS存在涉及VGLL2、SRT、TEAD2、NCOA2和CITED2的基因融合。这类肿瘤多见于儿童患者,与更常见于成人的亚型不同,它们并不偏好发生于头颈部。第二类SRMS以MYOD1 p.Leu122Arg基因突变为特征,多见于青少年、青年,较少见于老年人。这类肿瘤行为具有侵袭性,因此肿瘤学共识指南推荐采用高危方案治疗。第三类为无基因变异的SRMS。
近期描述了一类新的骨内和软组织SRMS,存在以下反复出现的基因融合:1)EWSR1::TFCP2或FUS::TFCP2;2)MEIS1::NCOA2。大部分TFCP2重排肿瘤发生于头颈部。在Dehner等发表的迄今最大系列中,17例涉及TFCP2融合的病例中,6例(35%)发生于颅面骨。作者发现,FUS-TFCP2 SRMS有两种主要形态变异型:一种是具有梭形和上皮样特征的未分化恶性肉瘤,另一种较少见,为相对单一形态的梭形至上皮样细胞肿瘤(图2),伴广泛玻璃样变。免疫组化显示,肿瘤表达结蛋白(软组织肿瘤中可能为局灶性)和MyoD1,通常表达ALK,较少表达肌生成素,部分病例表达角蛋白。
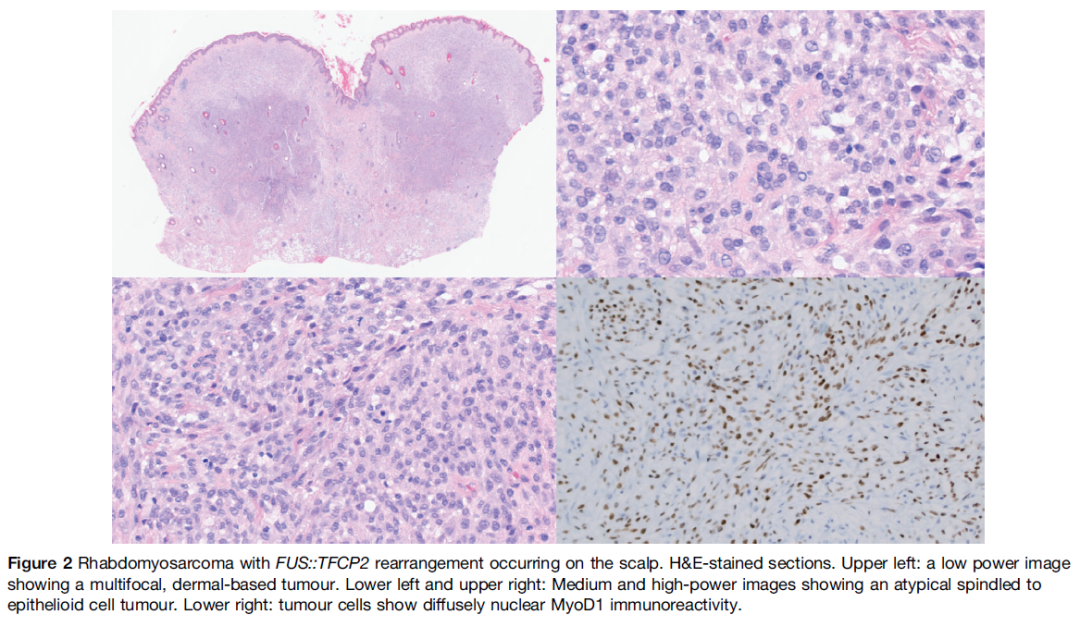
图2
这类TFCP2重排肿瘤有两个可能导致诊断误导的特征。部分肿瘤表达角蛋白,如Dehner等所指出的,这可能导致与肉瘤样癌(如头颈部的肉瘤样癌)的鉴别诊断困难。其次,这些肿瘤通常免疫组化表达ALK,这可能具有误导性,因为其并非源于潜在的ALK融合。
Kerr等强调了基因谱分析在鉴别IMT与FUS::TFCP2重排肿瘤中的重要性。作者报道1例患者因ALK免疫阳性而接受了不必要的克唑替尼治疗,随后基因谱分析显示存在FUS::TFCP2融合。回顾性分析发现,该肿瘤表达结蛋白、MyoD1和肌生成素。作者认为,由于结蛋白不具有鉴别意义,在遇到类似的ALK阳性梭形细胞肿瘤时,应谨慎进行MyoD1和肌生成素免疫组化检测。
TFCP2重排肿瘤中ALK表达的机制此前被解释为:ALK的第19内含子存在新的替代性转录起始(ATI)位点,这不仅导致ALK蛋白表达,还可能导致ALK荧光原位杂交(FISH)中5'信号出现非典型的纯合缺失模式。
FUS::TFCP2 SRMS是一种侵袭性实体,Dehner等报道其骨内肿瘤系列中,16例患者中有2例(13%)出现局部复发,8例(50%)出现远处转移;综合迄今发表的其他系列,有临床随访数据的患者中,53%死于该病,33%存在持续性/不可切除的病变。
EWSR1::POU2AF3肉瘤
伴EWSR1::POU2AF3融合的肉瘤是罕见的梭形细胞和圆形细胞肿瘤,特别好发于头颈部,尤其是鼻窦区。POU2AF3也称为COLCA2,最初因与结直肠癌的突变相关而被描述。这类肉瘤由Agaimy等人首次报道,其特征经Hiemenz等人进一步阐明,最近Koshyk等人也对其进行了研究,并综述了迄今发表的病例。
在迄今发表的三个系列研究中,19例病例中有13例发生于头颈部,其中9例明确位于鼻窦区。其他病例见于软组织和骨的多个部位。患者人群以中老年为主,无性别偏好。
Koshyk等人发现,这些EWSR1::POU2AF3融合肿瘤有两种主要形态变异型:一种是相对温和的梭形细胞肿瘤;另一种是高级别梭形细胞和圆形细胞肉瘤,特征类似于双相型滑膜肉瘤或神经内分泌癌,圆形细胞区域常可见点状染色质。免疫组化显示,这些肿瘤表达多种标志物,包括S100、细胞角蛋白、GFAP、CD99(膜阳性)、神经内分泌标志物(CD56、突触素、嗜铬粒蛋白和INSM1),1例在横纹肌母细胞样形态区域表达肌源性标志物。有报道称SATB2也可阳性,但我们认为其并非有用标志物。
涉及EWSR1(或FUS)的融合断点位于不同外显子,而POU2AF3的断点始终位于第2外显子。有趣的是,在Koshyk等人的系列研究中,4例发生于鼻窦区的病例,其EWSR1断点位于第14-16外显子,而鼻窦外部位的病例断点则位于第9或10外显子。
EWSR1::POU2AF3融合肿瘤通常表现为高级别肉瘤,18例有随访数据的已发表病例中,9例发生转移。部分患者在初始治疗后10年和23年出现转移性疾病,这表明该实体需要长期监测。Koshyk等人总结的现有预后数据显示,5年无局部复发生存率为48%,无转移生存率为54%。
伴EWSR1::PATZ1融合的肉瘤
这类罕见肉瘤为梭形细胞和圆形细胞肉瘤,具有多表型特征。肿瘤好发于胸腹软组织,但也有发生于颈部软组织、颌骨和舌的病例报道。
EWSR1::PATZ1肉瘤可见于广泛年龄范围(从儿童到老年人),已发表系列的中位年龄为47.5岁,男性发病率约为女性的两倍。在迄今最大的系列研究中,Dehner等人总结了其系列及既往报道病例的形态特征。大多数肿瘤边界清楚,伴有蘑菇状浸润区。典型表现为粗大的纤维间隔将肿瘤分隔成小叶和巢状结构,架构多样,包括实性、束状和微囊状。细胞密度多为中至高度,由不同比例的三种细胞组成:(1)小圆形‘血管球样’细胞,胞质透亮至淡嗜酸性;(2)小梭形细胞,胞质淡嗜酸性、呈纤维状;(3)较大的上皮样细胞,胞质嗜酸性。图3显示了梭形细胞和圆形细胞混合的肿瘤,但肿瘤也可完全由较大的上皮样细胞组成。少数肿瘤显示明显核异型性,大多数病例核分裂活性低,无坏死。
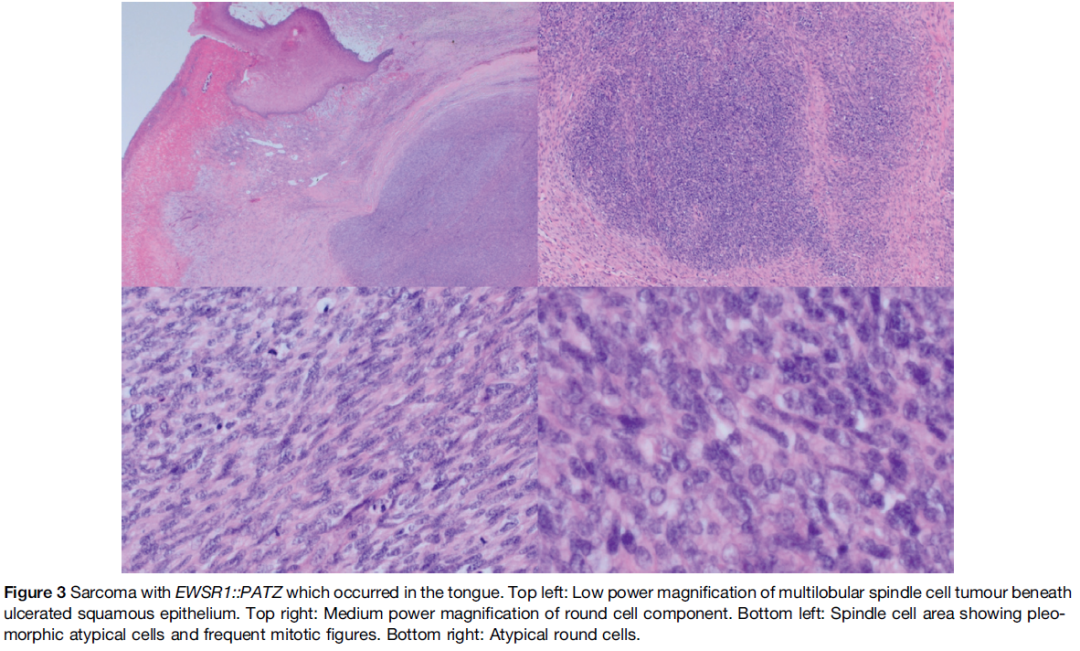
图3
迄今发表的所有病例的免疫组化特征相似:大多数表达GFAP、结蛋白和MyoD1,少数病例表达S100、SOX10和肌生成素。H3k27me3表达保留,约60%的病例至少局灶表达细胞角蛋白。
Dehner等人指出的潜在诊断陷阱包括:角蛋白与GFAP、S100或SOX10共表达,可能导致误诊为肌上皮肿瘤;肌源性标志物表达可能导致误诊为横纹肌肉瘤。此外,EWSR1 FISH对诊断EWSR1::PATZ1肉瘤无帮助,因其可能由隐匿性臂内倒位形成。这是由于EWSR1和PATZ1基因座位于22号染色体上,相距仅2 Mb,难以解读分离信号。
GLI1变异软组织肿瘤
GLI1变异软组织肿瘤于2023年首次被纳入WHO头颈部肿瘤分类(第5版)。头颈部是该肿瘤的第二常见发病部位,占迄今已发表病例的28%。最初描述GLI1变异肿瘤的系列病例显示具有独特的形态学表现,当时被称为“伴t(7;12)的血管周细胞瘤”,存在反复出现的ACTB::GLI1融合。
随着时间推移,GLI1变异肿瘤的诊断范畴已扩展至包括GLI1扩增和GLI1重排的肿瘤,最常见的融合伴侣为ACTB,较罕见的融合伴侣包括PTCH1、MALAT1和DERA。值得注意的是,MALAT1::GLI1融合也见于两种形态学独特的实体瘤中,这些肿瘤主要位于胃,即胃母细胞瘤和丛状纤维黏液瘤。
GLI1变异软组织肿瘤的形态学表现多样,但共享一些形态特征,包括相对温和的卵圆形、上皮样或梭形细胞,以及伴明显血管周生长的分叶状结构。Papke等人将一部分肿瘤描述为“独特的巢状血管球样肿瘤”,其典型表现为温和的血管球样细胞排列成巢状和小梁状,细胞学异型性极小,核分裂率低,无坏死。图4显示1例具有类似形态的病例。作者描述该亚群GLI1变异肿瘤行为温和,并认为这组肿瘤不应被视为肉瘤。
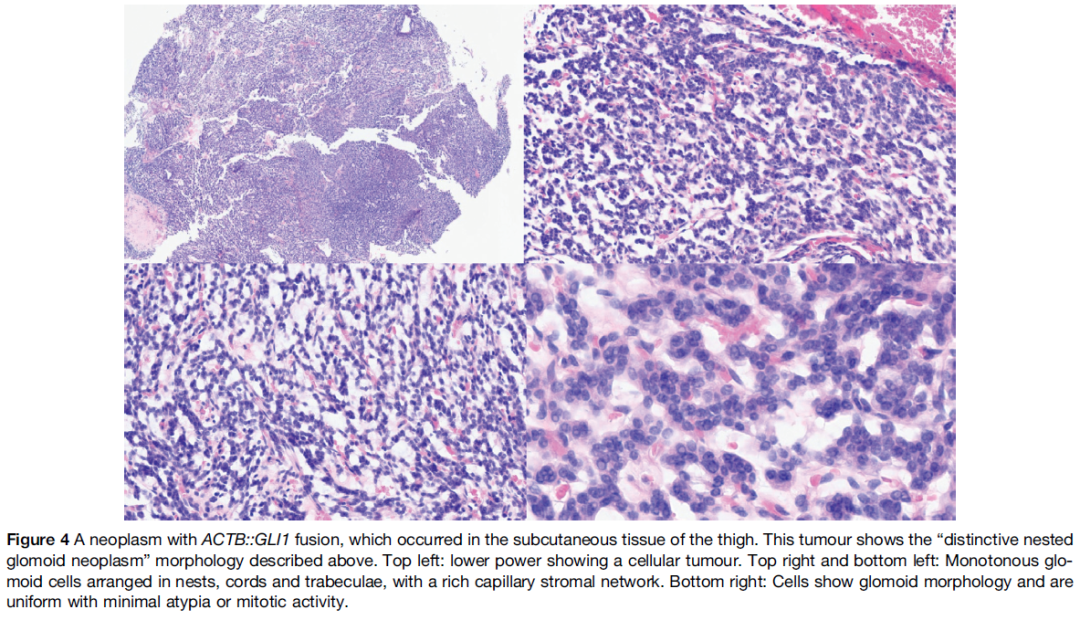
图4
Kerr等人报道了16例具有ACTB或MALAT1基因伴侣的GLI1融合肿瘤,其中2例局部复发,1例转移,因此提出将其命名为“具有恶性潜能的GLI1变异间叶性肿瘤”。
Saoud等人发表的最大单中心系列研究对比了23例GLI1扩增和15例GLI1重排肿瘤,发现两者形态特征相似,均为巢状上皮样细胞(较少为梭形细胞),伴丰富的血管网。相比之下,GLI1重排肿瘤体积更大,发生于更年轻的患者,而GLI1扩增肿瘤的总生存期和无进展生存期更差。在两组中,肿瘤大小>5 cm、核分裂率>4/10高倍视野及存在肿瘤坏死均与更差的预后相关。
GLI1变异肿瘤的免疫组化无特异性,大多数肿瘤表达CD56,部分亚群表达SMA、S100、CD10、cyclin D1和细胞角蛋白。GLI1免疫组化已被证明在检测GLI1异常肿瘤中具有高度敏感性和特异性,近期研究表明p16过表达可能是GLI1扩增(而非GLI1重排)肿瘤的有用预筛查指标。
GLI1扩增的肿瘤往往伴随12q上其他基因的共扩增,包括MDM2、CDK4和STAT6,这些可通过FISH检测到,且可能显示相应的免疫反应性。此类FISH和免疫组化结果可能构成诊断陷阱,但可通过基因谱分析解决。
随着肿瘤发生的分子驱动因素被发现并与形态学实体相关联,间叶性肿瘤的分类正在发生变化。
“实体瘤1560基因融合RNA检测”项目,基于RNA-based NGS测序+杂交捕获建库技术,检测覆盖ALK、EWSR1、FUS、NCOA2和GLI1等超过1560种已知融合和数百个基因相关的未知融合,同时“骨与软组织肿瘤272基因检测”、“骨与软组织肿瘤1308基因检测”项目基于DNA层面检测多种变异类型,辅助间叶肿瘤的鉴别诊断,评估预后和指导治疗等。
参考文献:
Spindle cell mesenchymaltumours of the head andneck: emerging andrecently describedentities characterised bymolecular findings
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)