首页 > 医疗资讯/ 正文
根据美国临床肿瘤学会(ASCO)和欧洲肿瘤内科学会(ESMO)的指南,乳腺癌诊断和治疗中最重要的遗传因素是BRCA1和BRCA2基因的突变状态。遗传 panel 筛查中还纳入了其他对癌症风险有显著影响的基因。对于这些基因,疾病风险评分预测大于20%。在临床实践中观察到,罕见遗传变异在年轻患者中具有显著影响,其特点是发病机制增强和总体预后较差。预测这些罕见变异的潜在影响可能揭示有关可能表型的重要信息,也可能提供新的见解,从而促成更有效的治疗和整体改善的临床管理。本文报告了一例 38 岁双侧乳腺癌女性患者,携带LZTR1基因致病性点突变(LZTR1:c.1260+1del变异)。通过本文描述的这个临床病例报告,旨在展示在乳腺癌患者的遗传诊断领域进行详细分子检测的意义。了解遗传性癌症发展的发病机制——比散发性肿瘤更可预测和可靠——将有助于发现迄今隐藏的内在信号通路,促进可重复的实验,从而加速新型治疗方法的发现。
背 景
乳腺癌的遗传学
就全球女性发病率和死亡率而言,乳腺癌已被认定为最常见的癌症类型。教育计划和组织良好的诊断(包括筛查计划)加上额外的治疗方案,显著提高了女性乳腺癌患者的医疗保健质量。然而,根据预测,乳腺癌的发病率正在以每年的速度增长。有人推测这可能与环境对该疾病产生的巨大影响有关。根据Murthy等人的研究结果,早期诊断在降低恶性肿瘤死亡率方面不如早期预防有效。尽管如此,在适当的评估范围内进一步研究高影响预后因素可能会改善肿瘤学的临床管理。
有遗传性乳腺癌和/或卵巢癌风险的个人应每年定期进行超声诊断。此外,高危患者可能需要通过乳房X光照射和/或乳腺磁共振成像进行进一步评估。如果诊断不明确,可以考虑进行诊断性活检。根据世界卫生组织(WHO)的指导意见,治疗策略取决于疾病分期和恶性细胞的激素状态。乳腺癌治疗的金标准是手术,包括部分切除术或乳房切除术。如果通过高危基因的分子检测确定患者罹患乳腺癌的风险较高,则可能建议进行预防性乳房切除术。全身治疗包括化疗药物和/或内分泌治疗。该治疗方案可在术前或术后管理中进行。根据美国国家综合癌症网络(NCCN)的现行指南,确诊为局部晚期或无法手术的乳腺癌(cN2腋窝淋巴结;cN3区域淋巴结疾病;cT4肿瘤)患者可能有资格接受术前全身治疗。疾病进展阶段和以下三种主要激素受体的表达水平在预测疾病病程中起着重要作用:人类表皮生长因子受体(HER-2)、雌激素受体(ER)和孕激素受体(PR)(乳腺癌风险因素如图1所示)。
约 10%-15% 的乳腺癌病例与遗传易感性相关,而大多数确诊病例仍为散发性。在遗传性乳腺癌的情况下,家族内疾病的发生表明存在遗传易感性,通常归因于相关基因的特定突变。BRCA1和BRCA2突变携带者的乳腺癌风险最高。这些基因的胚系突变已被证明会增加乳腺癌和卵巢癌综合征的发病风险。对大样本群体中存在的胚系突变的综合分析已导致发现与疾病阶段相关的其他变异。具有高外显率和乳腺癌易感性作用的基因包括肿瘤蛋白53基因(TP53)、磷酸酶和张力蛋白同源基因(PTEN)钙粘蛋白1基因(CDH1)和丝氨酸/苏氨酸激酶11基因(STK11)。在中等外显率基因类别中,已确定以下基因:共济失调毛细血管扩张突变基因(ATM)、BRCA1相关RING结构域1(BARD1)、检查点激酶2(CHECK2)、BRCA2基因的伴侣和定位器(PALB2)、RAD51C和RAD51D基因。这些基因经常被纳入基因panel检测,用于诊断筛查。基因检测的一个重要部分是关于人群遗传同质性的知识。特定等位基因的频率在人口同质性较高或较低的国家可能不同。波兰作为一个国家具有高度的同质性。因此,基因检测结果的解释应个体化。这突出了制定考虑遗传同质性的特定预测和诊断类别的必要性。LZTR1基因尚未被纳入遗传性乳腺癌-卵巢癌综合征的标准基因panel,因为其频率低且在疾病发展中的状态未得到证实。
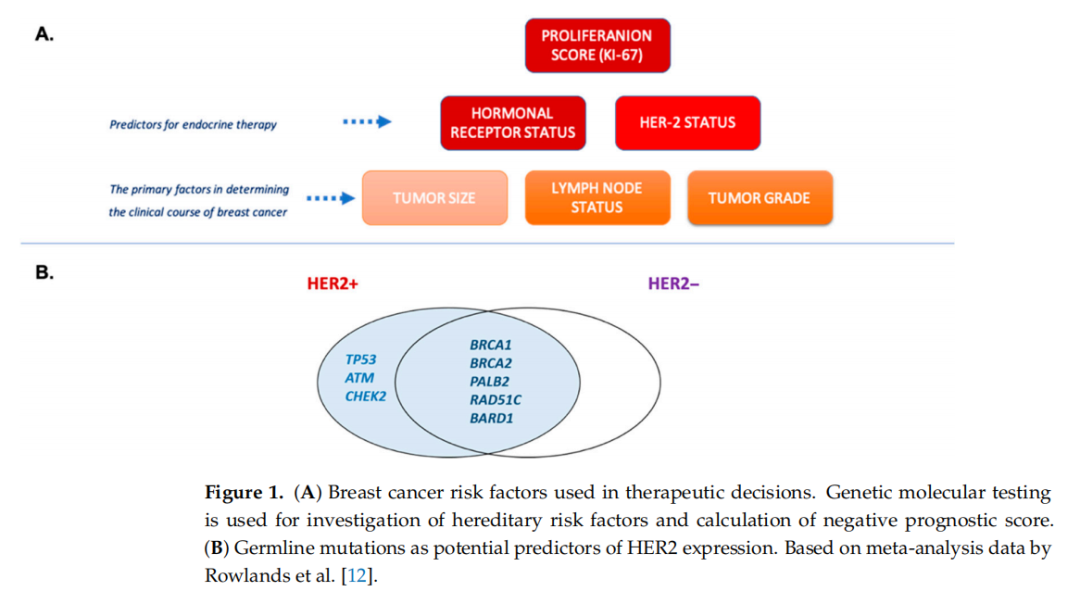
▲图1 (A)用于治疗决策的乳腺癌风险因素;(B)胚系突变作为HER2表达的潜在预测因子
由于已证实的遗传性癌症综合征风险,LZTR1基因被纳入扩展的NGS肿瘤panel。此外,已证实LZTR1的罕见变异与不同癌症类型(胶质母细胞瘤、肝细胞癌、食管胃癌、结直肠癌和肺癌)有关,包括乳腺癌。对细胞培养和动物模型的功能研究揭示了LZTR1突变可能驱动的致癌机制。在Gen2Phenotype数据库中,描述了LZTR1参与遗传性乳腺癌的信息(ID:G2P03479)。但关于与疾病相关的基因变异尚无明确信息。
LZTR1致病性变异主要与神经鞘瘤病和努南综合征相关。症状开始的中位年龄为 30 岁,而疾病诊断通常在 40 岁以上得到确认。基于这些数据,可以假设具有罕见LZTR1致病性变异的患者可能在 50 岁前出现疾病症状。为了正确预测表型,非常需要流行病学研究。TCGA和相关数据集可用于支持乳腺癌患者中LZTR1突变频率的研究。cBioPortal上的乳腺浸润性癌(TCGA,Firehose Legacy)开放获取数据集显示,LZTR1在乳腺浸润性导管癌和/或乳腺浸润性小叶癌中是更典型的突变基因。突变频率低于 2%。相比之下,40岁以下被诊断为乳腺癌的患者中,TP53基因胚系遗传变异的确诊变异患病率约为 5%。白人种族人群更有可能携带LZTR1基因突变,且经常在 40 岁以下被诊断。
根据gnomAD数据(访问日期:2025 年 6 月 27 日),LZTR1 c.1260+1del变异的总等位基因频率为 0.000001888,处于10−4 >(0.1888 × 10−5)> 10−6的范围内。基于独立遗传变异的Bonferroni检验阈值,适当的p值<5×10−7。因此,关于所述变异的当前可用数据应加以完善。人类基因组多样性(HGDP)的群体等位基因频率对此变异不可用。
LZTR1蛋白的生物学作用
LZTR1是一种肿瘤抑制基因,编码亮氨酸拉链样翻译后调节因子(LZTR1)蛋白,该蛋白属于BTB-Kelch超家族。LZTR1是一种高尔基体蛋白,据报道参与细胞凋亡过程。根据UniProt数据库中的可用数据,LZTR1蛋白(Q8N653)间接调节Ras家族蛋白的泛素化。因此,由于Ras/MAPK信号通路的减弱,该蛋白起到Ras/KRAS、N-RAS和H-RAS蛋白的负调控因子作用。具有功能活性的LZTR1蛋白与Cullin-3泛素连接酶复合物(CUL3)形成复合物,进而促进Ras蛋白的泛素化。Kelch结构域由六个β-折叠叶片或重复序列组成,位于LZTR1的N端;C端则包含两个由BACK结构域分隔的BTB结构域。BTB结构域具有保守结构,可在同源二聚化中相互作用。除了参与高尔基体的整合外,BTB结构域可能在LZTR1-E3-CUL3复合物的形成和稳定过程中发挥重要作用。Kelch结构域负责底物结合和调节E3活性。这些结构域能够结合不同的细胞蛋白,表明Kelch蛋白可能参与多种疾病的发生发展。在胚胎发育期间,LZTR1蛋白在肺、肝、肾、脑和心脏中表达。LZTR1蛋白的组织特异性表达取决于发育阶段(图2)。在成人中,该蛋白主要存在于血管和免疫系统中。根据转录组表达图谱(Expression Atlas),乳腺中无显著的LZTR1蛋白表达。然而,在乳腺癌患者(男女均有)中证实了LZTR1在转录水平的表达,但其状态因在研究人群中的频率极低而被认为在疾病发病机制中无显著作用。表达图谱中关于不同细胞系和细胞类型研究的补充信息显示,在选定的恶性和正常细胞系中,LZTR1在转录组和蛋白质组水平呈中等表达。
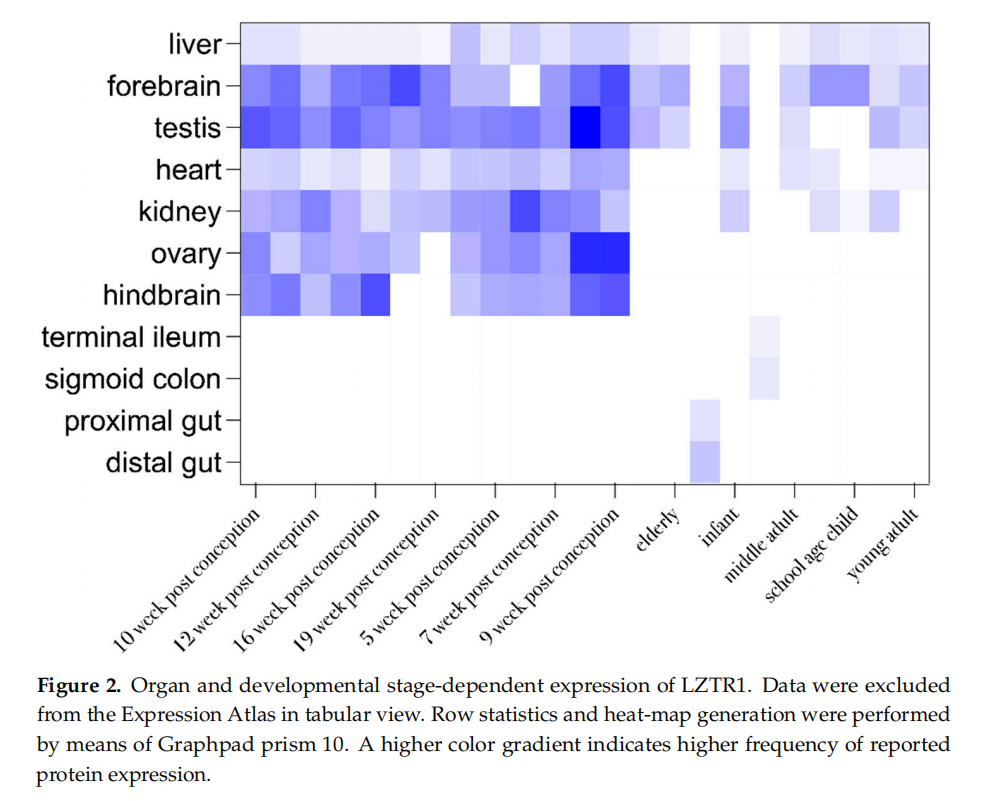
▲图2 LZTR1的器官和发育阶段依赖性表达
本文报告了一例 38 岁波兰女性双侧乳腺癌病例,该患者有癌症家族史。患者被发现是亮氨酸拉链样翻译后调节因子1基因(LZTR1)点突变的携带者。目前尚无关于该遗传变异分子后果的信息。在本研究中,研究人员使用生物信息学工具预测该变异的致病性,以进一步阐明该病例中癌症发展的分子基础。关于遗传背景的知识可能会促成新的预测因子分类的发现,并强调癌症中基因变异研究的必要性。
病 例
患者女,38 岁,因双侧乳腺癌(同时性)就诊于MEDGEN遗传门诊。既往无慢性病史。病史采集显示:未生育;无口服激素类避孕药使用史;有遗传性癌症家族史可能。患者家族癌症病史如下:母亲 62 岁时诊断为结肠癌;父亲 47 岁时疑似肾癌,已去世(图3)。对左侧乳腺肿瘤及病理改变淋巴结进行了穿刺活检。病理医师结论为浸润性乳腺癌,非特殊类型(根据WHO 2018年分类标准);采用Elston-Ellis改良版Bloom-Richardson分级系统评估恶性程度为(3+2+1=6)G2级。肿瘤样本的免疫组化检查显示:雌激素受体(ER)表达阳性(100%,Allred评分:比例评分5分+强度评分3分=总评分8分),孕激素受体(PR)表达阳性(100%,Allred评分:比例评分5分+强度评分3分=总评分8分),人表皮生长因子受体2(HER2)表达阴性(0%)。增殖指数呈高度阳性,Ki67>30%。组织病理学亚型为Luminal B型(HER2阴性)浸润性癌,按TNM分期为cT4N2Mx期。右侧乳腺穿刺活检的病理结果为浸润性非特殊类型癌(NST G2级),Luminal A型,ER、PR均100%阳性,HER2阴性,Ki67<14%,临床分期为cT1bN0Mx期。活检后约 14 天,患者接受了胸部、腹腔及盆腔CT扫描,检查显示左腋窝淋巴结转移;骨骼中散在多发稍模糊、密度较低的硬化灶——主要位于脊柱和骨盆带——其中L3椎体可见直径 10 mm的最大病灶,极可能为转移灶。进一步行骨显像检查显示多发播散性骨转移(位于脊柱、肋骨、骨盆、左肱骨及股骨)。患者未行手术治疗接受的治疗方案如下唑来膦酸 4 mg静脉注射每周期一次;细胞周期蛋白依赖性激酶4/6(CDK4和CDK6)抑制剂阿贝西利 150 mg口服每日两次;内分泌治疗依西美坦 2.5 mg每日口服;戈舍瑞林 3.6 mg皮下注射每 28 天一次。不幸的是,尽管接受了治疗,病情仍迅速恶化。患者在治疗开始后 6 个月去世。
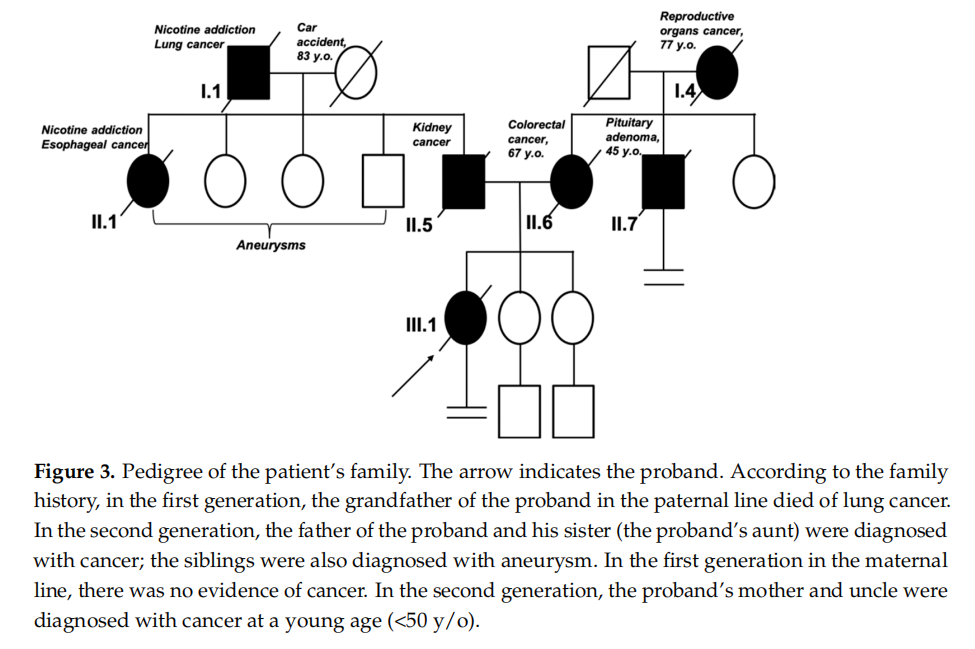
▲图3 患者家系
研究结果
分子诊断
研究人员在LZTR1基因的一个等位基因中发现了c.1260+1del变异(杂合型)。根据gnomAD数据库,该变异是一种移码突变,无胚系分类(22-20992903-AG-A,GRCh38版本)。ClinVar数据库中未收录该变异。Franklin工具对LZTR1变异(LZTR1:c.1260+1del)的分析提示其分类为可能致病性。Orphanet数据库中尚无关于该LZTR1变异体临床意义的报告。
基因变异的生物信息学分析
-
致病性评估
LZTR1基因位于22号染色体q11.21区,开放阅读框(ORF)包含 21 个外显子。该基因含有可能发挥重要调控作用的misc_features序列(指生物学特性无法用特性表关键词描述的序列)。其中一个misc_features序列被定义为淋巴母细胞沉默区,已被描述为GM12878淋巴母细胞的沉默子,其他序列的生物学影响尚未明确。LZTR1基因共有 7 个misc_feature区域,其中一个区域与第 11 号外显子的突变位点重叠。根据gnomAD数据,c.1260+1del变异体在 3 名欧洲人(非芬兰裔)中被发现,包括 2 名男性和 1 名女性。该变异体已在基因组和转录组水平被描述。单核苷酸缺失导致移码突变,极可能引起功能丧失(LoF),但根据gnomAD数据(访问日期:2025 年 3 月 6 日),其未被明确归类为剪接位点突变。目前尚无关于LZTR1:c.1260+1del变异的表型描述。所分析变异的图示见图4。
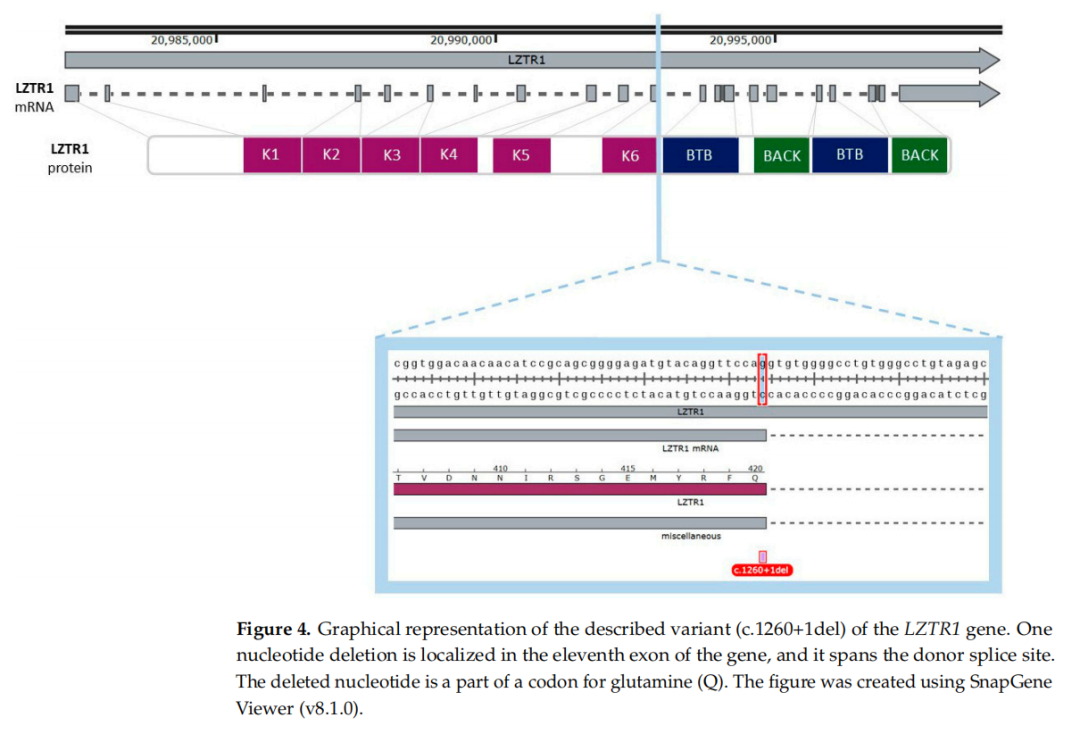
▲图4 本文报道的LZTR1基因变异
后续研究人员检测了可能的转录本和蛋白质结构。值得注意的是,该突变涉及外显子最后一个核苷酸的缺失,这可能导致剪接障碍。mRNA中的1260位与gnomAD中描述的位置不同。为找出位置差异的原因,使用Clustal Omega序列比对工具(v1.2.4版)对两个序列进行了比较。结果显示LZTR1基因的ccds序列全长具有序列相似性,详见图5。共识编码序列(consensus coding sequence)对蛋白质编码序列的预测等级更高,目前已整合到主要数据集中。
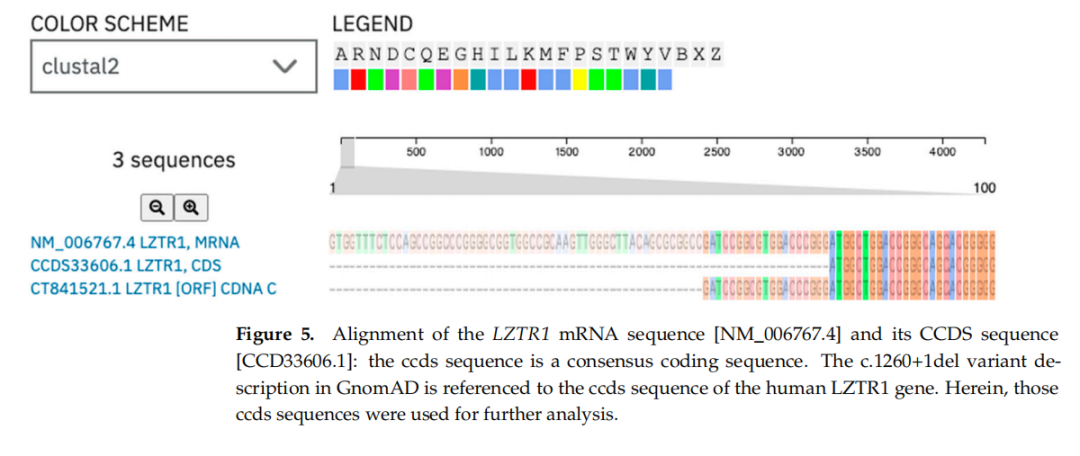
▲图5 LZTR1 mRNA序列[NM_006767.4]与其CCDS序列[CCD33606.1]的比对结果
通过Expasy的Variant Effect Predictor工具分析发现,大多数转录本被归类为基因上游变异、基因下游变异或剪接供体变异(图6)。
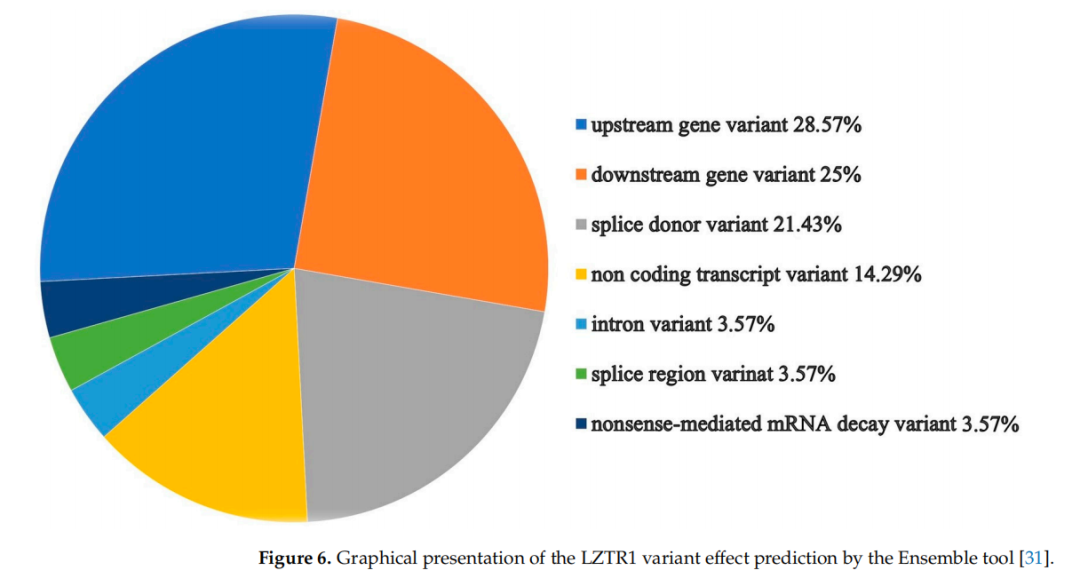
▲图6 Ensemble工具对LZTR1变异效应预测
-
遗传变异对剪接影响的分析
在HSF GenOmnis对LZTR1基因c.1260+1del变异的分析中,发现了三个新的隐蔽供体位点。该缺失未涵盖天然剪接供体位点(图7)。这些结果提示基因转录本形成的几种可能性,具体如下:剪接过程中发生移码突变,或选择新的隐蔽供体位点之一。MutationTaster分析显示剪接位点改变和移码突变。移码突变的预测结果与HSF GenOmnis的结果相似(表1)。SpliceAI对该变异体的检测证实了供体剪接位点的丢失和新供体剪接位点的获得。
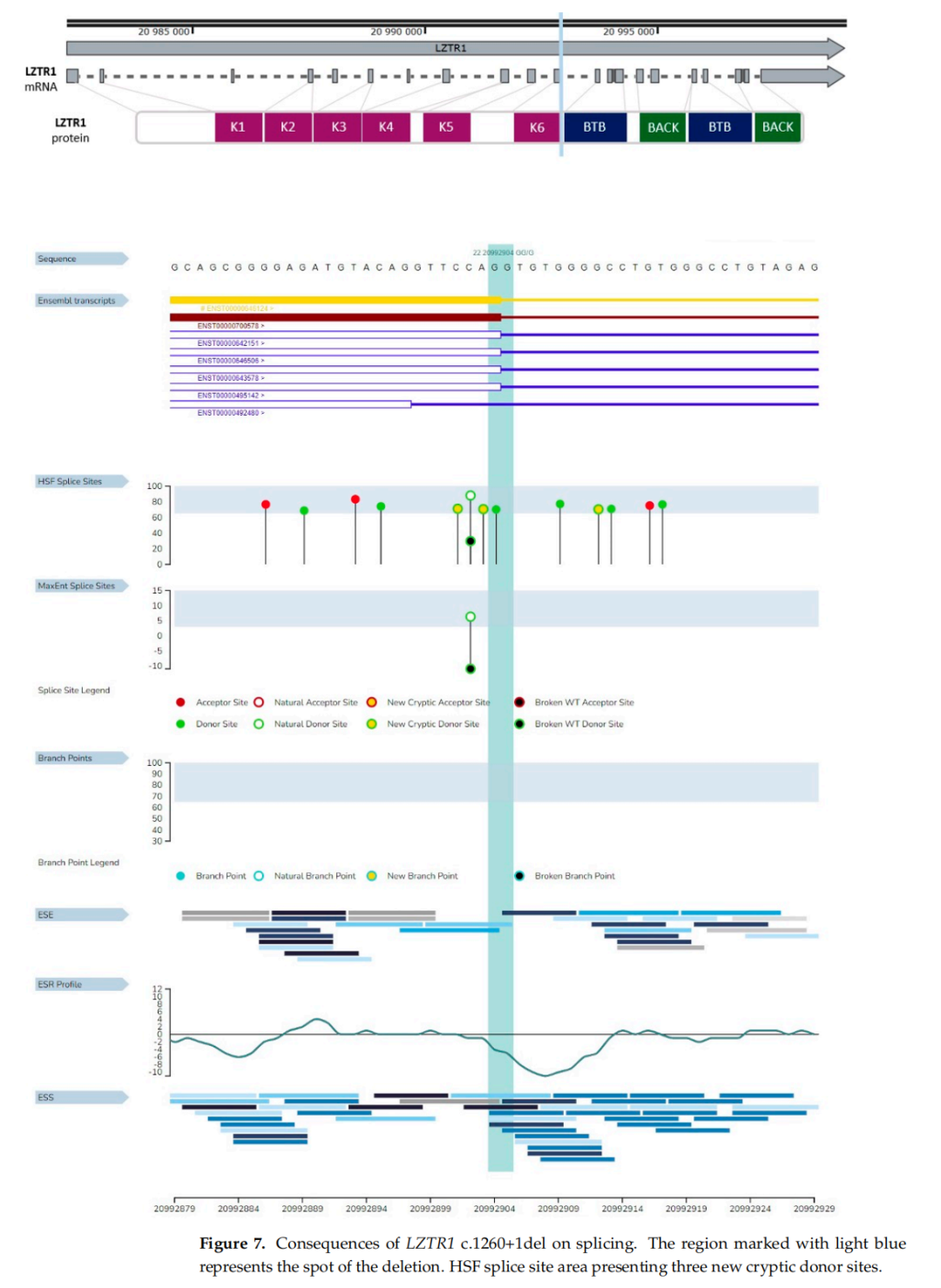
▲图7 LZTR1 c.1260+1del对剪接的影响

▲表1 HSF GenOmnis和MutationTaster预测的LZTR1 c.1260+1del新供体剪接位点
通过BDGP的神经网络剪接位点预测工具(BDGP: Splice Site Prediction by Neural Network)对剪接位点的检测显示,所分析的变异体与LZTR1基因的参考序列具有相同的剪接位点。该结果证实移码突变是所分析变异体的分子效应类型。
-
基因变异转录本预测、蛋白质结构设计和评估
在Ensemble数据库中,野生型(WT)LZTR1蛋白的数据定义了四种蛋白质编码转录变异,其结构如图8所示。
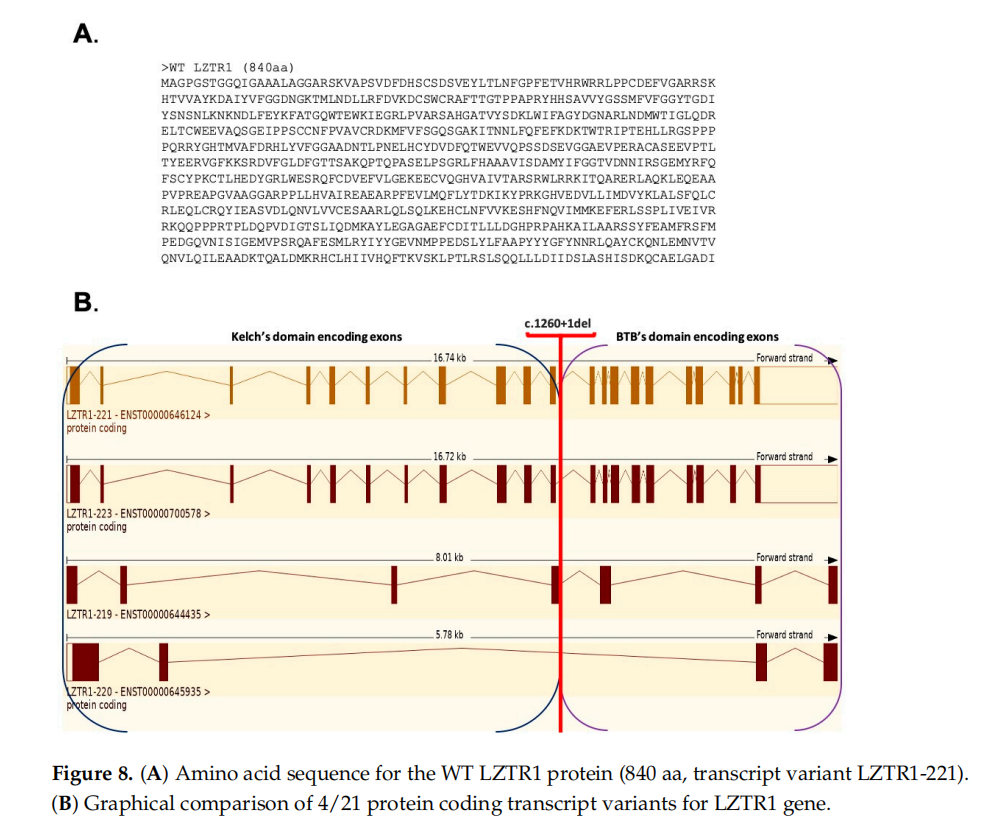
▲图8 (A)野生型LZTR1蛋白的氨基酸序列;(B)LZTR1基因4/21个蛋白质编码转录变异的图形比较
Prosite和Smart工具在野生型、MT1、MT2、MT3和MT4蛋白的氨基酸序列分析中仅识别出BTB结构域。Prosite工具用于在分析序列中识别Kelch和BTB结构域,其分析结果与数据库中包含的野生型LZTR1蛋白信息具有最高相似度得分。因此,Prosite收集的数据被用于比较预测蛋白质的结构元件(表2)。
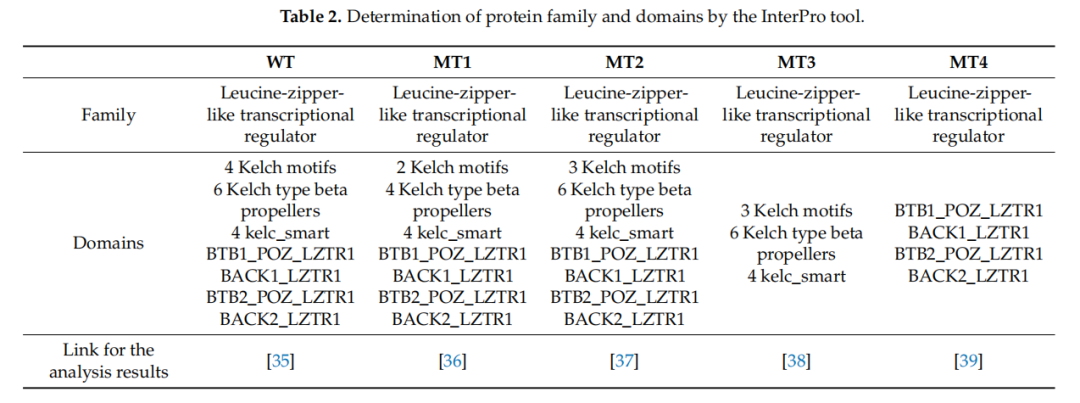
▲表2 通过 InterPro工具确定蛋白质家族和结构域
野生型蛋白通过使用LZTR1每个外显子中的剪接位点构建而成。InterPro分析显示四个Kelch基序、六个Kelch型β螺旋桨结构、四个Kelch smart结构域、两个BTB结构域和两个BTB back结构域。在现有数据库中,野生型LZTR1结构由六个Kelch基序组成(图9)。Prosite工具用于蛋白质结构的初步比较。
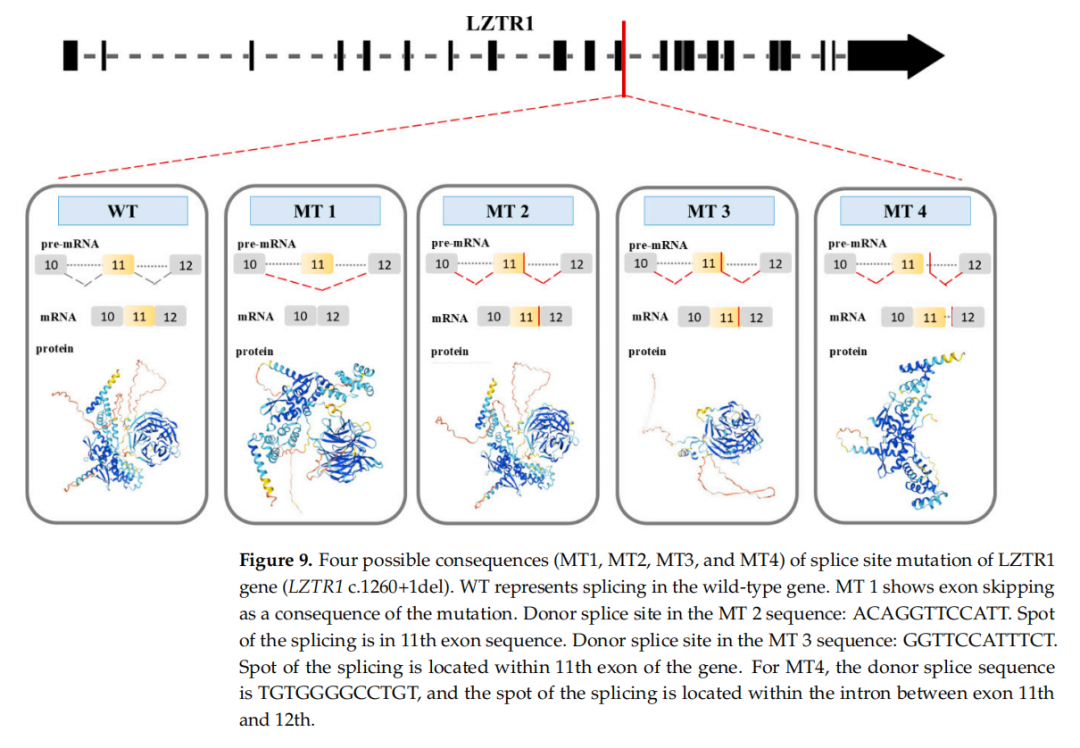
▲图9 LZTR1基因(LZTR1 c.1260+1del)剪接位点突变的四种可能结果(MT1、MT2、MT3和MT4)
在MT1前体mRNA的剪接过程中,第11外显子的序列被删除。因此,MT1蛋白具有两个BTB结构域和一个Kelch结构域,其中Kelch结构域包含两个Kelch基序和四个Kelch型β螺旋桨结构。对于MT2的剪接,使用了第11外显子上的新剪接供体位点(ACAGGTTCCATT)。MT2蛋白具有一个BTB结构域和一个Kelch结构域,后者包含三个Kelch基序和六个Kelch型β螺旋桨结构(图9)。MT1和MT2极有可能保留了与野生型蛋白结构相似的N端和C端结构。但MT1和MT2的蛋白结构中Kelch基序的数量与野生型不同,因此Kelch基序氨基酸序列的缺失导致了Kelch结构域功能异常。Kelch结构域并不参与底物泛素化结合过程的初始步骤。C.L.Philips等人的研究结果表明,Kelch结构域中的每个基序都是蛋白质正常功能所必需的,缺失其中一个基序可能导致蛋白质功能异常。
在MT3中,剪接过程使用了11外显子内的新剪接供体位点(GGTTCCATTTCT)。MT3蛋白结构包含N端和C端结构域,其Kelch结构域具有三个Kelch基序和六个Kelch型β螺旋桨结构(图9)。BTB结构域的缺失使MT3无法与E3连接酶复合物相互作用,因此与Kelch结构域结合的蛋白质无法被蛋白酶体靶向降解。此外,其中一个Kelch基序的缺失也会导致结构域功能异常。
位于11和12外显子之间内含子中的新剪接供体位点(TGTGGGGCCTG)可产生MT4蛋白。该蛋白包含两个BTB结构域(图9),并具有明确的N端和C端结构域。尽管MT4蛋白仅由BTB结构域组成,能够与E3连接酶复合物相互作用,但由于缺乏Kelch结构域,无法标记任何蛋白质进行降解。MT1、MT2、MT3和MT4的部分结构保留表明,这是一种功能丧失(LoF)突变,导致功能性蛋白缺失。
基因相关表型分析
已报道数据的分析结果如表3所示。与LZTR1变异体相关的表型主要包括努南综合征(Noonan Syndrome)和神经鞘瘤病(Schwannomatosis)。仅Orphanet数据库额外报道了胶质母细胞瘤(glioblastoma)表型。
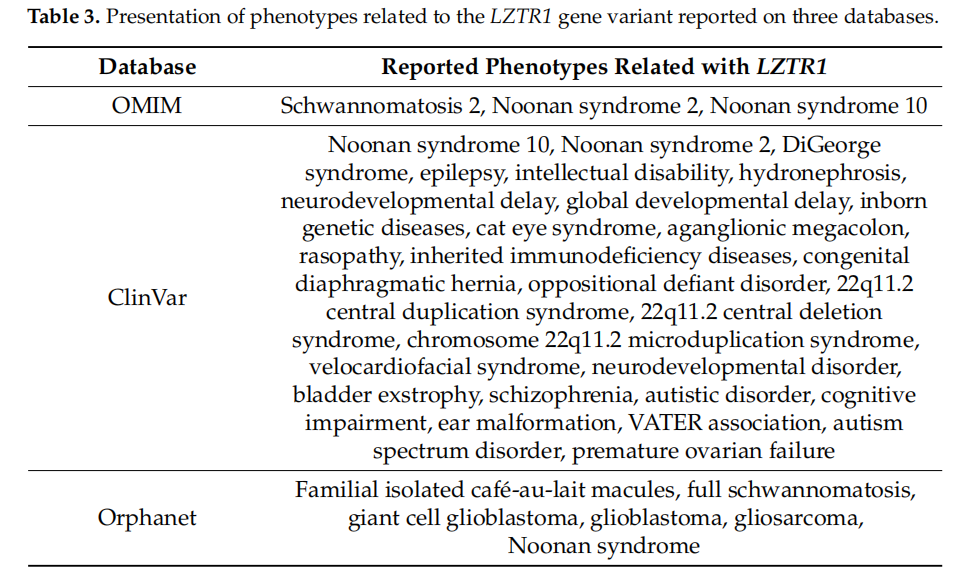
▲表3 三个数据库中报告的与LZTR1基因变异相关表型
蛋白质-蛋白质相互作用分析
在STRING数据库(访问日期:2025 年 5 月 22 日)中,鉴定出多个与LZTR1蛋白具有高置信度相互作用评分的蛋白质,包括:CUL3(Cullin-3)、KLHL22(Kelch样蛋白22)、KRAS(GTP酶Kras)、KLHL3(Kelch样蛋白3)、ZSWIM8(含锌指SWIM型蛋白8)、GAN(巨轴索神经病变蛋白)、KLHL21(Kelch样蛋白21)、KLHL8(Kelch样蛋白8)、KBTBD8(含Kelch重复和BTB结构域蛋白8)和KLHL7(Kelch样蛋白7)。
通过Genemania工具预测的LZTR1相互作用蛋白包括:RIT2(无CAAX的Ras样蛋白2)、SLC44A1(溶质载体家族44成员1)、BMPR1B(骨形态发生蛋白受体1B型)、KLHDC3(含Kelch结构域蛋白3)、KLHDC4(含Kelch结构域蛋白4)、RIT1(无CAAX的Ras样蛋白1)、SCYL2(SCY1样假激酶2)、LRCH4(含亮氨酸重复序列和钙调蛋白同源结构域蛋白4)、HSPG2(硫酸乙酰肝素蛋白聚糖2)、PBXIP1(PBX同源盒相互作用蛋白1)、SGSM3(小G蛋白信号调节剂3)、PPIL2(肽基脯氨酰异构酶样2)、LTBP3( latent转化生长因子β结合蛋白3)、AIFM3(线粒体相关凋亡诱导因子3)、ANKRD11(锚蛋白重复结构域11)、RBM10(RNA结合基序蛋白10)、KLHL22(Kelch样家族成员22)、ASCC2(激活信号共整合因子1复合物亚基2)、TUBGCP4(微管蛋白γ复合物相关蛋白4)和CABIN1(钙调神经磷酸酶结合蛋白1)。
蛋白质同源性分析
人类LZTR1蛋白(UniProt ID: Q8n653)与大鼠(RAT;UniProt ID: B5DFI4)、小鼠(MOUSE;UniProt ID: Q9CQ33)、斑马鱼(DANRE;UniProt ID: A1L1Q7)、鸡(CHIC;UniProt ID: A0A1D5P134)和热带爪蟾(XENTR;UniProt ID: B2GUN2) 的LZTR1蛋白具有同源性(图10)。多物种序列比对显示高度兼容性。跨越突变位点的氨基酸序列具有保守结构域。

▲图10 亮氨酸拉链样翻译后调节因子 1 (LZTR1) 的多物种氨基酸序列比对
模型生物的表型分析
选择具有高LZTR1同源性评分的模式生物进行表型检查。ZFIN数据库标记了两个与LZTR1基因相关的表型,包括颅血管畸形和心室肥大。联盟基因组(Alliancegenome)显示,小鼠LZTR1基因的表型涉及颅骨和面部形态异常、心脏超声异常、心脏肥大、细胞增殖增加及过早死亡。热带爪蟾和大鼠的LZTR1及LZTR1变异相关数据显示以下表型:心血管、中枢神经和胃肠系统疾病;甲状腺疾病;良性肿瘤;癌症和癌前肿瘤。LZTR1敲除突变个体因心血管异常导致致死。LZTR1常染色体显性突变在小鼠中诱发类似努南综合征的表型。J. W. Bigenzahn等人的研究显示,果蝇中LZTR1敲低后出现Ras依赖性功能获得性表型。
讨 论
遗传易感性见于 10–15% 的乳腺癌病例。其中大多数与参与DNA修复机制BRCA1和BRCA2基因的变异相关。此外,其他基因变异也与家族性癌症相关。LZTR1基因尚未被纳入遗传性乳腺-卵巢癌综合征检测中使用的主要基因panel。特定的基因变异在遗传性癌症综合征中得到证实,该综合征与耐药性KRAS突变型肺腺癌、结直肠癌和食管癌、肝细胞癌以及胶质母细胞瘤的较高风险相关。关于此类变异遗传背景的知识可能会促成新的预测因子分类的发现。这类研究强调了在癌症中进行基因变异研究的必要性。
本研究的目的是描述一名携带LZTR1 c.1260+1del基因变异患者的病例,并确定该胚系变异的表型效应。此外,通过计算机模拟研究,研究人员希望评估癌症发展的分子机制。本部分研究着重于寻找癌症家族发病与检测到的LZTR1基因变异之间的相关性。
所呈现的LZTR1 c.1260+1del转录本和蛋白质结构预测区分出四种可能的蛋白质。所有预测蛋白质的部分保留结构表明所分析的LZTR1变异存在功能丧失(LoF)突变。此类突变导致缺乏具有功能活性的蛋白质。LZTR1基因的功能丧失突变在五分之一的胶质母细胞瘤病例中被描述。这种恶性肿瘤常见于儿童和成人,且仍被认为与遗传性癌症综合征相关。与所分析基因的胚系突变相关的表型具有异质性。常见的观察特征包括畸形和过度活动。与LZTR1变异相关的临床表型大多表现为神经鞘瘤。由于缺乏典型的临床表型,生殖系LZTR1功能丧失突变在其他肿瘤中的作用仍未知。这些LZTR1功能丧失变异是否可能与RAS信号通路相关综合征(RASopathies)相关仍不清楚。
对LZTR1的蛋白质-蛋白质相互作用分析表明,该蛋白质与CUL3和KRAS存在相互作用。LZTR1-CUL3复合物是EGFR-AXL水平的负调节因子。泛素化减少导致酪氨酸激酶的积累。Ko等人报道了LZTR1突变肿瘤对EGFR抑制剂的敏感性。LZTR1-CUL3复合物的缺乏导致EGFR和AXL的积累,并表现出对EGFR和AXL联合抑制的特定易感性。Ko等人的研究揭示了现有药物(奥希替尼和阿法替尼)在治疗LZTR1突变癌症中的可能有效性。LZTR1基因中同时存在的胚系突变可能引发实体瘤中的酪氨酸激酶抑制剂(TKI)耐药性。
LZTR1表达的组织特异性和年龄相关变异性可能影响患者表型。Abe等人描述的肺癌细胞中LZTR1敲除证实其对RAS/MAPK激酶过度激活具有正向作用,从而促进细胞增殖。Abe还证实LZTR1参与胶原合成,因此该蛋白缺失会影响细胞外基质重塑,并可能促进上皮-间质转化。Biegenzahn等人发现,癌细胞对特定药物的敏感性取决于LZTR1基因的遗传变异。此外,该团队揭示,与Kelch结构域突变不同,BTB/BACK突变不会破坏细胞对伊马替尼的敏感性。
本研究显示不同生物间LZTR1结构域的高度保守性。因此,通过模式生物研究分析可能阐明LZTR1变异在癌症发展中的功能。Abe等人证明,LZTR1常染色体显性突变可在小鼠中诱发类似努南综合征的表型。J. W. Biegenzahn等人的研究显示,果蝇中LZTR1敲低后出现RAS依赖性功能获得性表型。Pae等人的研究表明,在果蝇中,CUL3在靶向Torso/RTK降解中起关键作用(人类中Torso的同源物是血小板衍生生长因子受体β[PDGFRB]),这可能是致癌信号的来源。此外,在黑腹果蝇研究中,Zipper等人证明LZTR1功能丧失变异导致细胞增殖增加、RAS通路激活和细胞凋亡诱导。正常LZTR1蛋白缺失会导致RAS蛋白水平改变。RAS蛋白含量升高会促进RAS/MAPK通路过度激活,表现为受累细胞异常增殖和分化。
本临床病例涉及一名携带杂合型c.1260+1del LZTR1变异的患者,该变异极可能具有负显性效应。因此,突变型(MT)蛋白与野生型(WT)蛋白的相互作用会部分抑制后者功能,导致RAS蛋白泛素化过程中断,进而引起RAS/MAPK通路过度激活并促进细胞过度增殖。在成人中,LZTR1蛋白主要在血管组织和特定类型造血细胞中表达。LZTR1是肿瘤抑制基因,也是RAS/MAPK通路的负调节因子。LZTR1突变评分的异质性及其频率差异与其对肿瘤发生影响的界定不清有关。此外,不同LZTR1基因突变变异携带者对治疗敏感性的差异报告证实了其高度表型异质性,并指出需根据临床意义对已发现的遗传变异进行分类。患者病史显示父系存在肺癌、食管癌和肾癌病例,母系存在卵巢癌和结直肠癌病例,这些数据与已报道的LZTR1基因致癌变异相符。所报道的c.1260+1del变异仅在 3 例杂合子中被描述。本研究分析结合已有报道数据,确定了所述LZTR1变异在癌症发展中的潜在显著影响。外显子测序荟萃分析证实了LZTR1突变在乳腺癌易感性中的作用,LZTR1及其他四个被归类为肿瘤抑制基因的基因被证实与乳腺癌风险增加相关。此外,在LZTR1、ATRIP和BARD1基因中发现了蛋白截断变异,其中BARD1是已知的乳腺癌预测因子,已被纳入乳腺和卵巢癌NGS检测panel。疾病的快速进展和治疗抵抗可能与RAS激酶水平改变相关,这也可能促进转移过程。所述临床病例中对激素治疗的抵抗或许可通过使用MEK抑制剂(如曲美替尼)来克服,这类治疗专门针对MAPK介导通路过度激活的患者。
研究证实LZTR1:c.1260+1del变异是一种功能丧失突变,定位于Kelch基序内。正如Bigenzhan等人报道,这种情况下极可能存在伊马替尼耐药性。然而,体外研究针对的是纯合状态下的其他变异,而本病例研究为LZTR1胚系突变杂合子患者。LZTR1:c.1260+1del的计算机模拟分析显示该变异极可能诱发肿瘤发生。这些发现强调需对携带该变异的患者进行密切监测,且可能需要调整推荐治疗策略。应强调需通过体外和体内研究验证本分析结果,迫切需要在临床模型中开展进一步功能研究,并对肿瘤患者中与LZTR1相关的表型进行更多流行病学研究。
结 论
结合现有文献数据,对LZTR1:c.1260+1del变异的计算机模拟分析结果表明,该变异极可能影响癌症发展。携带该变异的患者可能需要接受专科治疗。为验证初步结果,进一步的体外和体内分析必不可少。每项计算机模拟检测均需通过测量转录组和蛋白质组水平的功能试验来证实。本研究未纳入RNA评估,应对受累细胞中LZTR1转录本和蛋白水平进行适当检测。因此,所得结果为推测性结论。未来将利用体外模型开展研究,以进一步检验和验证已建立的假设。
参考文献:
Wieleba, I.; Smoleń, P.; Czukiewska, E.; Szcześniak, D.; Filip, A.A. LZTR1: c.1260+1del Variant as a Significant Predictor of Early-Age Breast Cancer Development: Case Report Combined with In Silico Analysis. Int. J. Mol. Sci. 2025, 26, 6704. https://doi.org/10.3390/ijms26146704
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)