首页 > 医疗资讯/ 正文

在对抗癌症的战役中,如何将药物精准、高效、安全地送达肿瘤组织,同时最大程度减少对正常组织的伤害(即“脱靶毒性”),一直是科学家们孜孜以求的目标。蛋白质,作为生命的基本元件,以其优异的生物相容性、可基因编程性以及结构均一性,成为构建新一代药物递送系统的理想“材料”。然而,精确控制蛋白质纳米颗粒的组装结构,并建立其宏观性质(如大小、药物释放速度)与微观分子设计之间的关联,仍是巨大挑战。
近日,内蒙古大学李昕宇团队在《Journal of Controlled Release》上发表题为 “Chimeric Collagen-like Proteins with Tunable Structural Heterogeneity for Precise Control and Targeted Doxorubicin Delivery”的重要研究成果。他们受细菌嵌合胶原样蛋白(CLP)启发,创新性地设计并构建了一系列结构高度可编程的嵌合胶原样蛋白(Chimeric CLP-like Proteins)。这些蛋白作为“智能骨架”,成功负载阿霉素,形成嵌合胶原样蛋白-阿霉素偶联纳米复合物(CDCNs),并在三阴性乳腺癌(TNBC)和胶质母细胞瘤(GBM)两种恶性实体瘤模型中,展现出卓越的靶向递送能力、增强的抗肿瘤效果和显著降低的系统毒性。
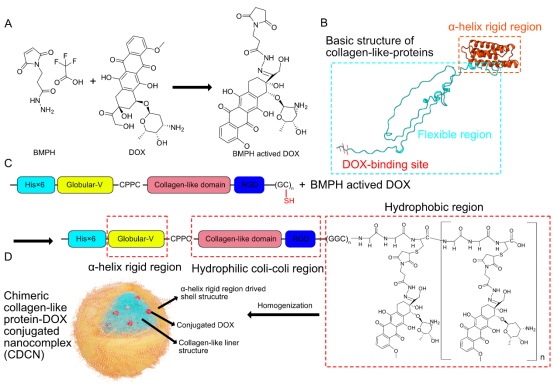
图1:CDCNs的设计与制备机制。 (A) DOX活化示意图。(B) 嵌合蛋白结构域组成:N端刚性球状结构域、柔性线性胶原样结构域、C端DOX偶联位点。(C) 活化的DOX通过迈克尔加成反应与蛋白载体上的半胱氨酸残基偶联。(D) CDCNs的宏观结构模型:DOX偶联的线性域被包裹在核心,刚性球状域形成纳米粒外壳。(来源:论文Fig 1)
创新设计:模块化构建,精准调控
研究团队的核心突破在于其模块化设计策略。他们设计的嵌合蛋白包含三个关键域(图1B):
N端刚性球状结构域(如α-螺旋或β-折叠):提供稳定性和作为后续靶向肽的融合位点。
中部柔性线性胶原样结构域((Gly-Xaa-Yaa)n重复序列):决定纳米粒大小和药物释放速率的关键。
C端特异性偶联位点((GC)n序列):用于通过稳定的硫醚键共价偶联经活化的DOX。
通过基因工程技术,研究人员可以精确调控这三个结构域的长度、类型(α-螺旋, β-折叠)和数量(如偶联位点数)。这种结构上的“可编程性”,使得CDCNs的宏观性质(粒径、形貌、载药量、释放动力学)能够被精准定制。
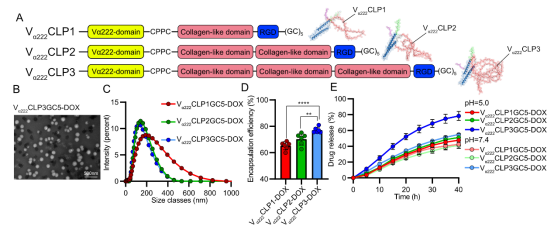
图2:线性结构域长度对CDCNs的影响。 (A) 不同长度线性结构域CLPs的设计及预测结构(红色:线性域;蓝色:α-螺旋域;紫色:DOX偶联位点)。(B) Vα222CLP3-DOX CDCNs的TEM图像(均匀球形)。(C) 线性域长度对CDCNs粒径的影响(DLS分析)。(D) 线性域长度对DOX包封率的影响。(E) 不同pH下,线性域长度对DOX释放动力学的影响。(来源:论文Fig 2)
关键发现:结构决定性能
研究揭示了嵌合蛋白的微观结构如何决定CDCNs的宏观性能和药效:
1、线性域长度 (图 2):
长度↑ → 粒径↓,包封率↑:更长的亲水线性序列促进疏水DOX分子聚集,形成更致密的内部结构。
长度↑ → 释放速率↑:更长的亲水柔性链在生理环境中促进纳米粒溶胀,增强基质渗透性,加速药物扩散(尽管核心更密,但溶胀效应占主导)。
2、刚性结构域类型与长度 (图 3):
α-螺旋域长度↑ → 外壳厚度↑ → 释放速率↓:更长的刚性α-螺旋形成更厚更致密的外壳,减缓药物扩散(屏障效应)。(Fig 3A-G)
β-折叠域长度↑ → 包封率↓ → 释放速率↑:β-折叠的刚性和平面构象增加了蛋白质载体的疏水性,减少了与疏水药物DOX的结合,同时降低了药物扩散的内部阻力。(Fig 3H,N)
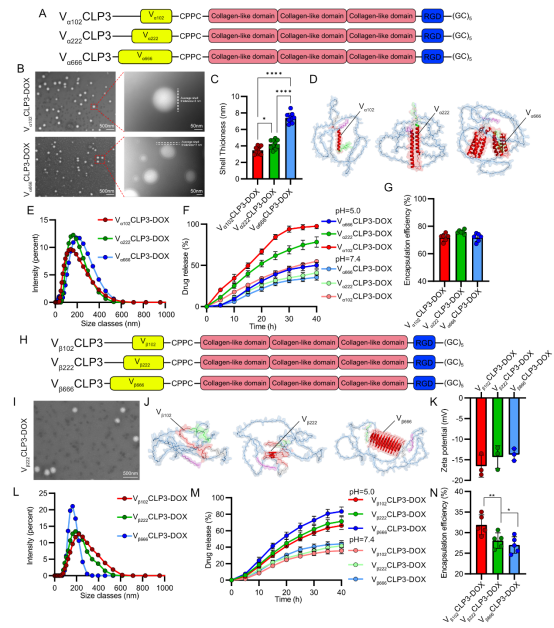
图3:N端球状结构域异质性对CDCNs的影响。 (A, D) N端α-螺旋异质性设计及蛋白预测结构(蓝色:线性域;红色:α-螺旋域;紫色:偶联位点)。(B, C) TEM图像及统计分析显示α-螺旋长度增加导致外壳增厚。(E) α-螺旋长度增加导致粒径略增。(F) α-螺旋复杂度增加显著减缓DOX释放。(G) α-螺旋异质性对包封率影响小。(H, J) N端β-折叠异质性设计及蛋白预测结构(蓝色:线性域;红色:β-折叠域;紫色:偶联位点)。(I) β-折叠异质性对CDCNs宏观结构影响小。(K) β-折叠异质性对Zeta电位影响小。(L) β-折叠复杂度增加使粒径略降。(M) β-折叠复杂度增加显著加速DOX释放。(N) β-折叠结构增加显著降低包封率。(来源:论文Fig 3)
3、DOX偶联位点数量 (图4):
位点数↑ → 粒径↓,包封率↑:更多结合位点提高了载药量,形成更致密的CDCNs结构。位点数↑ → 释放速率↓:更高的载药量导致疏水DOX分子聚集形成更致密的疏水核心,使CDCNs更均质稳定,减缓释放。
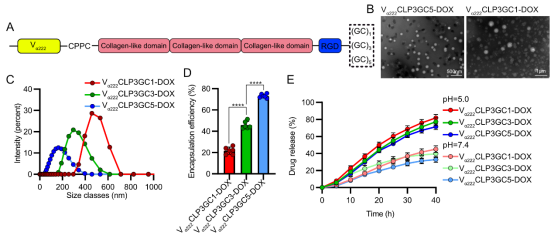
图4:DOX偶联位点数量对CDCNs宏观结构和药物包封的影响。 (A) 具有不同DOX偶联位点数量(1, 3, 5)的CLPs构建示意图。(B) TEM图像显示偶联位点增多(Vα222CLP3GC5-DOX vs Vα222CLP3GC1-DOX)导致粒径显著减小。(C) DLS分析证实粒径随偶联位点增加而减小。(D) 包封率随偶联位点增加而提高。(E) 更多偶联位点减缓了不同pH下的DOX释放速率。(来源:论文Fig 4)
精准打击:靶向治疗三阴性乳腺癌(TNBC)
当使用上述10种CDCNs对HeLa细胞进行孵育,我们注意到Vα222CLP3GC-DOX杀伤率最强,高达66.4%。基于上述研究,团队筛选出综合性能最优的载体Vα222CLP3GC5(尺寸合适、载药量高、释放速率适中,对癌细胞致死率最高)。为了赋予其靶向能力,他们将尿激酶型纤溶酶原激活物(UPA)肽基因融合到该载体的N端(图5A)。UPA肽能特异性识别在TNBC细胞(如4T1细胞)上高表达的uPAR受体。
1、精准识别:荧光显微镜显示,UPA修饰的CDCNs (UPA-CDCNs) 能高效被uPAR阳性的4T1 TNBC细胞内吞,而在uPAR阴性的HeLa细胞中则主要滞留在细胞膜上(图5D)。
2、强力杀伤:在体外,UPA-CDCNs对4T1细胞展现出强大的杀伤力,诱导显著凋亡(图5C)。机制研究表明,其通过上调P53、Caspase-3、Cleaved Caspase-3,下调BCL-2,激活了经典的DOX凋亡通路(图5E)。
3、安全性高:溶血实验证明UPA-CDCNs具有良好的生物相容性(图5F)。
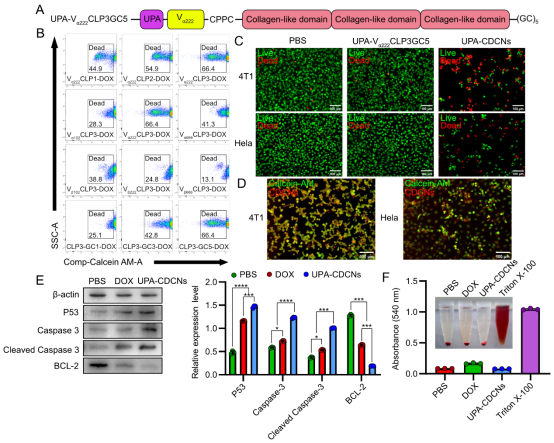
图5. TNBC靶向CDCNs的体外抗肿瘤效果。(A) TNBC靶向肽UPA融合至Vα222CLP3GC5 N端构建UPA-CDCNs示意图。(B) 流式细胞术分析显示不同CDCNs的抗肿瘤效果,Vα222CLP3GC5-DOX抑制效果最佳。(C) 活/死染色图像评估UPA-CDCNs抗肿瘤效果。(D) UPA-CDCNs靶向能力成像(红色DOX荧光):在uPAR+ 4T1细胞内强积累,在uPAR- HeLa细胞外滞留。(E) Western blot分析显示UPA-CDCNs处理上调促凋亡蛋白(P53, Caspase-3, Cleaved Caspase-3),下调抗凋亡蛋白(BCL-2)。(F) 溶血实验证实UPA-CDCNs生物相容性良好。(来源:论文Fig 5)
体内显神威:高效抑瘤,毒性大降
在TNBC原位小鼠模型中的评价更令人振奋(图6):
精准富集,长效滞留:静脉注射Cy7标记的纳米颗粒后,荧光成像显示,UPA-CDCNs能长时间富集在肿瘤部位(荧光持续24小时),而未修饰的CDCNs在16小时内就被快速清除(图6D)。离体器官成像进一步证实UPA-CDCNs在肿瘤部位有强荧光信号,而CDCNs主要富集在心脏和肾脏(图6G)。
TNBC模型 (UPA-CDCNs):
1、强效抑瘤: 显著抑制肿瘤生长(肿瘤体积/重量远低于PBS和游离DOX组)(图6E, F),延长生存期(中位>40天 vs PBS组18天,DOX组28天)(图6C)。
2、精准靶向: 体内成像显示UPA-CDCNs在肿瘤部位长时间滞留富集(图6D, G),而普通CDCNs被快速清除。
3、促进凋亡: 肿瘤组织内广泛凋亡,促凋亡蛋白表达上调(图6H, I, J, K)。
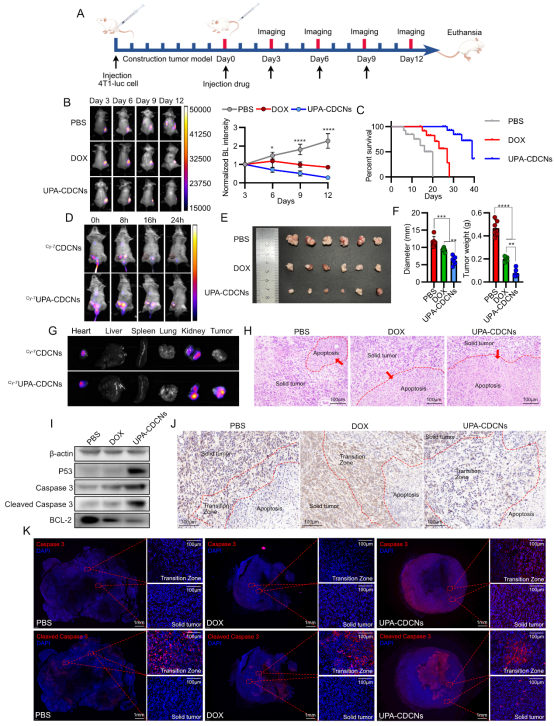
图6. UPA-CDCNs的体内抗TNBC效果。(A) 实验设计时间线。(B) 生物发光成像及相对强度定量显示UPA-CDCNs显著抑制肿瘤进展。(C) 荷瘤小鼠生存曲线(UPA-CDCNs组显著延长)。(D) 活体荧光成像评估CDCNs和UPA-CDCNs药代动力学(UPA-CDCNs肿瘤滞留时间长)。(E, F) 解剖后代表性肿瘤图像、肿瘤重量和直径记录(UPA-CDCNs组最小)。(G) 主要器官荧光成像显示UPA-CDCNs肿瘤特异性富集(与C图对应)。(H) 肿瘤组织H&E染色(中央区),红箭头示凋亡区域。(I) 全肿瘤组织蛋白表达Western blot分析。(J) 肿瘤组织BCL-2免疫组化(红虚线示凋亡区、实体瘤、过渡区)。(K) 肿瘤组织Caspase 3 / Cleaved Caspase 3免疫荧光。(来源:论文Fig 6)
安全性优势(图7):
1、心脏保护: 游离DOX引起明显心肌病变(心脏组织切片可见深色点状病灶,图7E),而UPA-CDCNs未观察到心脏毒性或主要器官损伤。
2、降低系统毒性: UPA-CDCNs治疗组血清中心肌损伤标志物(CK, LDH-L)、肝损伤标志物(ALT, AST)水平显著低于游离DOX组,接近正常水平(图7B, C, D, F, G)。无溶血反应(图5F)。
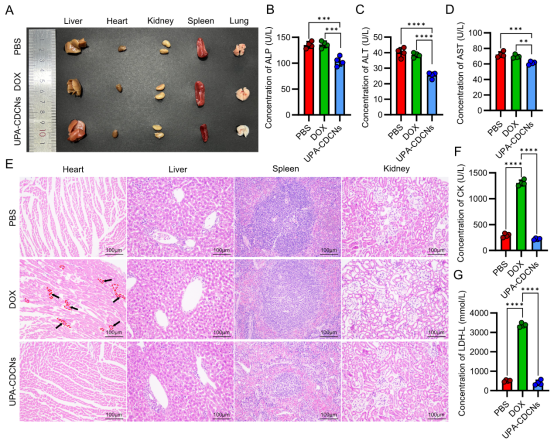
图7. UPA-CDCNs相比游离DOX生物毒性降低。(A) TNBC小鼠不同治疗组各组织照片(DOX组脾肿大)。(B) 血清碱性磷酸酶(ALP)水平(脾肿大相关,UPA-CDCNs组略降)。(C, D) 血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平(肝损伤标志,UPA-CDCNs组接近正常)。(E) 心、肝、脾、肾组织H&E染色。红虚线和黑箭头强调游离DOX诱导的心肌病(心脏切片深色点状物质)。(F, G) 血清肌酸激酶(CK)和乳酸脱氢酶(LDH-L)水平(心肌损伤标志,DOX组显著升高)。(来源:论文Fig 7)
突破血脑屏障:靶向治疗致命脑瘤(胶质母细胞瘤, GBM)
团队进一步探索了该平台用于治疗致命脑瘤GBM的潜力。他们将GBM靶向肽LinTT1基因融合到Vα222CLP3GC5的N端。LinTT1能特异性结合GBM微环境中肿瘤和基质细胞表面异常表达的线粒体蛋白p32。
1、体外高效杀伤GBM细胞:
LinTT1-CDCNs 处理 GBM 细胞 (GL261) 12 小时,即可导致 64.3% 的细胞死亡,效果显著优于游离阿霉素(DOX,仅 19.8%)。
2、作用机制: 通过激活 P53-Caspase 凋亡通路 诱导细胞死亡。
突破血脑屏障(BBB):
3、体外模型: LinTT1-CDCNs 能有效穿越 Transwell BBB 模型。
体内模型(小鼠): 静脉注射后 24 小时,能在大脑中检测到明显的 Cy7 荧光信号,证明其成功穿越 BBB 到达脑部肿瘤部位(图8B, C)。
对比: 未修饰的 CDCNs 主要聚集在心脏和肾脏,无法有效进入大脑(图8B, C)。
体内高效抗肿瘤,显著延长生存期:
肿瘤抑制: LinTT1-CDCNs 治疗组使肿瘤生物发光信号降低 50%,DOX 组降低 20%,PBS 组增加 20%(图8D, E)。
生存期: 显著延长小鼠中位生存期至 40 天以上,PBS组18天,DOX组26天(图8F)。
组织学证据:H&E 染色显示 LinTT1-CDCNs 组 GBM 病灶显著缩小。Western Blot、免疫组化、免疫荧光证实 LinTT1-CDCNs 处理显著:上调促凋亡蛋白:P53, Caspase-3, Cleaved Caspase-3, TNF-α, CD63(图8G, H, I)。下调抗凋亡蛋白:BCL-2(图8G)。
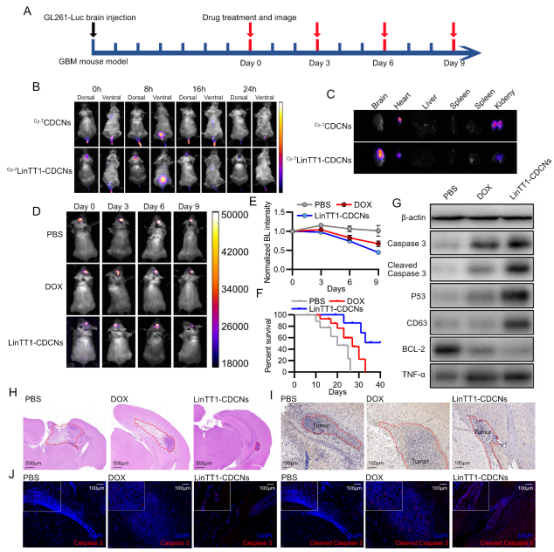
图8. LinTT1修饰CDCNs的抗GBM效果。(A) 体内抗GBM实验时间线。(B) 活体荧光成像示踪Cy7标记的CDCNs和LinTT1-CDCNs药代动力学。(C) 给药24小时后主要器官荧光成像显示LinTT1-CDCNs成功穿越BBB在脑部富集,而CDCNs主要富集于心肾。(D) GBM模型小鼠生物发光成像。(E) 不同治疗后GBM相对生物发光强度定量(LinTT1-CDCNs组显著降低)。(F) 生存曲线(LinTT1-CDCNs组生存期显著延长)。(G) 全脑组织凋亡相关蛋白Western blot分析。(H) 脑组织H&E染色显示LinTT1-CDCNs治疗显著减小GBM病灶。(I, J) GBM病灶处BCL-2免疫组化及Caspase-3/ Cleaved Caspase-3免疫荧光。(来源:论文Fig 8)
意义与展望:开启蛋白药物递送新篇章
该研究不仅成功开发了针对TNBC和GBM的高效低毒靶向递送系统,其提出的“结构可编程嵌合胶原样蛋白”设计策略具有更深远的意义:
1、精准调控: 通过调整蛋白微观结构(线性域长、刚性域类型/长度、偶联位点数),可精确控制纳米粒的宏观性质(粒径80-800 nm可调,释放时间20-40 h可调),满足不同肿瘤治疗需求。
2、模块化平台: N端可作为“通用接口”融合多种靶向肽(如UPA, LinTT1)、免疫调节肽、甚至光动力/光热响应肽,轻松构建多功能治疗载体。
3、拓展性强: 该平台可整合刺激响应元件(如MMP酶切位点、光敏蛋白),实现药物在肿瘤部位的智能响应释放。其应用前景不限于癌症治疗,还可拓展至免疫佐剂、抗生素递送等领域。
4、安全优势: 基因工程设计的de novo CLP作为“空白模板”,减少了暴露的功能基团,相较于天然蛋白(如BSA, HSA),潜在免疫原性风险更低,且具备高纯度、批次间一致性好、易于规模化生产等优势。
结论:
内蒙古大学李昕宇团队开发的基于嵌合胶原样蛋白的CDCNs平台,巧妙地结合了刚性球状蛋白的稳定性和线性胶原蛋白的可调性,通过基因工程实现了载体结构-性能-功能的精准编程。该平台在TNBC和GBM模型中展现出的高效靶向、强效抑瘤和卓越安全性,为克服传统化疗药物的毒副作用和递送瓶颈提供了强有力的新工具。其模块化、可编程的设计理念,为下一代智能化、多功能蛋白基药物递送系统的开发开辟了广阔道路。
参考文献:
Xia, Y., Li, Y., Huang, J., et al. (2025). Chimeric collagen-like proteins with tunable structural heterogeneity for precise control and targeted doxorubicin delivery. Journal of Controlled Release , 386 ( 2025 ), 114131.
原文链接:
https://doi.org/10.1016/j.jconrel.2025.114131
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)