首页 > 医疗资讯/ 正文
急性髓系白血病(AML)多影响老年群体,约三分之一的初治(ND)患者年龄为75岁或以上。这些患者中的大多数不适合接受强化化疗,历史上预后多不理想。然而,近年来,通过口服BCL2抑制剂维奈克拉(Ven)与去甲基化药物(HMA)联合治疗,在不适合强化疗的AML患者中已成为标准治疗方法,显著改善了生存率和生活质量(QoL)。除维奈克拉外,针对FLT3、IDH1/2突变的口服小分子抑制剂,以及最近针对KMT2A重排(KMT2Ar)的抑制剂也成为AML治疗的重要补充。随着治疗选择的增加,AML的管理依赖于共同决策过程,不仅应考虑疾病特征,还应考虑患者的身体状况、生活质量指标和偏好。
《Blood Cancer Journal》近日发表综述,Courtney D. Dinardo (梅奥诊所)和Naseema Gangat (MD安德森癌症中心)两位教授回顾了临床试验和真实世界经验,概述了不适合强化治疗的成人AML患者的实用管理方法。

患者FITNESS和治疗选择
普遍认为,仅凭年龄无法充分衡量患者的身体状况。在日常临床护理中,由于缺乏经过验证的fitness筛查标准,确定患者的fitness仍存在挑战。多年来,已经开发出几种评分系统,这些系统主要依赖共病情况和疾病特征(如增强型造血干细胞移植共病指数[HCT-CI]或AML复合模型[AML-CM]),或涉及专家小组的共识(如欧洲白血病网络(ELN)标准,以及意大利血液学会、意大利实验血液学会(SIES)和意大利骨髓移植学会(GITMO)共识标准或Ferrara unfitness标准)。后者提供了不适合强化疗的共识定义,包括年龄大于75岁、东部肿瘤协作组(ECOG)表现状态≥3、医学共病(心肺、肾或肝疾病)和/或社会心理因素(认知状态和护理支持)。将上述unfitness标准应用于655名接受包括“7+3”方案(7天标准剂量阿糖胞苷和3天蒽环类药物)、CLAG-M方案(克拉屈滨、大剂量阿糖胞苷、粒细胞集落刺激因子和米托蒽醌)或减量CLAG-M方案治疗的AML患者,结果显示unfit组的总生存期显著较短(中位4.8个月,而fit组为36.8个月),unfit组的28天死亡率也显著高于fit组(14%比2%)。
另一个可以考虑的frailty评估工具是安大略玛格丽特公主癌症中心开发的HCT-frailty量表,该量表纳入八个变量:临床frailty量表、工具性日常生活活动测试、握力测试、计时起坐测试、自我健康评价问题、单次跌倒问题,以及frailty评估前七天内获得的血清白蛋白和C反应蛋白水平。根据总分,患者可分为fit(0-1分)、临界frail(1.5-5.0分)或frail(≥5.5分)。
新出现的数据表明,治疗前的老年评估可能为AML患者提供更敏感和特异的fitness衡量标准。在一项涉及74名接受强化疗的初治AML患者的单中心前瞻性研究中(中位年龄69岁;11%为≥80岁),老年评估包括认知、抑郁、焦虑、身体功能(PF)(自我报告和客观测量)和共病情况。客观PF使用简短身体性能电池(SPPB)进行评估,包括定时4米行走、椅子起坐、站立平衡和握力测量。在调整竞争风险因素后,认知功能障碍(改良简易精神状态检查(MMSE)<77)和PF降低(SPPB<9)的参与者的总生存期显著较短。
基于这些发现,最近一项2期试验结合老年评估(共病负担、身体和认知功能)和遗传特征,指导60岁以上AML患者的治疗选择。共纳入73名患者,其中通过老年评估认为fit且疾病风险为预后良好或中等患者接受类似强化“7+3”方案的化疗(n=4)或脂质体柔红霉素-阿糖胞苷(CPX351)(n=4)。不适合强化治疗或预后不良AML接受低强度化疗,包括单独使用去甲基化药物(n=18)、维奈克拉-去甲基化药物(n=43)或其他治疗(n=4)。74%的患者在多个老年评估领域表现出功能障碍,从入组到治疗开始的中位时间为1天(范围:0-13天),凸显了治疗前老年评估的可行性,及其作为60岁以上成人AML虚弱更准确衡量标准的潜力。
除指导治疗强度选择外,老年评估对于预测接受低强度治疗的AML患者的治疗结局也具有价值。在CALGB 361101研究中,共纳入96名被认为不适合强化治疗的AML患者(中位年龄:73岁),随机分配接受地西他滨单药治疗或地西他滨联合硼替佐米治疗。结果显示,包括HCT-CI>3、认知功能障碍和全球生活质量评分较低在内的多个基线因素与总生存期缩短相关。
综上所述,在随机比较结果出来之前,简单老年评估可能有助于指导治疗决策,降低成人AML过度治疗的风险。然而,在日常实践中,fitness评估还需考虑近期ELN提议中规定的治疗方案。总体而言,unfitness由以下因素决定:(i)预先存在的主要医学共病(射血分数<50%的心力衰竭、严重肾或肝功能损害、并发实体瘤),(ii)治疗医生对体能状态的评估(ECOG>2),以及(iii)社会情况,包括但不限于缺乏护理支持。
遗传风险因素和治疗选择
目前,AML的预后评估主要基于ELN遗传风险模型。ELN-2022模型将遗传风险分为预后良好、预后中等和预后不良三个类别:预后良好(核心结合因子,RUNX1-RUNX1T1或CBFB-MYH11,NPM1突变且无 FLT3-ITD 或不良核型,以及CEBPA bZIP突变),预后中等(核型未分类为不良或良好,NPM1突变伴FLT3-ITD,野生型 NPM1 伴FLT3-ITD且无不良风险基因病变,T(9;11)(p21.3;q23.3)-MLLT3-KMT2A),预后不良(不良核型,BCR/ABL1,TP53突变,ASXL1突变、BCOR突变、EZH2突变、RUNX1突变、SF3B1突变、SRSF2突变、STAG2突变、U2AF1突变和/或ZRSR2突变)。然而,该模型在指导维奈克拉(Ven)联合去甲基化药物(HMA)治疗时适用性有限。近期提出的ELN-2024风险分层模型则适用于接受低强度治疗(包括HMA±Ven或HMA+艾伏尼布[适用于IDH1突变AML)])的患者,分为预后良好(NPM1突变、IDH2突变、IDH1突变、DDX41突变且无TP53突变、KRAS突变、NRAS突变和FLT3-ITD)、中等(FLT3-ITD和/或KRAS突变和/或NRAS突变且无TP53突变)和不良(TP53突变)三个风险类别。接受阿扎胞苷+艾伏尼布治疗时,携带FLT3-ITD、K/NRAS突变的 IDH1突变仍预后良好。
一般而言,生存期和缓解的遗传预测因子倾向于存在重叠。在一项对279名接受维奈克拉联合阿扎胞苷治疗的初治AML患者的汇总分析中,基于TP53、KRAS、NRAS和FLT3-ITD的突变状态开发了一种四基因分子预后风险签名(mPRS)。在TP53野生型(WT)、KRAS/NRAS WT和FLT3-ITD WT患者中,完全缓解(CR)或不完全缓解(CRi)率为77.2%(高获益组);存在FLT3-ITD或KRAS/NRAS突变且TP53 WT患者中该比率为59.2%(中等获益组);而在存在TP53突变的患者中为47.6%(低获益组)。
梅奥诊所的一项研究纳入400名在临床试验之外接受维奈克拉联合去甲基化药物治疗的患者,发现NPM1突变、IDH2突变和DDX41突变与较高的缓解率相关,而TP53突变、FLT3-ITD和RUNX1突变与较低的缓解率相关。研究识别出四种不同的分子治疗反应特征:(i)NPM1突变,IDH2突变,或DDX41突变且TP53 WT,RUNX1 WT,及FLT3-ITD WT(CR/CRi为87%),(ii)NPM1 WT, IDH2 WT, DDX41 WT, TP53 WT, RUNX1 WT, FLT3-ITD WT(CR/CRi为73%),(iii)NPM1突变,IDH2突变,或DDX41突变突变合并TP53突变,RUNX1突变,或FLT3-ITD突变(CR/CRi为63%),(iv)TP53突变,RUNX1突变,或FLT3-ITD突变伴NPM1 WT,IDH2 WT,或DDX41 WT(CR/CRi为44%)。中位总生存期为13.2个月,3年生存率为29%。接受移植治疗的患者比未接受移植的患者生存结果更好(中位总生存期:未达到 vs. 10.8个月,3年生存率:62% vs. 22%)。另一方面,不良核型、KMT2A重排、TP53突变、KRAS突变和IDH2野生型对生存有负面影响。此外,该研究特别表明,在梅奥诊所、MD安德森癌症中心和芝加哥大学的三个独立队列中,实现CR或CRi在预测生存结果方面超越了遗传风险因素的重要性。此外,VIALE-A研究强调了实现MRD阴性CR/CRi的预后重要性,其中MRD阴性状态的患者中位总生存期为34.2个月,而MRD阳性患者为19个月。最终,实现缓解的可能性显著影响生存,是指导治疗决策的关键因素。
治疗
强烈建议对初治AML采取全面且个性化的管理方法,综合考虑疾病相关因素(遗传风险)和患者特征(包括身体状况和治疗目标/偏好)。建议在开始治疗前等待遗传测试结果,特别是在白细胞计数低或正常的患者中。对于高白细胞计数的病例,应迅速采取临时措施(如白细胞分离、羟基脲±阿糖胞苷),以稳定患者直至获得基因组结果。总体而言,成人AML与较差的生存率相关,但治疗结局正在改善。北欧国家对AML患者进行的年龄特异性生存分析(1972-2021年)显示,除80-89岁年龄组外,所有年龄组的生存率均稳步提高。值得注意的是,70-79岁年龄组的生存获益最小,而年轻患者(<50岁)的生存显著改善,这主要归因于更强化的治疗和异基因造血干细胞移植(ASCT)的使用。需要注意的是,该研究早于维奈克拉在欧洲获批,而维奈克拉在不适合强化治疗的患者中显示出生存和生活质量的获益。
不适合强化治疗患者的治疗方案
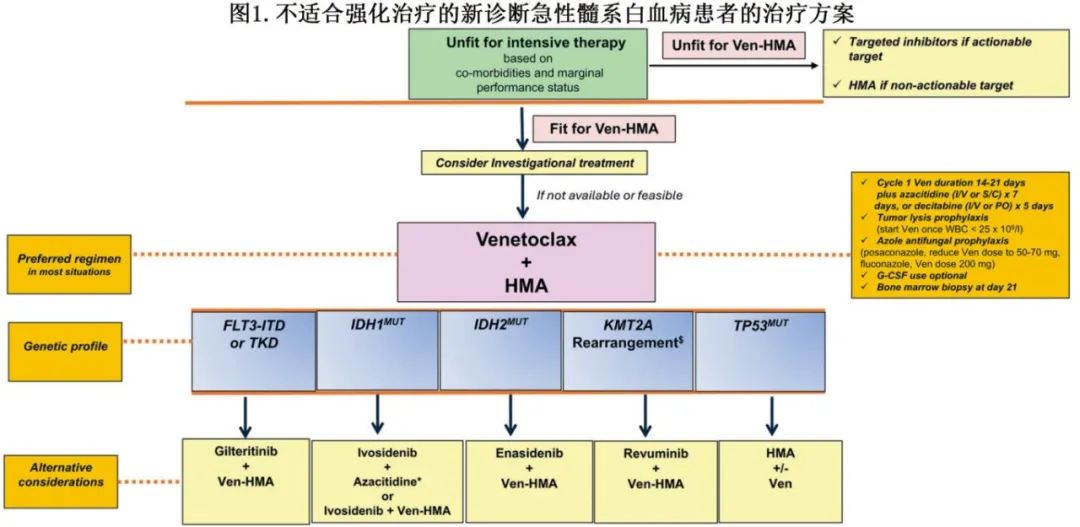
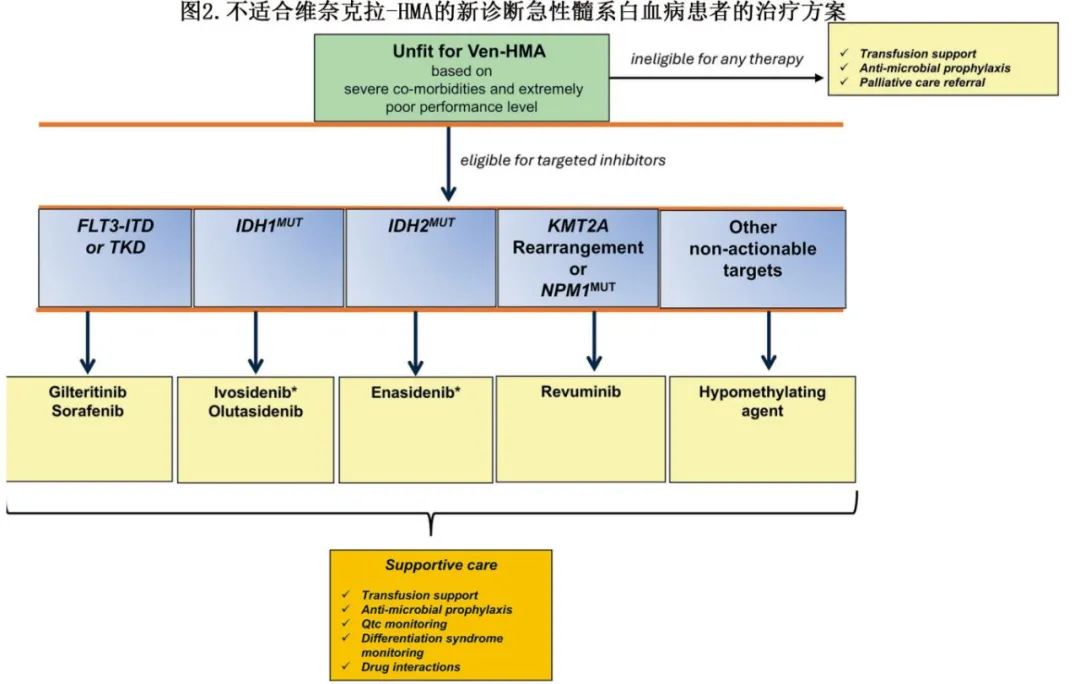
图1为根据年龄较大、存在主要医学共病和体力状态边缘等因素,不适合强化治疗的初治急性髓系白血病(ND-AML)患者的治疗算法。首先应提供试验性治疗,若不可行,则Ven-HMA 是大多数患者(包括可操作突变患者)的首选一线治疗,因其在unfit患者(包括80岁以上和90岁以上患者)中具有经证实的疗效和有利的安全性特征。作者Courtney D. Dinardo (CDD)和Naseema Gangat (NG)的治疗方案总体一致。例外情况包括IDH1突变患者,CDD认为阿扎胞苷联合艾伏尼布是首选方案。对于TP53突变患者,加用维奈克拉不能改善缓解率或生存率,可考虑单独使用HMA。Ven-HMA方案在遗传特征有利的患者中(缓解率约90%)可带来高CR/CRi率,治疗启动后一至两个月内出现反应。治疗可在门诊进行,但需在首次维奈克拉剂量递增阶段密切监测肿瘤溶解综合征。早期治疗相关死亡率仍低(<5%),治疗常可改善体能状态,使部分患者能够接受异基因造血干细胞移植(ASCT)。然而也需考虑Ven-HMA治疗的经济和心理社会负担,因为该治疗无时间限制且常伴明显骨髓抑制。此外,多项研究显示,约三分之一接受Ven-HMA治疗的ND-AML患者无反应,几乎所有反应者终将复发,凸显该疗法的非治愈性。部分特别frail的AML患者因骨髓抑制风险不适合Ven-HMA,可能从针对FLT3突变、IDH1/2突变、NPM1突变或KMT2A重排的单药治疗中获益(图2)。
维奈克拉联合去甲基化药物一线治疗
2018年11月,Ven联合HMA获FDA批准用于不适合强化化疗的ND-AML患者。关键III期VIALE-A试验评估了Ven(口服400 mg,28天)联合阿扎胞苷(75 mg/m²,皮下或静脉注射,第1-7天)对比安慰剂联合阿扎胞苷(n=145)在ND-AML患者中的疗效。主要纳入标准为年龄≥75岁(中位76岁;范围49-91岁),或存在显著医学共病,如需治疗的心衰或射血分数<50%、慢性稳定型心绞痛、肺功能受损(一氧化碳弥散量<65%或第1秒用力呼气量<65%),或ECOG状态2-3。Ven-阿扎胞苷组较阿扎胞苷单药组显著改善结局,CR/CRi率更高(66% vs. 28%),中位总生存期更长(14.7 vs. 9.6个月)。长期随访(中位43.2个月)发现,Ven-阿扎胞苷治疗的患者中有部分可获得持久缓解。达到CR/CRi的患者中位缓解持续时间18.2个月,42%的可评估患者通过流式细胞术达到MRD<10⁻³。值得注意的是,三分之二的MRD反应者携带IDH1/2突变(33%)或NPM1突变(33%)。
CR/CRi对于长期生存至关重要,51%和29%的CR/CRi患者分别在2年和3年后仍存活。此外,MRD阴性缓解者的生存期更长(中位34.2个月 vs. MRD阳性19个月)。超过半数的缓解者和长期生存者(>2年)携带IDH1/2突变(35%)或NPM1突变(20%),而FLT3突变(11%)和TP53突变(8%)相对少见。
VIALE-A研究的长期随访显示,52%的CR/CRi患者出现疾病进展/复发,中位生存期6.8个月,尽管42%的患者接受了挽救治疗。在真实世界中,对一线Ven-HMA治疗复发/耐药的患者中位总生存期约3个月,TP53突变、K/NRAS突变或ASXL1突变患者的生存期极差(1年生存率<1% vs. 无这些突变的患者42%)。
几个真实世界研究概括了 VIALE-A 试验的结果,但存在些许差异(表1)。
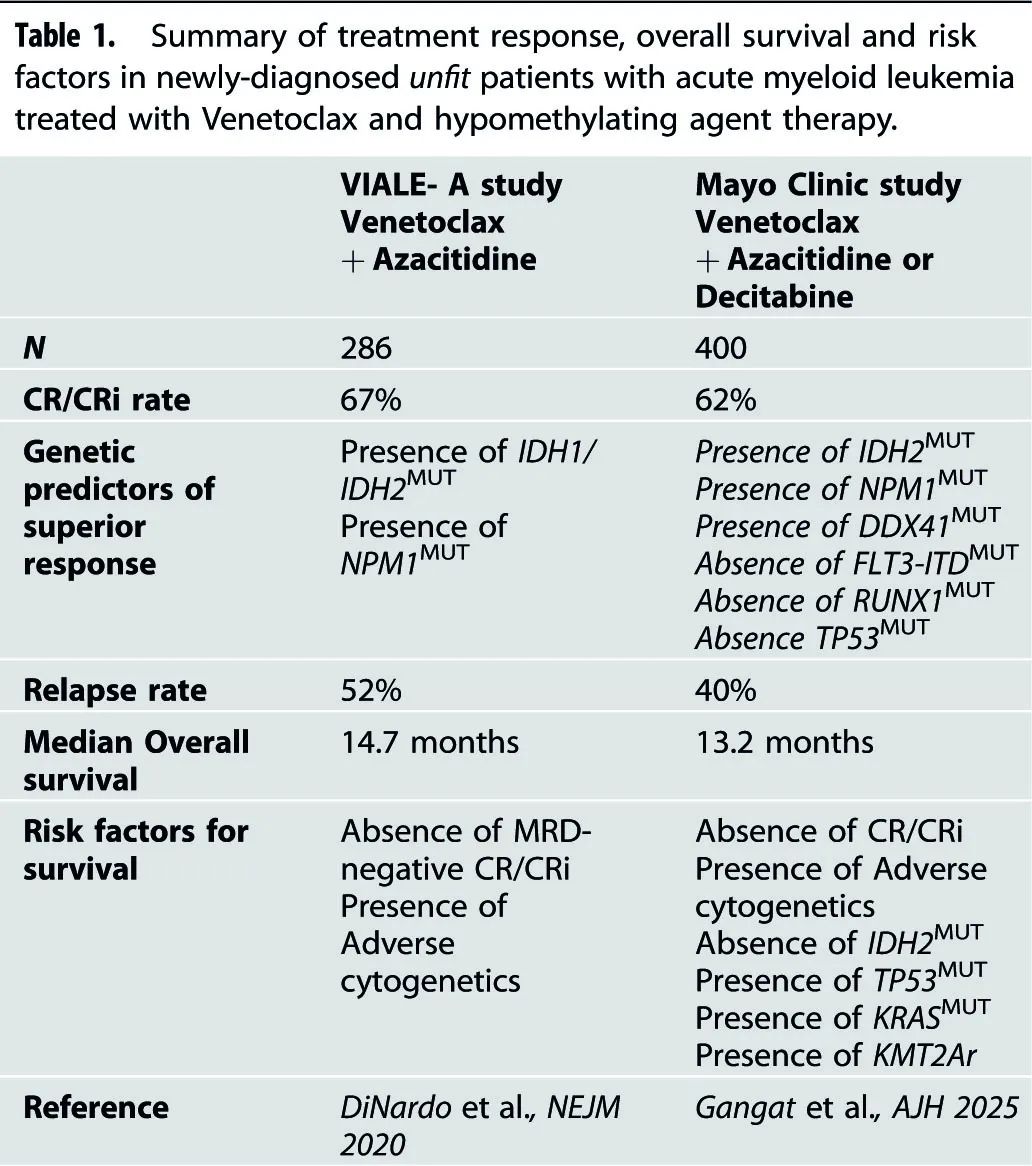
在梅奥诊所对400名ND-AML患者的研究中,患者接受维奈克拉(中位剂量每日200mg)联合地西他滨(n=265)或阿扎胞苷(n=148)治疗,38%的患者达到CR,24%的患者达到CRi,总体CR/CRi比率为62%。在梅奥分析中,携带一个或多个有利突变(NPM1、IDH2、DDX41)且无不利突变(TP53、FLT3-ITD、RUNX1)的患者中观察到最高的CR/CRi比率(87%),而至少有一个不利突变且无有利突变的患者反应最低(CR/CRi为44%)。同样,具有不良核型、KMT2A重排、TP53突变、KRAS突变和IDH2野生型的患者生存期较差。上述风险因素划分了低、中、高危组,相应的中位生存期(删失移植)分别为:未达到(3年生存率:67%)、19.1个月(33%)和7.1个月(0%)。在另一项包括154名接受Ven-HMA治疗的患者的多中心回顾性研究中(77%为ND-AML患者,年龄超过80岁,范围80-92岁),64%的患者接受了400mg的Ven治疗,治疗时间从≤7天(n=6,3.9%)、8-14天(n=11,7.1%)、15-21天(n=8,5.2%)到>21天(n=116,75.3%)不等。73%的患者达到CR/CRi,治疗缓解者的中位总生存期为13.2个月。30天和60天死亡率分别为8.5%和17%。
从实用的角度来看,优化Ven在第一个周期的给药方案至关重要,因为大多数接受标准28天Ven给药的患者会出现具有临床意义的骨髓抑制。在VIALE-A试验中,常见的血液学不良事件包括3级及以上的血小板减少症(46%)、中性粒细胞减少症(43%)和发热性中性粒细胞减少症(43%)。此外,回顾性研究一致显示,缩短Ven给药时间可达到类似的疗效,并且毒性更小。因此,强烈推荐在第一个周期实施缩短的Ven给药方案(14-21天)。在梅奥诊所的一项研究中,初治AML患者在第1周期接受14天(n=40,15%)、21天(n=41,15%)或28天(n=189,70%)的Ven治疗;接受14天、21天和28天Ven治疗的患者的CR/CRi率相似(68% vs 66% vs 62%),中位生存期也相似,分别为18.6个月、21.3个月和13.2个月。此外,对于携带一个或多个不利突变(TP53、FLT3-ITD、RUNX1)且无有利突变(NPM1、IDH2、DDX41)的患者,Ven治疗的持续时间似乎不影响缓解率。另一方面,接受28天Ven治疗的患者与接受21天和14天治疗的患者相比,3级及以上感染的发生率更高(28% vs 18% vs 20%)。
一项比较分析报告了类似结果。该分析比较了在法国7个中心接受阿扎胞苷7天+Ven 7天(7+7方案)治疗的82名初治AML患者与在MD安德森癌症中心接受标准剂量Ven-HMA治疗(第1周期接受≥21天Ven)的111名患者的疗效。两组的CR/CRi率(均为72%)和总生存期(11.2个月 vs 10.3个月)相似,但缩短Ven给药时间可降低8周内的早期死亡率(6% vs 16%)和血小板输注需求(62% vs 77%)。此外,在携带“对Ven不太敏感”的遗传学特征(TP53突变、FLT3-ITD、KRAS突变或NRAS突变)的患者中,Ven给药时间的长短似乎不影响总生存期。
另一个关键问题在于,Ven-HMA治疗是否能够实现无治疗缓解(TFR)。一项多中心研究分析了因耐受性差而停止治疗的缓解期患者的预后,该研究由法国创新白血病组织(FILO)的12个中心和莫菲特癌症中心共同开展。在62名初治AML患者中,28名患者停止了Ven-阿扎胞苷治疗,34名患者继续接受阿扎胞苷单药治疗,两组的结局相似。在中位随访23个月时,无治疗生存期为16个月(MRD阴性:2年无治疗生存率为80%),并且治疗周期数对无治疗生存期有显著影响。接受超过10个周期治疗的患者无治疗生存期最长,但至少接受5个周期治疗被认为与可接受的TFR相关(中位TFR未达到 vs 10个月)。另一项回顾性比较分析纳入在Ven治疗基础上缓解期≥12个月的患者,其中55%的患者继续治疗直至疾病进展,45%的患者停止治疗(STOP组)。长期随访(>5年)显示,STOP组的中位TFR为45.8个月,超过50%的患者仍处于持续缓解状态;在携带NPM1突变和/或IDH2突变、MRD阴性CR以及接受≥12个月Ven治疗的患者中,成功实现TFR的可能性更大,表明在部分患者中可以实现TFR。根据现有证据,建议对于接受≥12周期Ven治疗且达到MRD阴性CR的患者,可考虑停止治疗。
异基因干细胞移植(ASCT)
ASCT对于确保AML患者的长期生存仍然至关重要,而Ven联合去HMA疗法为改善患者体能状态和fitness提供了机会,从而使其有资格接受移植。在梅奥诊所的一项真实世界研究中,400名患者(中位年龄69岁)中有55名(13.8%)在中位3个周期的Ven-HMA治疗后接受ASCT桥接治疗。在移植时,98%的患者处于CR/CRi或形态学无白血病状态。移植后中位生存期未达到,3年生存率为62%。13名患者(24%)经历了移植后复发,3年累积复发率为25%,在具有不良核型的患者中显著更高(80% vs 非不良核型的17%)。
同样,在一项29名Ven-HMA后进行ASCT的患者的研究中,移植后中位生存期为14.3个月,与接受强化疗后移植的患者结局相当。另一项研究中,119名初治非核心结合因子AML患者(≥60岁)中有21名(18%)接受Ven-阿扎胞苷作为初始治疗并接受ASCT,与推迟ASCT的31名患者相比,总生存期显著更长(中位生存期未达到 vs 518天)。
此外,在接受Ven-阿扎胞苷临床试验并桥接至移植的33名患者中,移植后中位生存期为29.9个月,MRD阴性患者1年生存率为76%。
上述研究表明,Ven-HMA可作为ASCT的有效桥接疗法,为原本不适合强化治疗的患者带来长期生存获益。
FLT3抑制剂一线治疗
在初治AML患者(≥70岁)中,约20%存在涉及内部串联重复和酪氨酸激酶结构域的FMS样酪氨酸激酶3受体(FLT3)突变,这些突变具有不同的预后影响。美国FDA批准的口服小分子FLT3抑制剂包括midostaurin和奎扎替尼(quizartinib),可与“7+3”化疗联合用于一线治疗,以及吉瑞替尼,批准作为单药用于复发/难治性患者。此外,crenolanib仍在临床研究中,而索拉非尼(批准用于肾癌和肝细胞癌)可作为超说明书用药。
FLT3抑制剂作为不适合强化治疗的AML患者低强度治疗的一部分的潜在获益尚未在随机研究中得到确认(表2)。在一项吉瑞替尼联合阿扎胞苷对比阿扎胞苷的3期临床试验中,虽然吉瑞替尼-阿扎胞苷组的CR/CRi率更高(58% vs 27%),但CR率(16% vs 14%)和总生存期相似(9.8个月 vs 8.9个月)。
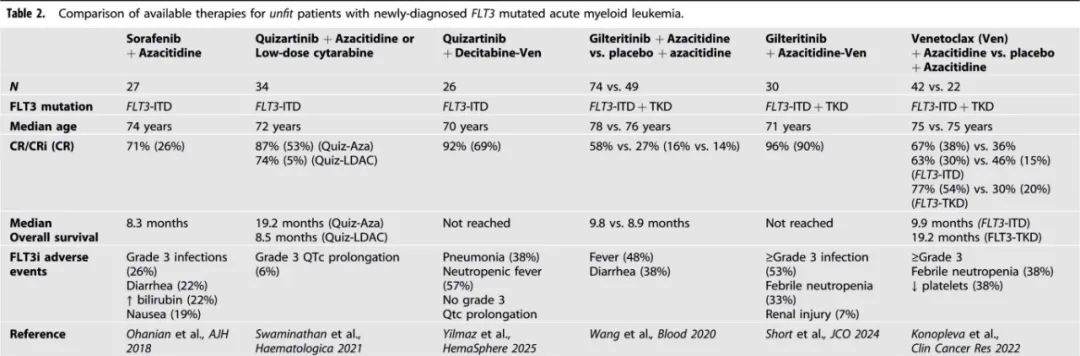
关于奎扎替尼或索拉非尼与HMA联合使用的有效数据有限。在一项针对不适合强化治疗的FLT3-ITD AML或骨髓增生异常综合征(MDS)患者的1/2期临床试验中,根据医生的判断,奎扎替尼与阿扎胞苷或低剂量阿糖胞苷(LDAC)联合使用。在34名先前未接受治疗的患者中,奎扎替尼-阿扎胞苷组的CR/CRi为87%(CR为53%),奎扎替尼-LDAC组为74%(CR为5%),两名患者出现3级QTc延长。接受奎扎替尼与阿扎胞苷联合治疗的患者中位总生存期数值上优于接受LDAC治疗的患者(19.2个月 Vs 8.5个月)。
与其他FLT3抑制剂类似,索拉非尼可根据两项2期研究(NCT01254890和NCT02196857)的数据超说明书使用,这些研究评估了索拉非尼400 mg每日两次联合阿扎胞苷在不适合强化治疗的FLT3-ITD AML患者中的应用。27名患者中有19名(70%)达到CR/CRi,中位缓解持续时间为14.5个月。值得注意的不良反应包括1/2级高胆红素血症(22%)、腹泻(22%)、疲劳(22%)和恶心(19%),以及3/4级感染(26%)和中性粒细胞减少性发热(26%)。
一个关键的未解决问题在于:FLT3抑制剂-HMA联合治疗在FLT3突变AML中的疗效和耐受性与Ven-HMA相比如何?通常来说,FLT3-ITD的存在与对Ven-HMA治疗的缓解率较低相关;在一项针对接受Ven-阿扎胞苷临床试验的FLT3突变患者的汇总分析中,FLT3-ITD和FLT3-TKD患者的CR/CRi率分别为63%和77%,中位总生存期分别为9.9个月和19.2个月。同样,在梅奥诊所对接受Ven-HMA治疗的初治AML的研究中,39名携带FLT3-ITD的患者CR/CRi率为41%,显著低于没有FLT3-ITD的64%。
目前,提高FLT3突变AML疗效的努力利用了FLT3抑制剂之间的临床前协同作用,以及在复发/难治性缓解中观察到的有希望的临床活性。在一项针对不适合强化治疗的初治AML患者的试验中,研究了阿扎胞苷、Ven(第1周期28天,第2周期第1-14天)和吉瑞替尼(第1-28天)的三联疗法(中位年龄71岁,73%为FLT3-ITD)。在30名接受一线治疗的患者中,CR(90%)和CRi(6%)达到96%,93%的患者通过流式细胞术达到MRD阴性。此外缓解也较为持久,仅5例复发,18个月总生存率为72%。显著的不良反应包括3级发热性中性粒细胞减少症(33%)和感染(50%)。地西他滨、奎扎替尼和Ven的三联方案也有类似的高度有效率。最终,在老年和unfit FLT3突变AML患者中比较Ven-阿扎胞苷与Ven-阿扎胞苷和吉瑞替尼联合治疗的2期MyeloMATCH试验(NCT06317649)的结果将影响最优管理。
IDH1/2抑制剂一线治疗
在老年AML患者中,约20%携带异柠檬酸脱氢酶1(IDH1)突变(6%)或IDH2突变(12%-15%),这些突变通常与正常核型和NPM1突变相关。艾伏尼布是一种口服靶向药物,已获美国FDA批准用于治疗初治IDH1突变AML患者,可单药使用或与阿扎胞苷联合使用。关键临床试验中IDH1/2抑制剂在初治AML中的临床活性总结见表3。
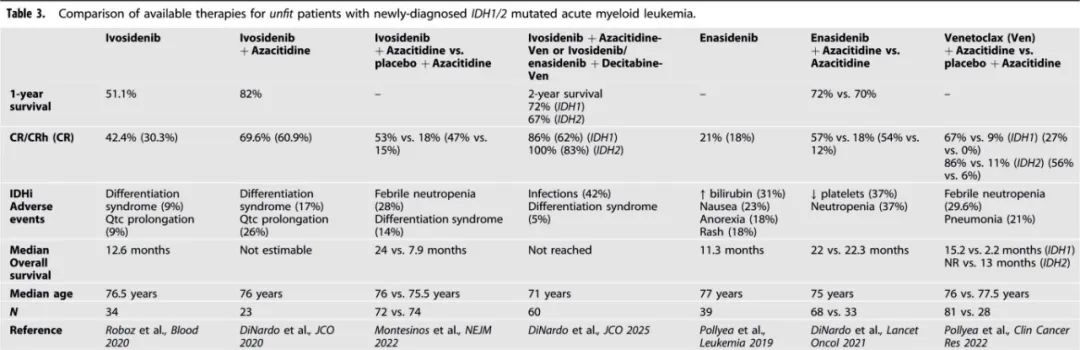
艾伏尼布单药治疗在不适合强化治疗的初治AML中的疗效通过一项1期子研究得以确立,该研究共纳入34名IDH1突变初治AML患者(中位年龄76.5岁),患者每日接受500 mg艾伏尼布治疗。其中42%的患者达到CR/CRi(CR占30%),中位缓解持续时间未达到,62%的患者在1年后仍处于缓解状态。主要不良反应包括分化综合征和QTc间期延长,各占9%。后续的临床前研究表明,将阿扎胞苷与艾伏尼布联合使用可增强分化和凋亡,从而促使开展艾伏尼布-阿扎胞苷在不适合强化治疗的初治AML中的临床研究。研究共纳入23名患者(中位年龄76岁),接受艾伏尼布-阿扎胞苷联合治疗,61%的患者达到CR(中位至CR时间为3.7个月),71%的患者清除IDH1突变,1年生存率为82%。在治疗相关不良反应方面,分化综合征和QTc间期延长的发生率分别为17%和26%。这些发现为艾伏尼布-阿扎胞苷(n=72)对比安慰剂-阿扎胞苷(n=74)的3期临床试验铺平了道路,该试验结果显示,艾伏尼布-阿扎胞苷组的CR/CRi率(54% Vs 16%)和中位总生存期(24个月vs 7.9个月)均更优。
与艾伏尼布不同,enasidenib是一种IDH2突变抑制剂,由于与阿扎胞苷单药治疗相比缺乏生存优势,尚未获批用于一线治疗。在一项针对携带IDH2突变初治AML患者的1/2期研究中,39名患者(中位年龄77岁)每日接受100 mg enasidenib治疗,CR率仅为18%;常见的治疗相关不良事件包括间接高胆红素血症(31%)、恶心(23%)以及疲劳、厌食和皮疹(各18%)。随后开展了一项随机、开放标签的2期研究,比较enasidenib-阿扎胞苷(n=68)与阿扎胞苷单药治疗(n=33)的疗效;enasidenib-阿扎胞苷组57%的患者达到CR/CRi,而阿扎胞苷单药治疗组为18%,但两组的总生存期相似(中位数:22个月 vs 22.3个月)。与阿扎胞苷单药治疗相比,enasidenib-阿扎胞苷治疗更易导致3级或4级不良事件——血小板减少症(37%对比阿扎胞苷单药组的19%)、中性粒细胞减少症(37% vs 25%)和发热性中性粒细胞减少症(16% vs 16%)。
另一项2/1b期研究采用根据风险调整治疗的策略,enasidenib单药治疗不超过5个周期,对于在第5个周期未达到CR/CRi或疾病进展的患者,在enasidenib基础上加用阿扎胞苷。enasidenib单药治疗组(n=60)和enasidenib+阿扎胞苷组(n=17)的CR/CRi率分别为40%和30%。
总体而言,临床试验和真实世界分析均表明,携带IDH1/2突变,尤其是IDH2突变的患者在接受Ven-HMA治疗后显示出良好的反应和生存前景。
在一项针对接受维奈克拉-阿扎胞苷试验治疗的IDH1/2突变患者的汇总分析中,IDH1突变和IDH2突变患者的CR/CRi率分别为67%和86%。IDH2突变和IDH1突变病例的中位总生存期为未达到和15.2个月。值得注意的是,IDH2R172突变的CR/CRi率(93%)高于IDH2R140突变(83%)。
临床前研究和临床研究显示IDH抑制剂与Ven之间具有协同作用。因此,Ven-HMA + IDH抑制剂的三联方案目前正处于积极研究阶段。一项1b/II期研究评估了艾伏尼布 + Ven联合或不联合阿扎胞苷在初治IDH1突变AML患者中的安全性和疗效;双药和三药联组的CR/CR率分别为83%和90%。
此外,与艾伏尼布-Ven双药联合治疗相比,接受三药联合治疗的患者反应更深、更持久,流式细胞术检测的MRD阴性CR/CRi率分别为75%和50%,24个月总生存率分别为75%和58%。此外,在一项最近发表的针对60名携带IDH1/2突变的初治AML患者的汇总分析中,患者因身体状况不适合接受强化治疗,接受IDH抑制剂三联方案(艾伏尼布-Ven-阿扎胞苷或艾伏尼布/enasidenib-口服地西他滨-Ven)治疗,92%的患者达到CR/CRi;2年总生存率为69%,累积复发率为24%。在未接受过HMA或Ven治疗的骨髓增生异常综合征相关初治AML患者中,2年总生存率为84%,累积复发率为20%。一项3期随机试验(EVOLVE-1)正在进行中,旨在确认一线三联方案对IDH1突变 AML的获益。
Menin抑制剂一线治疗
在初治AML的前线治疗中,KMT2A重排(KMT2Ar)在成人AML中较为罕见(约5%),且接受Ven-HMA治疗的生存极差。在梅奥诊所对400名接受Ven-HMA治疗的初治AML患者的分析中,7名(2%)KMT2Ar患者的CR/CRi率为43%,中位总生存期仅2.5个月,凸显了对新疗法的迫切需求。Revumenib是一种首创的Menin抑制剂,已获批用于复发/难治性KMT2Ar,CR率为17.5%,中位总生存期为8个月。近期公布的revumenib与Ven-按这个联合用于一线治疗的研究结果显示,在KMT2Ar患者中,CR/CRi达89%(CR为78%),且所有患者通过流式细胞术检测均为MRD阴性。此外,Menin抑制剂在NPM1突变AML中也显示出活性,在上述研究中,79%的患者达到CR/CRi(CR为65%)。总体而言,三联疗法的安全性良好,不良反应包括分化综合征(19%)和QTc延长(44%),目前通过方案修正已减少每个周期的Ven给药时间,以改善与骨髓抑制相关的并发症。
其他正在研发的Menin抑制剂包括ziftomenib和bleximenib,正在研究与Ven和阿扎胞苷联合使用的疗效。revumenib与地西他滨/cedazuridine和Ven的全口服联合方案也在研究中。计划开展的随机研究将比较三联疗法与Ven-HMA,以评估Menin抑制对缓解率和生存的附加获益。
总结
近年来,人们越来越意识到,对于接受Ven-HMA治疗的unfit初治AML患者,其治疗反应和生存结局具有高度异质性,且与潜在的基因组特征密切相关。鉴于Ven-HMA治疗对绝大多数患者而言并非根治手段,建议采取个体化的治疗选择方法,并在缓解期强烈考虑ASCT。推荐进行全面的二代测序(NGS)检测,或至少检测可靶向的突变,并考虑快速的检测周转时间,以便及时选择适当的治疗方法。重要的是,应避免过度治疗。近期数据显示,在第1个周期减少Ven暴露可诱导与标准28天给药方案相当的缓解率,同时减轻毒性,且不损害总生存期。一项比较14天与28天Ven联合阿扎胞苷的随机研究正在进行中,以解决这一问题。目前的临床试验正在研究Ven-HMA与靶向疗法(FLT3、IDH1/2或Menin抑制剂)的联合应用,以改善具有可采取行动的异常基因组特征患者的反应深度和持久性。这些联合策略还可能减轻靶向肿瘤外的毒性,同时优化整体的获益-风险比。几项正在进行的随机试验将确认三联方案是否为这些不同基因组AML亚组增添价值,即在不增加额外毒性的情况下改善缓解率和总生存期。
参考文献
Gangat, N., Dinardo, C.D. Newly diagnosed acute myeloid leukemia in unfit patients: 2026 treatment algorithms. Blood Cancer J. 15, 139 (2025). https://doi.org/10.1038/s41408-025-01346-1
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)