首页 > 医疗资讯/ 正文
低级别浆液性卵巢癌(LGSOC)是一种罕见的上皮性卵巢癌亚型,占所有上皮性卵巢癌的比例不足10%,与高级别浆液性卵巢癌(HGSOC)在组织病理学、分子特征和临床表型上存在显著差异。其临床特点包括发病年龄较轻、对传统化疗敏感性低,且多数患者在初始治疗后会出现疾病复发。LGSOC主要由丝裂原活化蛋白激酶(MAPK)通路突变驱动,其中Kirsten大鼠肉瘤病毒同源基因(KRAS)突变最为常见,约30%的患者携带该突变。研究显示,KRAS突变型(KRASmt)患者的预后显著优于KRAS野生型(KRASwt)患者。
目前,LGSOC的治疗面临诸多挑战。初始治疗以肿瘤细胞减灭术联合化疗或激素治疗为主,但复发后化疗的客观缓解率(ORR)仅为0%-13%。虽有MEK抑制剂(如曲美替尼、比美替尼)在随机试验中显示出一定活性(ORR分别为26%和16%),但约1/3的患者因毒性反应停药,临床应用受限。因此,探索更有效的治疗方案对改善复发性LGSOC患者预后至关重要。

近期,发表在JClinOncol杂志的一项研究,旨在评估新型MEK抑制剂Avutometinib单药或联合FAK抑制剂Defactinib在复发性LGSOC患者中的疗效和安全性。具体而言,通过比较两种方案的客观缓解率、缓解持续时间、无进展生存期及安全性,确定更优的治疗选择,为复发性LGSOC提供新的治疗策略。
本研究为一项II期、开放标签、多中心随机试验,采用适应性设计,分为4个部分(A-D)。
-
患者分层:入组患者为经≥1线铂类化疗后复发、存在可测量病灶的LGSOC患者,按KRAS突变状态(KRASmt/KRASwt)分层。
-
治疗分组:PartA中患者1:1随机分配至两组:①单药组:Avutometinib4.0mg每周两次(口服,3周用药+1周休息为1周期);②联合组:Avutometinib3.2mg每周两次联合Defactinib200mg每日两次(给药周期同单药组)。经interim分析后,联合组被选为“推进方案”,进入PartB和PartC扩展阶段;PartD则探索低剂量Avutometinib(1.6mg每周两次)联合Defactinib的疗效。
-
主要终点:由盲法独立中心评估(BICR)的客观缓解率(ORR,基于RECISTv1.1标准)。
-
次要终点:包括缓解持续时间(DOR)、无进展生存期(PFS)、安全性及药代动力学特征。
研究方法
1.患者纳入与排除标准
纳入标准:年龄≥18岁;组织学确认的卵巢或腹膜LGSOC;经RECISTv1.1标准评估存在可测量病灶;≥1线含铂化疗后出现影像学或临床进展;允许既往接受过1线MEK或RAF抑制剂治疗;需通过验证试验确认KRAS突变状态。
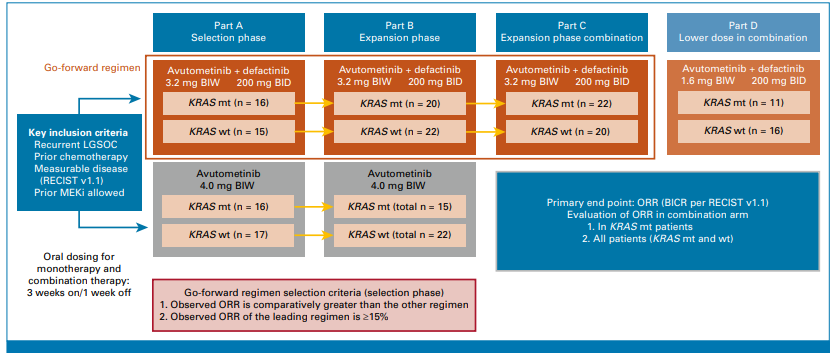
图:研究设计
2.治疗与评估
-
治疗方案:所有患者在治疗前2个周期接受预防性用药(氢化可的松乳膏、保湿剂、防晒霜及全身抗生素)以减少皮疹风险。
-
疗效评估:通过计算机断层扫描(CT)或磁共振成像(MRI)每周期评估肿瘤反应;KRAS突变状态由中心实验室采用TempusxTv4.0LDTNGS检测确认。
-
安全性评估:不良事件(AEs)按美国国家癌症研究所(NCI)通用术语标准(CTCAEv5.0)分级,记录治疗相关AEs的发生率、严重程度及处理措施(如剂量暂停或调整)。
3.统计分析
-
疗效分析基于意向性治疗人群(接受≥1剂研究药物的患者),采用精确二项式检验评估ORR,Kaplan-Meier法估计DOR和PFS,Brookmeyer-Crowley法计算95%置信区间(CI)。
-
样本量计算:假设两组ORR绝对差异≥15%,每组32例患者可保证88%的概率选择最优方案。
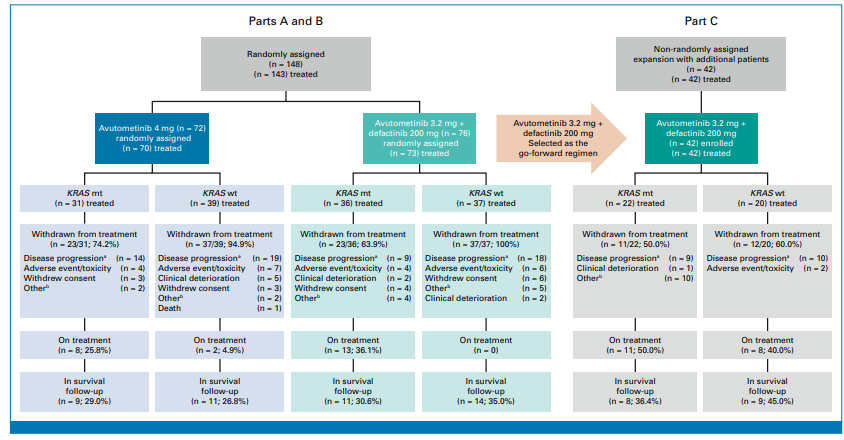
图:患者的治疗流程采用CONSORT流程图展示,适用于A、B、C各部分,并根据KRAS突变状态和治疗分组进行汇总
研究结果
1.患者基线特征
共115例患者接受联合方案治疗,中位既往治疗线数为3(范围1-9),86%接受过激素治疗,51%接受过贝伐珠单抗,22%接受过MEK抑制剂。联合组与单药组(70例)的人口学和基线特征均衡。
2.疗效结果
-
客观缓解率(ORR):联合组经BICR确认的ORR为31%(95%CI:23%-41%),其中KRASmt患者ORR达44%,KRASwt患者为17%;单药组ORR为17%(KRASmt23%,KRASwt13%)。
-
缓解持续时间(DOR):联合组中位DOR为31.1个月(95%CI:14.8-31.1),81%的患者在6个月时维持缓解,72%在12个月时维持缓解。
-
无进展生存期(PFS):联合组中位PFS为12.9个月(95%CI:10.9-20.2),其中KRASmt患者达22.0个月,KRASwt患者为12.8个月。
-
亚组分析:未接受过MEK抑制剂的患者ORR(33%)高于接受过的患者(24%);未接受过贝伐珠单抗的患者ORR(43%)高于接受过的患者(20%)。
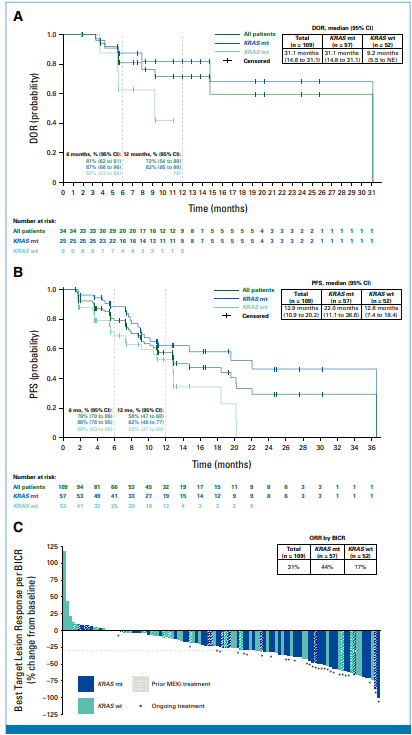
图:(A)由BIRC(盲态独立审查委员会)评估的缓解持续时间(DOR),针对达到完全缓解或部分缓解的患者,采用Kaplan-Meier法计算,时间为首次出现缓解至疾病进展的时间间隔;(B)由BIRC评估的无进展生存期(PFS),在可评估疗效的人群中,根据KRAS突变状态、研究阶段(phase)及治疗分组进行总结;(C)由BIRC评估的目标病灶总和相对于基线的最佳变化百分比(最佳疗效)。
3.安全性结果
-
联合组最常见的≥3级治疗相关AEs为肌酸磷酸激酶(CPK)升高(24%)、腹泻(8%)和贫血(5%)。
-
10%的患者因AEs停药,主要原因是CPK升高(4%);通过剂量暂停或调整可有效管理多数AEs,患者对Avutometinib和Defactinib的相对剂量强度分别为0.84和0.77。
-
皮肤反应(皮疹、痤疮样皮炎等)和眼部事件(视物模糊)多为1-2级,可通过预防性用药或短暂停药缓解。
总之,Avutometinib联合Defactinib在复发性LGSOC中显示出显著疗效:总体ORR达31%,且KRASmt患者获益更显著(ORR44%),中位DOR超过30个月,中位PFS近13个月;安全性可控,因AEs停药率仅10%,显著低于既往MEK抑制剂单药治疗。
该联合方案已获美国FDA加速批准用于KRAS突变的复发性LGSOC患者,并正在III期试验(RAMP301,NCT06072781)中与标准治疗对比,有望成为复发性LGSOC的新标准治疗。
原始出处
BanerjeeSN,VanNieuwenhuysenE,AghajanianC,etal.EfficacyandSafetyofAvutometinibPlusDefactinibinRecurrentLow-GradeSerousOvarianCancer:PrimaryAnalysisofENGOT-OV60/GOG-3052/RAMP201.JClinOncol.2025.DOI:https://doi.org/10.1200/JCO-25-00112.ClinicalTrials.govIdentifier:NCT04625270.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)