首页 > 医疗资讯/ 正文
长期生存(LTS)在多发性骨髓瘤(MM)中定义为单线治疗后生存≥10年。随着蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)、单克隆抗体(mAbs)、自体干细胞移植(ASCT)和新型免疫疗法的引入,MM的治疗取得了显著进展。然而,仅部分患者能够实现长期疾病控制,表明骨髓瘤内在因素和免疫介导机制共同发挥关键作用。
长期生存患者的免疫骨髓微环境(IBME)具有独特的特征,包括增强的T细胞功能、NK细胞毒性增加以及免疫抑制性髓系细胞减少。未来的研究需要整合免疫疗法、微环境调控和MRD导向策略,以推动MM治疗从疾病管理向持续缓解和功能性治愈转变。
内在机制:基因组与表观遗传稳定性
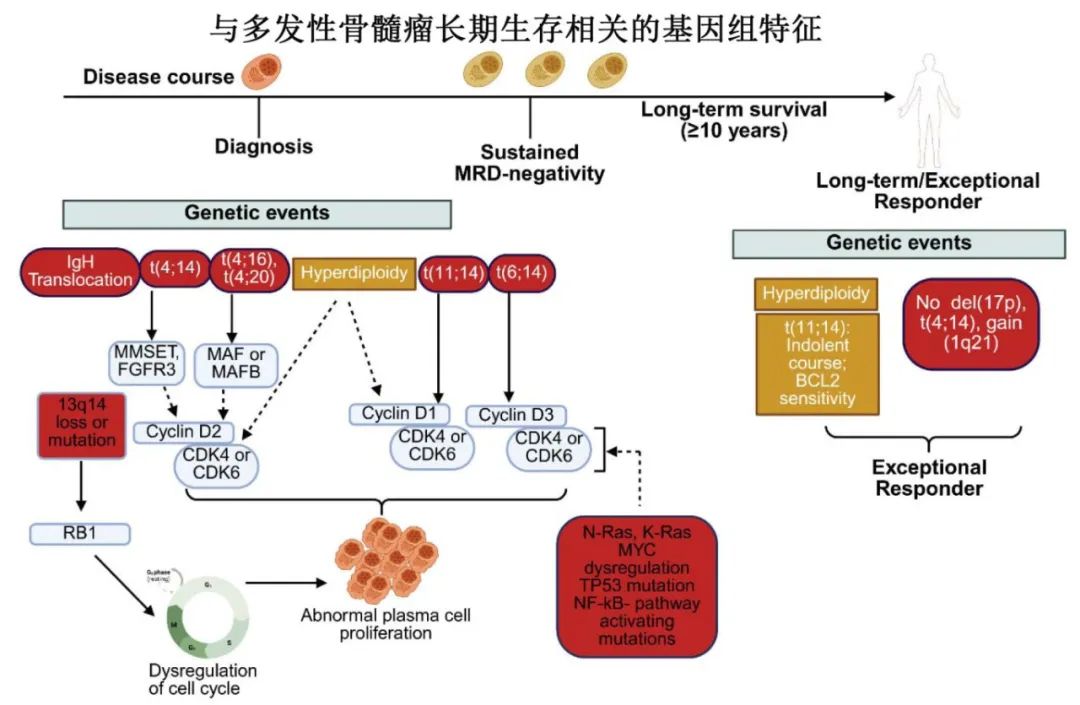
基因组稳定性:LTS患者常表现出更稳定的基因组特征,减少克隆异质性和新抗原负荷,维持免疫监视;如超二倍体(约50%的病例)和缺乏高危细胞遗传学异常(如del(17p)、t(4;14)、t(14;16);但在LTS患者中罕见)。超二倍体与更好的预后相关,而IgH易位(如t(11;14))与对BCL2抑制剂的敏感性增加相关。此外,关键通路(如TP53、NF-κB)的稳定性可抑制炎症和免疫逃逸克隆。
基因组不稳定性:基因组不稳定性是MM的标志,导致克隆多样性、治疗抵抗和疾病进展。LTS患者的基因组稳定性可能减少克隆演化,支持长期疾病控制。
表观遗传学稳定性:LTS患者的骨髓瘤细胞可能保留更稳定的表观遗传景观,限制表型可塑性,减少对骨髓基质(如CXCR4/SDF-1轴)的依赖,增强治疗敏感性。
外在机制:免疫编辑与微环境重塑
1.免疫编辑:MM的免疫编辑是一个动态过程,包括免疫系统的消除、平衡和逃逸三个阶段。
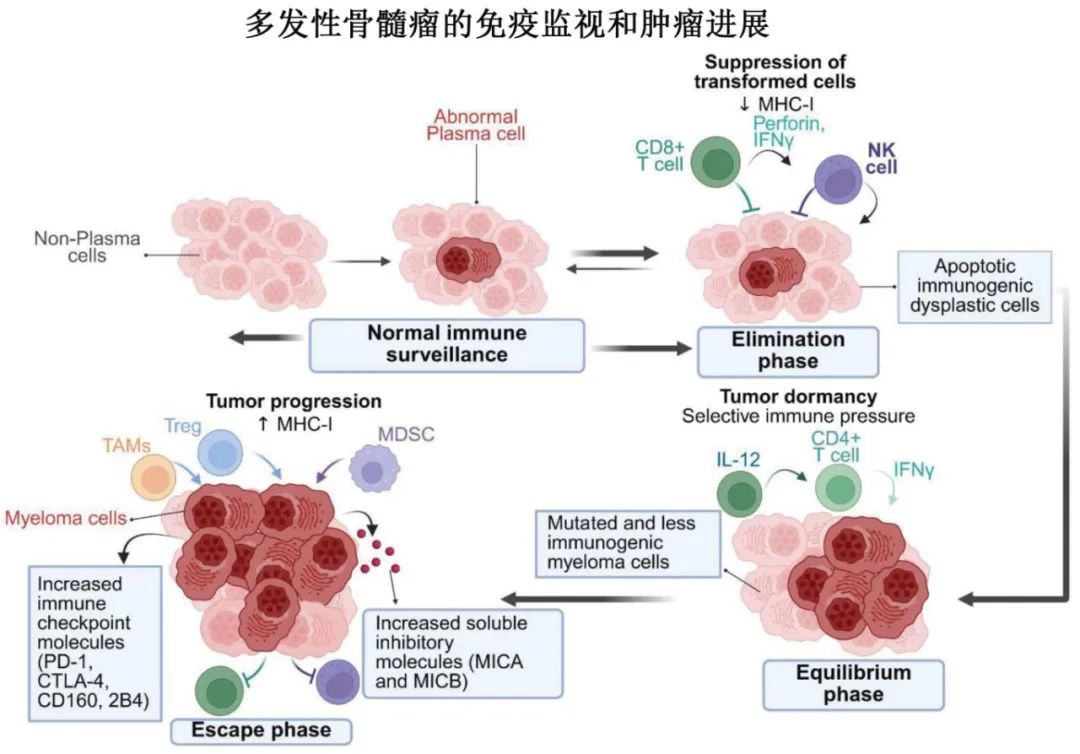
消除阶段:CD8+ T细胞和NK细胞通过穿孔素、颗粒酶B和IFN-γ清除异常浆细胞。
平衡阶段:抗原特异性T细胞(如SOX2反应性)维持肿瘤休眠,IMiDs(如来那度胺)增强此效应。
逃逸阶段:骨髓瘤细胞通过下调MHC I类分子、丢失肿瘤抗原表达、上调免疫检查点分子(如PD-1、CTLA-4)等机制逃避免疫监视。
2.免疫监视和长期免疫调节:LTS患者的骨髓免疫微环境表现出增强的T细胞和NK细胞功能,减少的免疫抑制细胞,以及持续的抗骨髓瘤免疫监视。
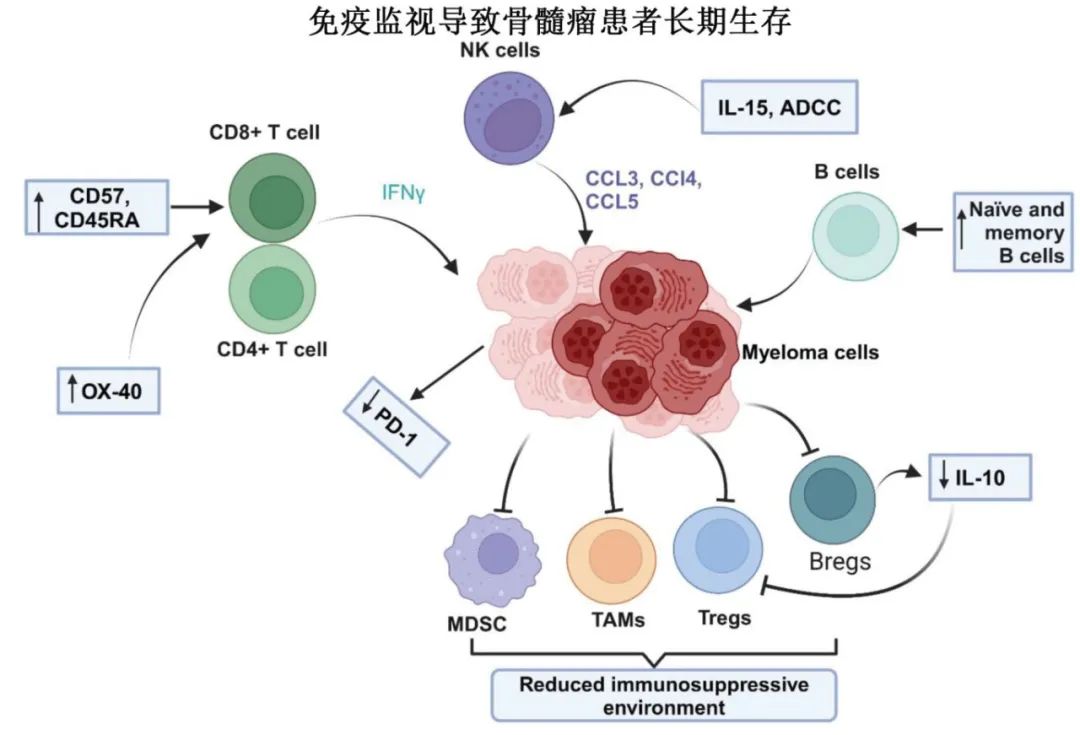
T细胞:LTS患者表现出更高的CD8+细胞毒性T细胞频率和有利的Treg/Th17平衡,增强的IFN-γ产生和CXCR3驱动的骨髓归巢。效应记忆CD8+ T细胞(CD57+、CD45RA+)增多,耗竭标志物减少
NK细胞:LTS患者的NK细胞表现出更强的细胞毒性(NKG2D介导)和炎症趋化因子表达(CCL3、CCL4、CCL5)。
B细胞:LTS患者的B细胞表现出更高的CD19+ B细胞计数,支持抗原呈递和免疫监视。记忆B细胞保留,Bregs减少,维持免疫稳态
治疗干预的影响
IMiD:如来那度胺和泊马度胺,通过下调PD-1、上调OX-40和抑制Tregs来增强T细胞功能。
双抗:通过靶向T细胞上的CD3和浆细胞上的BCMA、GPRC5D、FcRH5等抗原,重定向T细胞以实现强大的抗肿瘤活性。
CAR-T疗法:早期记忆T细胞表型(CD8+CD27+)与持久缓解相关。
未来方向
免疫疗法优化:开发靶向GPRC5D/FcRH5的双抗或CAR-T,克服抗原逃逸。
微环境调控:靶向基质细胞和细胞因子网络(如IL-15),逆转免疫抑制。
精准分层:整合基因组、MRD检测和免疫图谱,识别潜在LTS患者。
参考文献
Kasomva K, et al. Molecular and Immunological Determinants of Long-Term Survival in Multiple Myeloma.Blood Adv . 2025 Jul 17:bloodadvances.2025016829. doi: 10.1182/bloodadvances.2025016829.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)