首页 > 医疗资讯/ 正文
类风湿性关节炎(Rheumatoid Arthritis, RA)是一种慢性、全身性、炎症性的自身免疫疾病1,主要影响小关节,但有些患者会出现大关节受累的情况,比如膝关节,严重的病例需要进行全膝关节置换术(Total Knee Arthroplasty, TKA)2。先前研究表明,骨与软骨的损伤通常导致RA膝关节破坏,但是膝关节的特殊结构——半月板在RA中同样有明显的毁损3。RA半月板毁损是否导致膝关节破坏?RA半月板毁损的机制是什么?目前尚不清楚。
2025年7月28日,中山大学孙逸仙纪念医院关节外科马若凡/许杰团队最新研究成果“CD142-positive synovial fibroblasts drive meniscus destruction in rheumatoid arthritis”于Nature Communications杂志在线发表。该研究阐明,RA的CD142+滑膜成纤维细胞由ABCC4/cAMP/PKA途径侵袭并毁损半月板,首次揭示了RA半月板毁损在膝关节破坏中的重要作用,提出CD142+滑膜成纤维细胞可作为RA侵袭性细胞亚群及RA膝关节预后不良的新指标,为防治RA膝关节破坏提供了新治疗靶点。

在RA病理过程中,滑膜成纤维细胞(Synovial Fibroblast, SF)扮演多重维度的重要角色,不仅是炎症效应细胞,更是关节破坏的核心执行者,是关键治疗靶标。先前发表在Nature正刊的研究表明,位于滑膜衬里下层(Sublining Layer, SL)的 FAPα+THY1+SF会导致严重且持续的炎症,而位于滑膜衬里层(Lining Layer, LL)的 FAPα+THY1-SF则介导骨和软骨损伤4;NOTCH3 信号通路驱动滑膜SL的THY1+SF分化,并加剧炎症反应5。本研究通过scRNA-seq等多种实验手段发现了先前未报道的新SF亚群——CD142+ SF,发现CD142+ SF存在着从滑膜SL转移至LL的空间重构现象,首次在单细胞层面鉴定了RA侵袭性SF亚群。
【主要内容】
1、RA半月板毁损较OA更严重,滑膜衬里层(LL)炎症与半月板毁损显著相关
作者首先从组织学比较骨关节炎(Osteoarthritis, OA)与RA的半月板破坏情况,发现RA半月板内有明显的滑膜细胞侵袭现象,并较OA半月板的毁损更严重。与OA滑膜相比,RA滑膜炎症更显著,RA滑膜LL层炎症与RA半月板的侵袭及毁损显著相关。
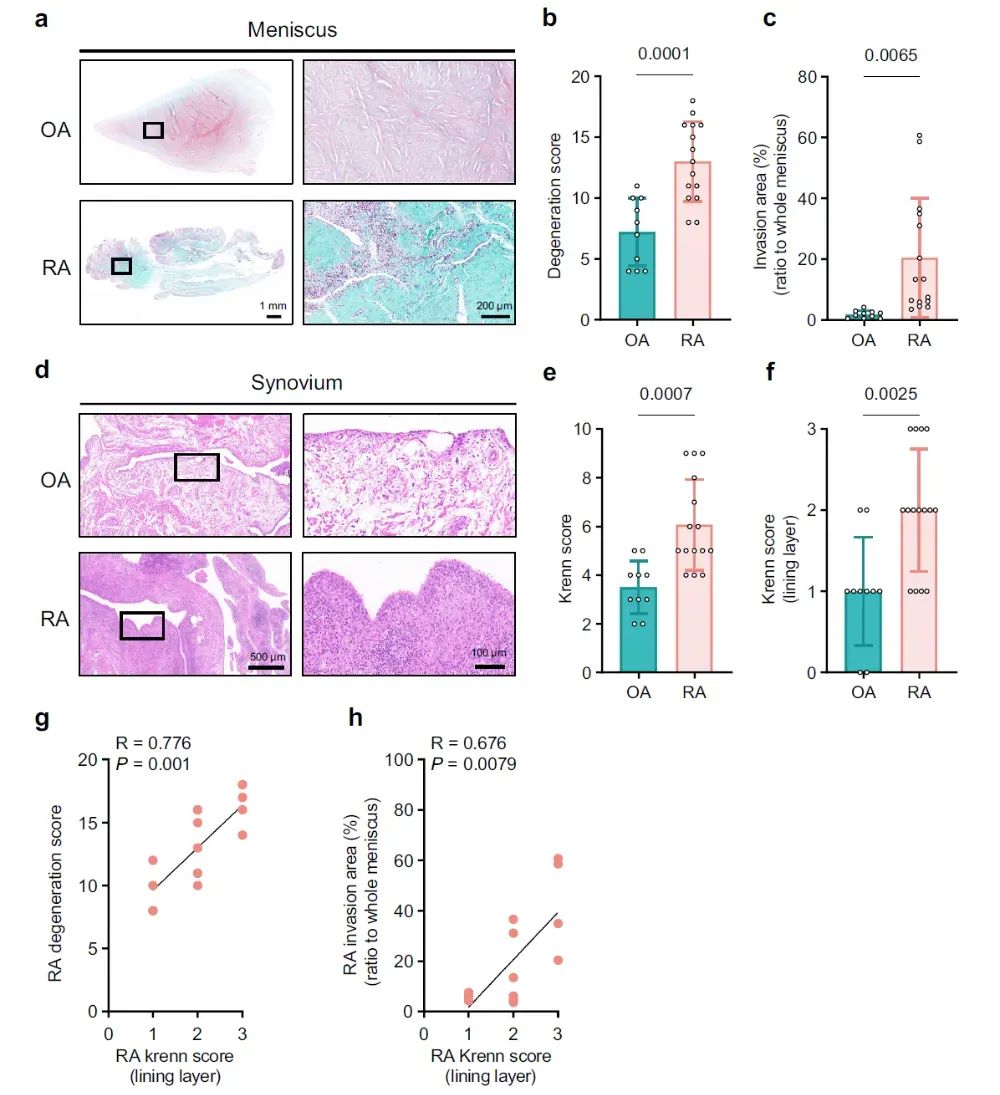
图1 | RA 半月板毁损程度与滑膜LL层炎症程度呈正相关
2、CD142⁺滑膜成纤维细胞(SF)在 RA 膝关节中显著富集
对RA患者膝关节的软骨、滑膜、半月板进行单细胞测序(scRNA-seq),发现SF可分为3个亚群,其中一个SF亚群高表达CD142基因。进一步分析发现CD142+ SF与半月板细胞存在数量最多的配体-受体相互作用,同时CD142+ SF的基因集在成纤维细胞增殖(fibroblast proliferation)、细胞迁移正性调控(positive regulation of cell migration)等通路显著富集,提示CD142+ SF具有潜在的侵袭半月板能力。流式细胞术证实RA 滑膜中CD142+ SF占比显著高于 OA 和正常滑膜组织(RA约达30%),且在关节液沉积中大量表达。小鼠RA模型滑膜中CD142+ SF同样表达升高。
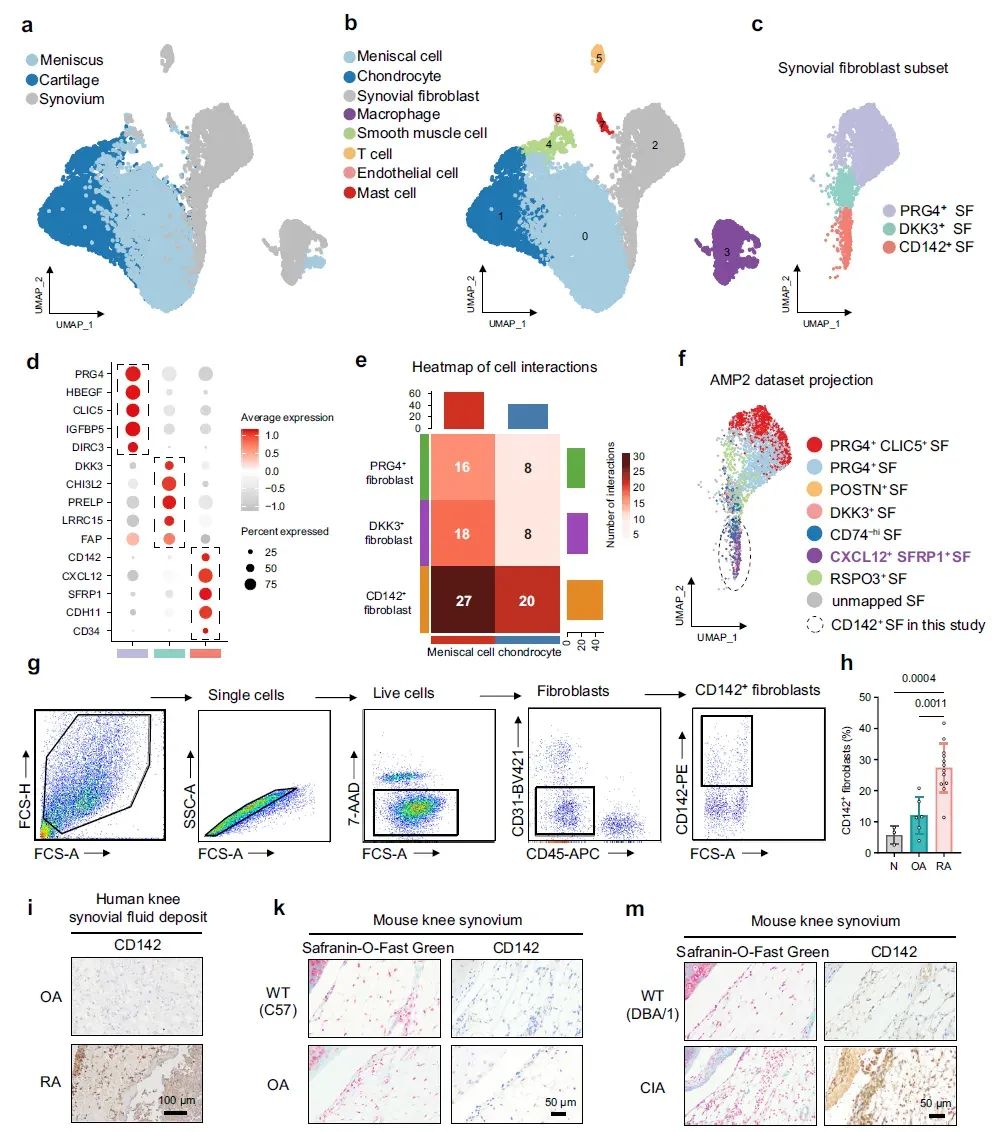
图2 | CD142⁺ SF在 RA 膝关节中显著富集
3、CD142⁺SF在 RA滑膜中的空间重构(SL→LL)
对人类滑膜进行多重荧光免疫组化(mIHC)染色后发现,在正常及OA滑膜中,LL层主要由PRG4+ 细胞构成,CD142+ 细胞位于SL层;而在RA滑膜中,LL层的CD142+ 细胞显著增加,SL层的CD142+ 细胞明显减少,这种空间重构现象表明RA的CD142⁺SF在解剖上更靠近半月板,有利于侵袭;此外,CD142+ 细胞与巨噬细胞标志物CD68并不共表达,说明CD142是独立的成纤维细胞标志物。对RA患者的腕、肘、肩、髋、踝等多个关节的滑膜进行mIHC染色,同样能发现CD142⁺SF存在,并主要存在于LL层。
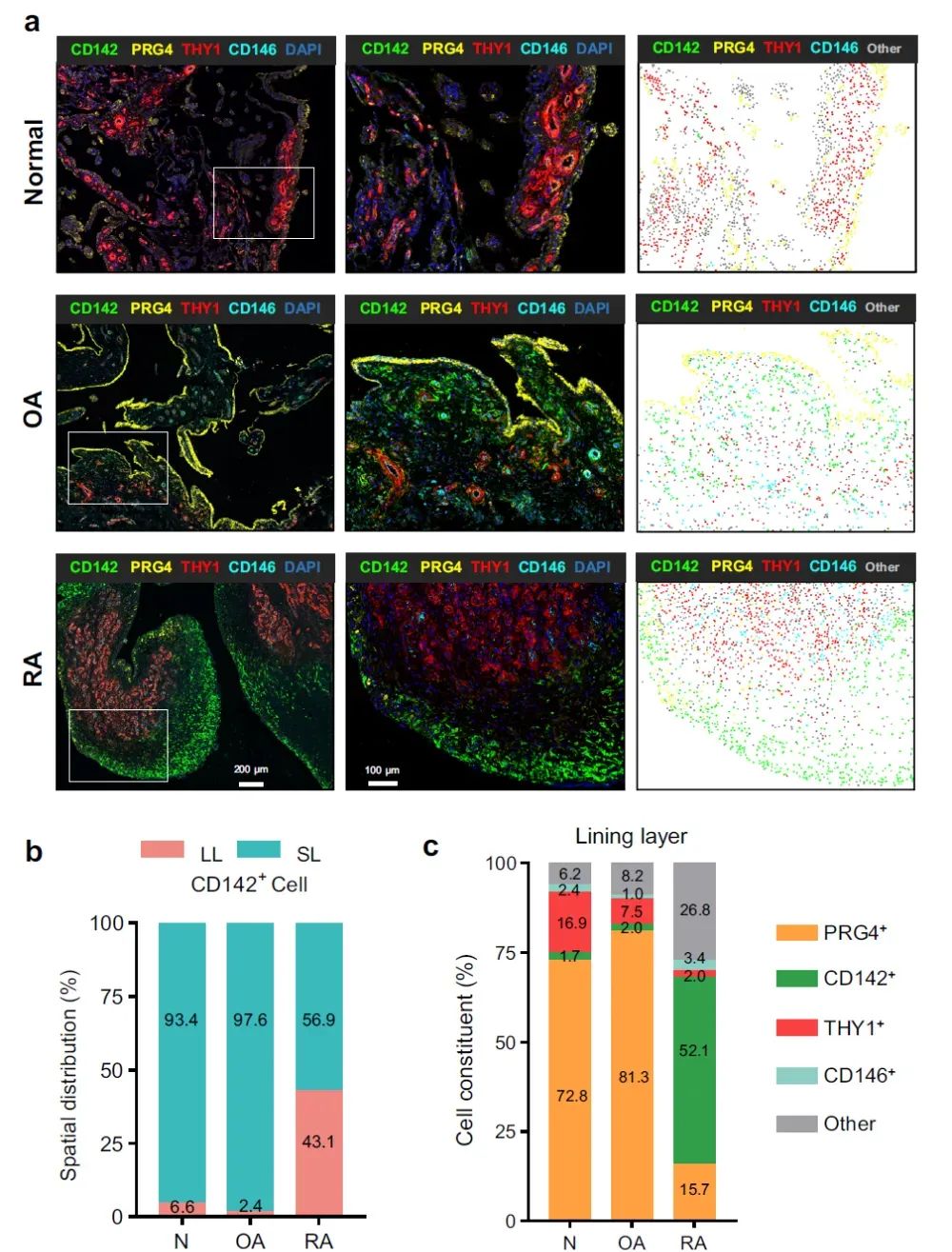
图3 | RA滑膜中CD142⁺ SF的空间重构
4、CD142⁺SF侵袭并毁损RA 半月板
对人类RA半月板及小鼠RA模型半月板进行免疫组化(IHC)染色后发现,半月板内的滑膜侵袭区域高表达CD142。流式细胞术分选出人来源的RA滑膜CD142+ 及CD142- SF并使用CSFE荧光染料标记,对DBA/1小鼠膝关节内注射,每周1次,共4次,分别在12和16周龄时取样。结果表明,CD142+ SF注射组的半月板中有显著的SF粘附和侵袭现象,同时半月板明显毁损。两组在软骨损伤方面,第12周龄时无区别,但第16周龄时CD142+ SF注射组出现更严重的软骨损伤,说明软骨损伤继发于半月板的毁损。此外,共培养实验表明CD142+ SF显著降低了半月板COL1A1基因的表达,Transwell实验证明CD142+ SF具有更强的迁移和侵袭能力。
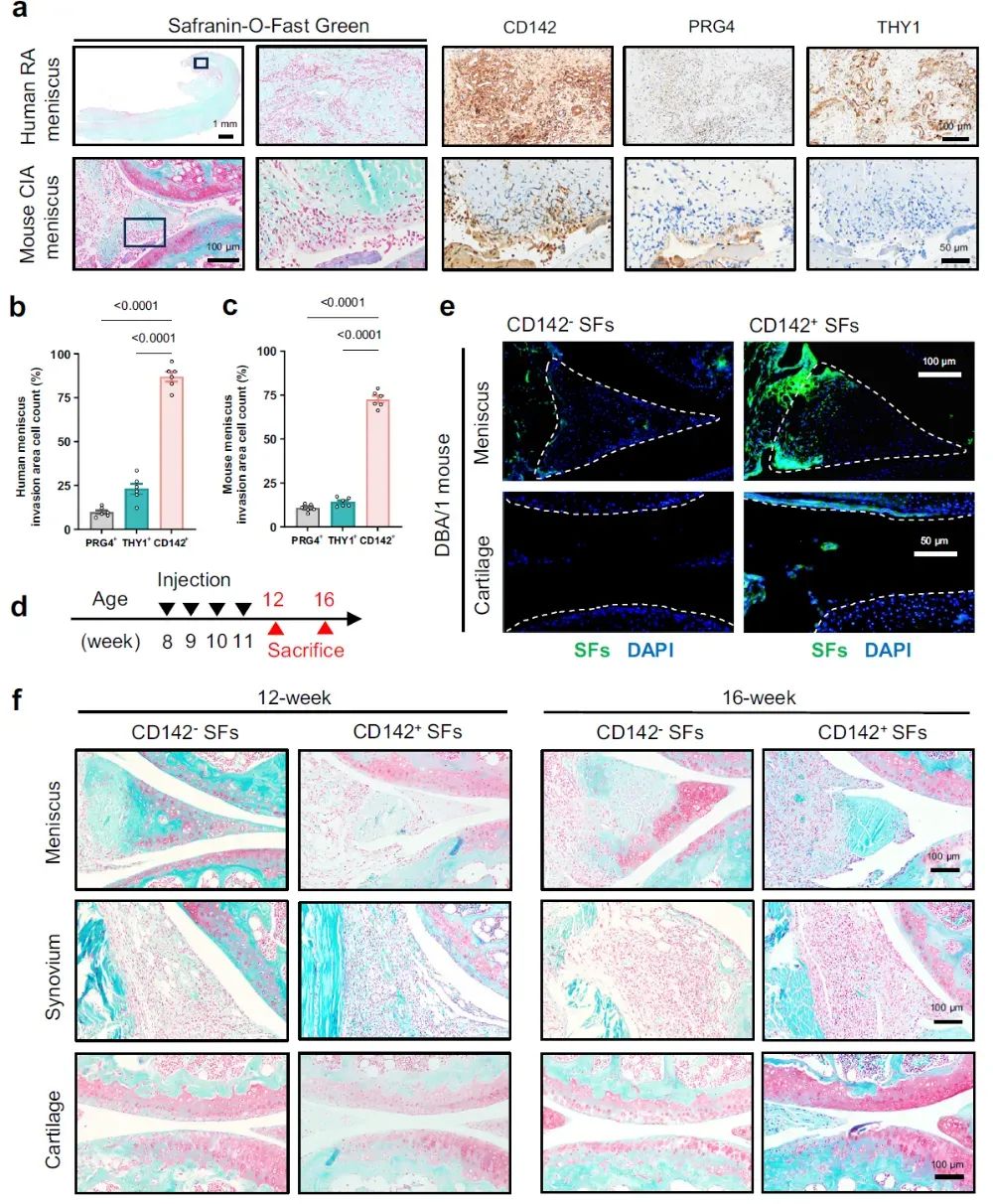
图4 | CD142⁺ SF侵袭并毁损RA半月板
5、CD142⁺SF高表达ABCC4介导侵袭,MK571可抑制其侵袭毁损半月板
转录组测序(Bulk RNA-seq)及IHC染色表明CD142⁺ SF高表达ABCC4,同时高表达细胞迁移/侵袭的相关细胞成分。使用MK571阻断ABCC4可抑制CD142⁺ SF的侵袭能力和改善半月板细胞COL1A1基因表达。动物实验表明同时注射MK571和CD142⁺ SF可减轻半月板毁损。
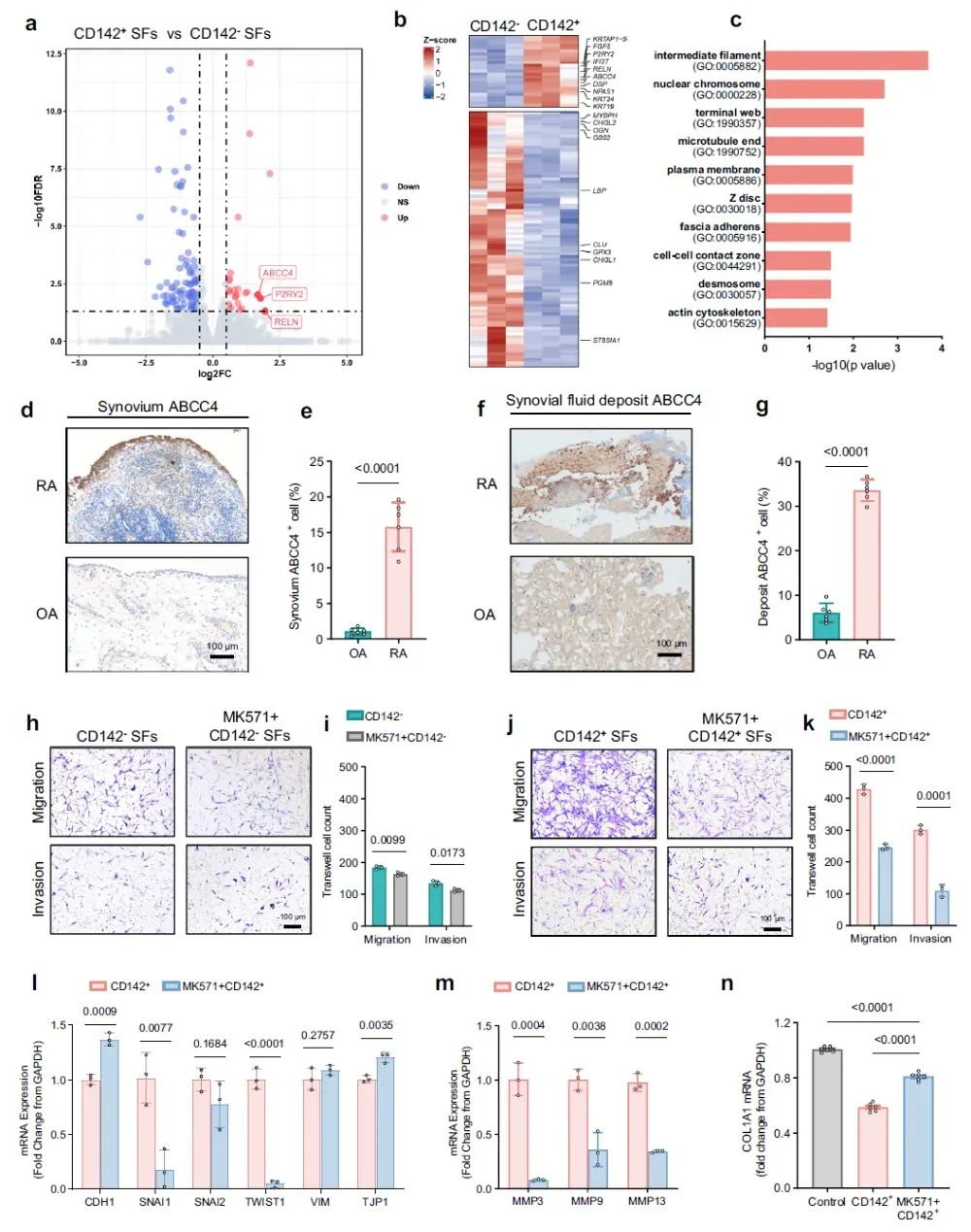
图5 | CD142⁺ SF高表达ABCC4,MK571可抑制CD142⁺ SF侵袭能力
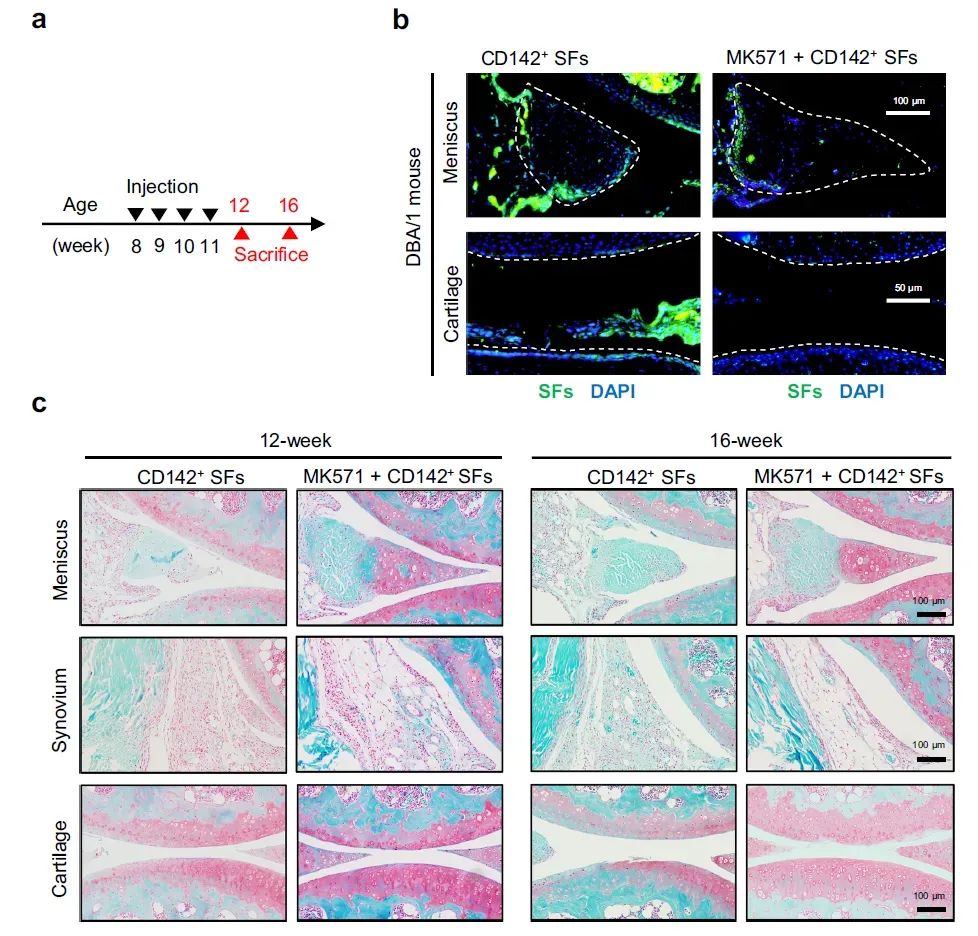
图6 | MK571延缓CD142⁺ SF对半月板的侵袭毁损
6、IL-1β和TNF-α促进CD142⁺SF生成,ABCC4通过cAMP/PKA信号介导侵袭
使用IL-1β、TNF-α、TGF-β、IL-17、IFN-γ五种与RA炎症相关的细胞因子刺激CD142- SF后,发现IL-1β和TNF-α显著促进了CD142的表达,同时CD142⁺ SF的细胞标志物(CXCL12、SFRP1、CDH11等)与ABCC4表达上升。通过ELISA和qRT-PCR实验证实:ABCC4负责cAMP的外流,CD142⁺ SF的胞内cAMP外流增加,导致下游PKA激活受阻,因此SNAI1、SNAI2、TWIST1等迁移相关基因和MMP系列酶基因表达升高,介导CD142⁺ SF的侵袭。
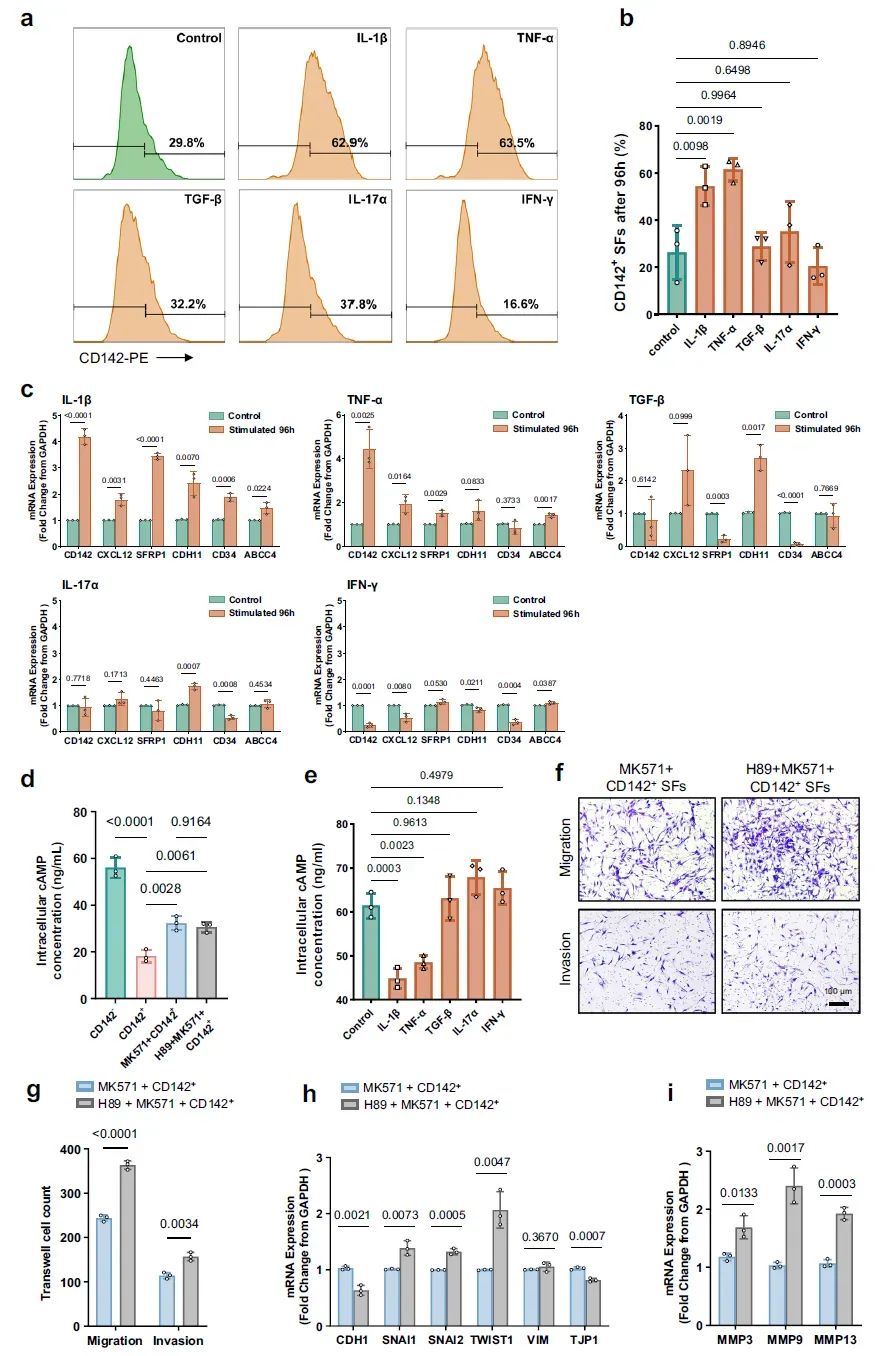
图7 | IL-1β和TNF-α促进CD142⁺ SF生成,ABCC4通过cAMP/PKA信号介导侵袭
7、滑膜LL层高表达 CD142⁺ SF 提示RA膝关节预后不良
研究纳入17 名RA且出现膝关节症状的患者,所有患者均在膝关节疼痛或肿胀的早期阶段接受了滑膜活检。随访时间为 2013 年至 2024 年,根据患者最终是否接受了全膝关节置换术(TKA),将其分为TKA组和non-TKA组。TKA 组的膝关节功能评分(Knee Society Score, KSS)显著低于non-TKA 组,反映其膝功能受损更严重。对两组患者的早期滑膜进行mIHC染色发现,相较于non-TKA组,TKA组的滑膜中LL层高表达CD142+ 细胞,这表明滑膜LL层高表达 CD142⁺ SF可作为RA膝关节功能预后不良的新指标。
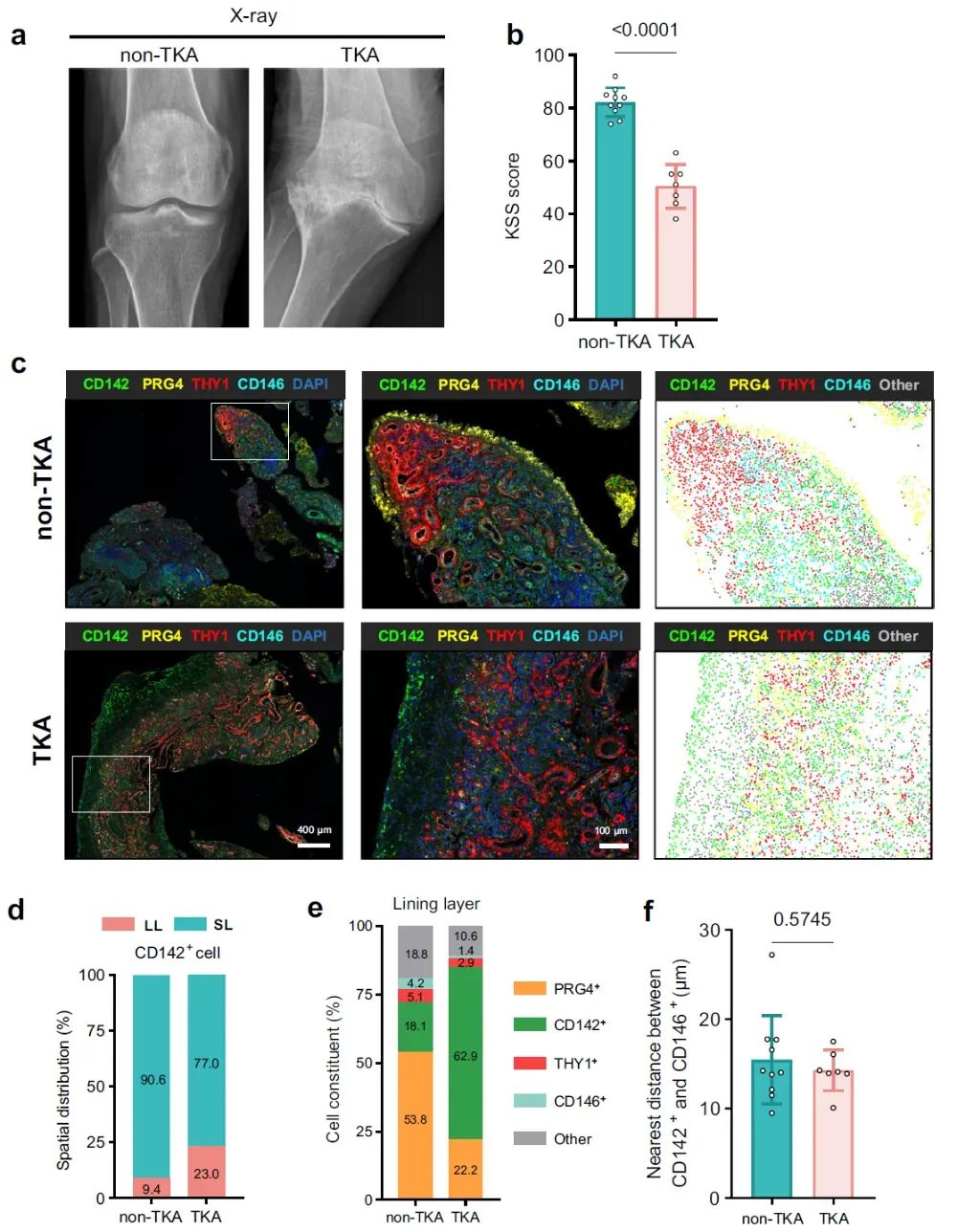
图8 |滑膜衬里层高表达 CD142⁺ SF 提示RA 膝关节预后不良
【研究总结与意义】
本研究发现并鉴定了RA成纤维细胞新亚群——CD142+ SF,在RA中显著增殖,存在由滑膜SL层至LL层的空间重构现象。CD142+ SF通过ABCC4/cAMP/PKA信号侵袭并毁损半月板,这可能是RA膝关节破坏的首要原因。CD142+ SF在RA各大小关节的滑膜中存在,IL-1β 和 TNF-α 能够将 CD142- 细胞转化为 CD142+ 细胞,从而促进RA发展。本研究表明,早期RA患者膝关节滑膜LL层高表达CD142+ SF是严重膝关节破坏甚至需要膝关节置换治疗的风险因素,可以作为评估RA膝关节预后的指标、防治RA膝关节破坏的新靶点。
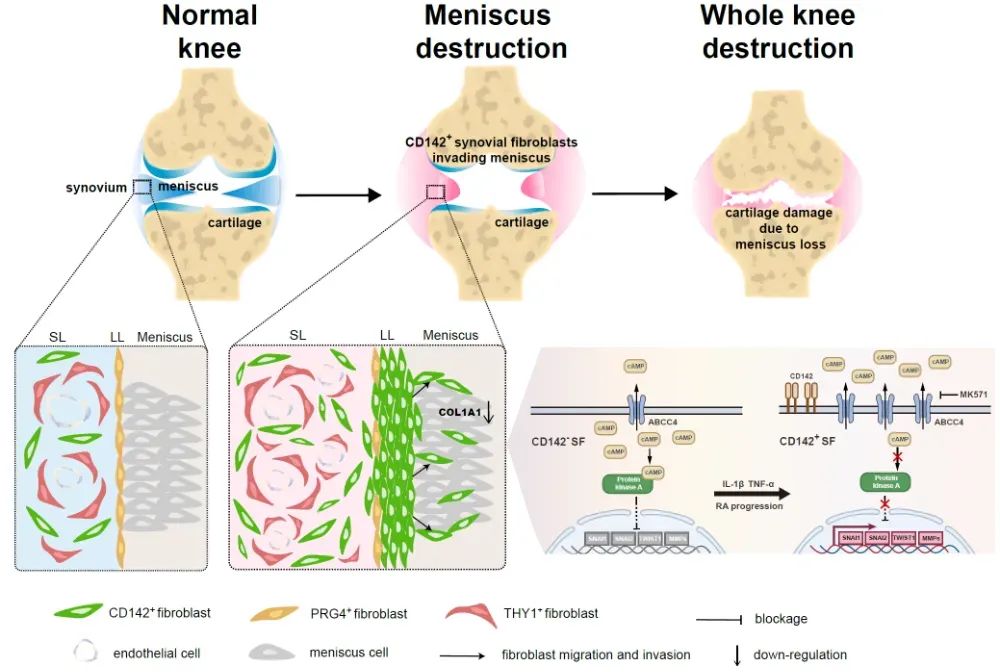
图9 |本研究机制总结示意图
中山大学孙逸仙纪念医院关节外科孙浩副主任医师、林晓滨硕士研究生为本研究的共同第一作者,中山大学孙逸仙纪念医院关节外科马若凡教授为最后通讯作者,中山大学孙逸仙纪念医院关节外科许杰教授、中山大学孙逸仙纪念医院风湿免疫科戴冽教授和华中科技大学附属协和医院骨科魏玉龙教授为共同通讯作者。本研究受国家重点研发计划、国家自然科学基金和广东省基础与应用基础研究基金等项目资助。
参考文献
Smolen, J. S., Aletaha, D. & McInnes, I. B. Rheumatoid arthritis.Lancet 388, 2023–2038 (2016).
Harb,M. A. et al. Have the annual trends of total knee arthroplasty inrheumatoid arthritis patients changed?. J. Knee Surg. 31, 841–845 (2018).
Kimura, C. & Vainio, K. The pattern of meniscus damage in therheumatoid arthritis. Arch. Orthop. Unfallchir 83, 145–151 (1975).
Croft, A. P. et al. Distinct fibroblast subsets drive inflammation anddamage in arthritis. Nature 570, 246–251 (2019).
Wei, K. et al. Notch signalling drives synovial fibroblast identity andarthritis pathology. Nature 582, 259–264 (2020).
原文链接:
https://doi.org/10.1038/s41467-025-61842-7
猜你喜欢
- Schizophrenia:童年创伤对首次发病精神病患者前额叶-边缘系统功能连接的影响
- 官方发文 职称评定对这类医师给予倾斜
- 前列腺炎患者不要滥用抗生素
- 警惕!5种房事意外一定要就医
- 求美护肤别过度 头皮健康看这些标准
- Nat Immunol:华东师范大学卢伟强/刘明耀表明乳酸受体HCAR1驱动结肠直肠癌中免疫抑制性PMN-MDSCs的募集
- European Radiology:深度学习提高了弥漫性胶质瘤动态对比增强MRI的可靠性
- 花椰菜怎么做好吃 花椰菜的家常做法大全
- Front Endocrinol:α受体阻滞剂对肾上腺嗜铬细胞瘤患者术中血流动力学的影响
- 研究证实:聪明人在激烈竞争中活下来,不是靠自己,而是靠这样做
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)