首页 > 医疗资讯/ 正文
肝细胞癌 (HCC) 是癌症相关死亡的主要原因,全身治疗耐药性仍然是一项重大的临床挑战。
2025年8月1日,清华大学董家鸿、王韫芳、柳娟共同通讯在Signal Transduction and Targeted Therapy 在线发表题为“Targeting AKR1B1 inhibits metabolic reprogramming to reverse systemic therapy resistance in hepatocellular carcinoma”的研究论文。该研究探讨了代谢重编程导致HCC全身治疗耐药的机制。我们建立了具有多药耐药特征的HCC细胞系,并观察到这些细胞的代谢活性增强。
整合多组学分析揭示了高活性的葡萄糖-脂质和谷胱甘肽代谢途径,这些途径在支持肿瘤细胞增殖和存活方面发挥着关键作用。该研究构建了HCC耐药细胞的代谢重编程图谱,并确定了醛酮还原酶(AKR1B1)是该重编程的关键调控因子,它通过调节能量代谢和增强应激耐受性来维持耐药性。重要的是,AKR1B1的表达水平与HCC患者的耐药性和不良预后密切相关。AKR1B1的分泌特性不仅强调了其预测价值,而且还促进了耐药性的细胞间传递。在克服耐药性方面,AKR1B1抑制剂依帕司他与标准疗法联合使用可显著降低耐药性。这些发现强调了代谢重编程在HCC耐药性发展中的重要性。AKR1B1是调节代谢重编程的关键酶,已被确定为潜在的生物标志物和治疗靶点,为克服HCC治疗中的耐药性提供了新的见解。

肝细胞癌 (HCC) 是全球癌症相关死亡的主要原因之一,其特点是发病率和死亡率持续居高不下。大多数患者确诊时已处于晚期,因此需要全身治疗作为主要治疗方法。然而,肿瘤对治疗药物的耐药性日益显现,给临床带来了重大挑战,常常导致疗效不佳和预后不良。作为晚期HCC的一线酪氨酸激酶抑制剂,仑伐替尼和索拉非尼尽管具有共同的抗血管生成特性,但其受体靶向特性却截然不同。仑伐替尼强效抑制VEGFR1-3、FGFR1-4和PDGFRα,优先阻断血管生成信号传导。相比之下,索拉非尼除了VEGFR2/3和PDGFRβ外,还广泛靶向RAF激酶,从而实现增殖和血管生成途径的双重抑制。这些不同的选择性模式可能导致了临床实践中观察到的异质性耐药机制。传统上,肿瘤耐药机制被归因于药物外排泵的改变、细胞内信号通路失调、药物代谢的变化以及DNA修复机制增强等因素。HCC通过遗传、信号转导和微环境适应,对仑伐替尼和索拉非尼产生异质性耐药。突变驱动的耐药机制包括维持EGFR通路激活、绕过TKI靶向的KRAS变异。在仑伐替尼耐药模型中,EGFR-STAT3-ABCB1轴的再激活和在索拉非尼难治病例中,FGFR4-ERK通路依赖性证明了信号传导的可塑性。非编码RNA进一步调节耐药表型,其中circTTC13通过SLC7A11上调增强索拉非尼耐受性,而LINC01056的缺失则促进代偿性生存信号传导。微环境的贡献涵盖缺氧诱导的HIF-1α介导的干细胞特性,以及维持治疗耐受性的免疫细胞介导的细胞因子网络。值得注意的是,新出现的证据表明外泌体串扰参与了抗性因子在肿瘤亚克隆之间的传播。随着单细胞转录组学的出现,在单细胞水平上研究抗性相关的细胞异质性并分析抗性细胞的遗传特征的能力提供了前所未有的见解,有助于更精确地阐明治疗耐药的潜在机制。
近年来,肿瘤细胞代谢重编程被认为是一种导致治疗耐药的新机制,引起了该领域的广泛关注。肿瘤代谢重编程是指癌细胞改变其代谢途径以满足对能量和生物合成前体日益增长的需求,从而促进细胞增殖并在不利条件下维持生存的适应性过程。代谢重编程的概念可以追溯到20世纪初,当时Otto Warburg首次报道肿瘤细胞即使在有氧条件下也表现出异常高的糖酵解速率,这一现象如今被认为是癌细胞广泛代谢重组的标志。这种代谢重编程不仅扰乱了传统的代谢网络,而且对肿瘤细胞的增殖、存活、免疫逃避和转移也起着至关重要的作用。随着先进的多组学技术的出现,研究人员越来越专注于表征肿瘤细胞复杂的代谢重编程图谱。这些努力有望揭示耐药的潜在机制,并精确定位影响治疗结果的关键代谢酶。在作者之前对耐药肝癌细胞代谢重编程研究的综述中,报道了与非耐药肝癌细胞相比,耐药肝癌细胞经历了显著的代谢转变,其特征是能量储存增加、能量产生增加和抗氧化能力增强。然而,迄今为止,尚无研究全面整合代谢物和酶水平的分析,以构建耐药性HCC的综合代谢重编程图谱。利用多组学方法为识别新的治疗靶点提供了一个有前景的框架,从而为更有效的HCC治疗策略铺平了道路。
通过整合转录组学、代谢组学和代谢通量分析的方法,该研究鉴定出AKR1B1是与肝细胞癌(HCC)治疗耐药性相关的关键酶靶点。AKR1B1是多元醇途径中的限速酶,它催化葡萄糖还原为山梨糖醇,从而调节细胞代谢和能量稳态。先前的研究表明,在肺癌细胞中,AKR1B1可以与STAT3相互作用,调节胱氨酸转运体SLC7A11的表达,从而促进对酪氨酸激酶抑制剂(TKI)的耐药性。该研究首次揭示了AKR1B1通过调节代谢重编程在介导HCC耐药性中发挥关键作用。然而,其在HCC精准诊断和靶向治疗中的确切作用值得进一步研究。
该研究旨在全面探究HCC治疗耐药性背后的代谢重编程机制,重点阐明与耐药性相关的代谢特征。通过构建耐药性肝癌细胞中葡萄糖和脂质代谢重编程的详细图谱,该研究为理解耐药性背后的代谢适应机制提供了宝贵的见解。值得一提的是,该研究结果强调了AKR1B1作为一种分泌蛋白,具有作为早期检测肝细胞癌耐药性生物标志物的巨大潜力。此外,作为影响耐药性的关键代谢酶,AKR1B1已被确定为联合治疗策略的一个有希望的治疗靶点。更重要的是,研究证明了联合使用依帕司他(一种临床批准的AKR1B1抑制剂,常用于治疗糖尿病周围神经病变)可有效缓解仑伐替尼耐药性。这些发现不仅为理解肝细胞癌耐药机制提供了新的视角,也为开发新型预测性生物标志物和旨在克服肝细胞癌耐药性的治疗方法奠定了理论基础。
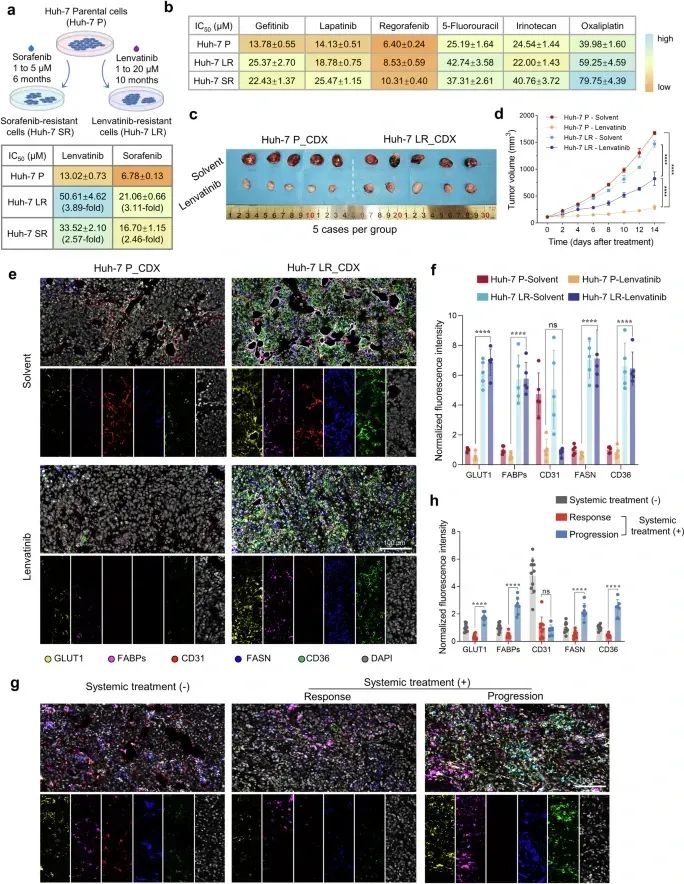
图1 耐药细胞的多重耐药性和相关代谢适应(图源自Signal Transduction and Targeted Therapy)
参考消息:
https://www.nature.com/articles/s41392-025-02321-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)