首页 > 医疗资讯/ 正文
摘 要
目的 探索青少年单、双相抑郁障碍患者炎症细胞因子水平的差异。
方法 纳入年龄15~24岁的重性抑郁障碍患者32例(单相组)、双相障碍抑郁发作患者53例(双相组)、健康对照25名(对照组)。采用17项汉密尔顿抑郁量表(17-item Hamilton depression scale,HAMD-17)、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)、32项轻躁狂症状清单(32-item hypomania checklist,HCL-32)评定患者的临床症状;采用酶联免疫吸附测定法检测所有受试者外周血的血清炎症细胞因子水平。
结果 与单相组相比,双相组发病年龄更小、总病程更长、本次病程更短、HAMD评分更低、HCL-32评分更高,差异有统计学意义(P<0.05)。三组间白介素(interleukin,IL)-1β、IL-6、干扰素γ(interferon-γ,INF-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、肿瘤坏死因子受体2(tumor necrosis factor receptor 2,TNFR2)、IL-4、IL-10、IL-13水平比较差异有统计学意义(P<0.05)。两两比较显示,和对照组相比,单相组和双相组的促炎细胞因子IL-1β、IL-6、TNF-α水平升高(均P<0.05),而抗炎细胞因子IL-4、IL-10、IL-13水平降低(均P<0.05);双相组INF-γ、TNFR2水平高于对照组(P<0.05);与单相组相比,双相组的INF-γ [43.25(29.27,53.63)pg/mL vs. 62.76(39.27,89.16)pg/mL]、IL-13 [16.92(14.74,24.02)pg/mL vs. 22.29(17.35,36.52)pg/mL]升高。多因素logistic回归分析显示,IL-13(OR=1.078,95%CI:1.011~1.150,P=0.022)与双相抑郁障碍独立相关联。
结论 青少年单、双相抑郁障碍患者存在炎症细胞因子的改变,双相障碍抑郁发作患者的IL-13、INF-γ水平高于重性抑郁障碍患者,较高水平的IL-13与双相障碍抑郁发作具有相关性。
关键词
青少年;双相障碍;重性抑郁障碍;炎症;细胞因子;促炎细胞因子;抗炎细胞因子;IL-13
重性抑郁障碍(major depressive disorder, MDD)和双相障碍(bipolar disorder, BD)是常见的精神障碍,误诊率高,且发病机制尚未阐明。有研究显示青少年MDD的患病率达2.0%,是青少年病残的原因之一[1-2]。由于青少年时期抑郁症状不典型,临床上两者诊断存在困难。有研究发现最初诊断为MDD的青少年中,高达50%会转化为双相谱系障碍[3],因此亟需客观的诊断标志物或稳定的测量指标。关于MDD和BD的研究显示,心境障碍患者的外周免疫标志物水平升高[4-6]。然而其研究主要集中在成年患者,鲜有研究对青少年患者的炎症细胞因子进行分析。本研究探讨青少年MDD和BD抑郁发作患者的炎症细胞因子水平差异,为阐明炎症假说在MDD和BD的发病机制提供依据。
1 对象与方法
1.1 研究对象
患者组为2020年4-11月在河北省精神卫生中心住院的MDD和BD抑郁发作患者。采用简明国际神经精神访谈中文版(mini international neuropsychiatric interview,MINI)进行访谈。
1.1.1 单相组
入组标准:①年龄15~24岁;②符合《精神障碍诊断与统计手册第5版》(Diagnostic and Statistical Manual of Mental Disorders, 5th Edition, DSM-5)“重性抑郁障碍”的诊断标准;③17项汉密尔顿抑郁量表(17-item Hamilton depression scale,HAMD-17)总分≥18分;④受教育年限≥6年;⑤近1个月内未服用精神科药物。排除标准:①存在颅脑器质性疾病;②有严重的心、肝、肾、内分泌、免疫等躯体疾病;③符合DSM-5中其他精神障碍诊断标准;④妊娠或哺乳期女性;⑤入组前3个月曾接受过激素治疗,服用过免疫调节药物或其他可能影响神经内分泌的药物。共收集32例患者。
1.1.2 双相组
入组标准:①年龄15~24岁;②符合DSM-5“双相Ⅰ型障碍,目前为重性抑郁发作”或“双相Ⅱ型障碍,目前为重性抑郁发作”的诊断标准;③HAMD-17总分≥18分;④受教育年限≥6年;⑤近1个月内未服用精神科药物。排除标准同单相组。共收集53例患者。
1.1.3 对照组
采用广告方式招募健康对照。入组标准:①年龄15~24岁;②不符合DSM-5中任何精神疾病诊断标准;③无精神疾病家族史。排除标准:①存在颅脑器质性疾病;②有严重的心、肝、肾、内分泌、免疫等躯体疾病;③妊娠或哺乳期女性;④入组前3个月曾接受过激素治疗,服用过免疫调节药物或其他可能影响神经内分泌的药物。共收集25名对照。
本研究获得河北省精神卫生中心伦理委员会的审核批准(审批号:202007)。受试者进入研究前签署知情同意书。
1.2 研究方法
1.2.1 一般情况调查 采用自制调查表收集受试者的一般资料,包括年龄、性别、体质指数(body mass index,BMI)、精神疾病家族史、发病年龄、病程等。
1.2.2 临床量表评估
采用HAMD-17评定患者的抑郁症状;采用汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)评定患者的焦虑症状;采用32项轻躁狂症状清单(32-item hypomania checklist,HCL-32)筛查轻躁狂症状,作为BD筛查的辅助工具。以上量表由同1名中级职称精神医学专科医师在受试者入组前1 d独立完成。
1.2.3 外周血炎症细胞因子检测
采集所有受试者清晨空腹肘静脉血5 mL于促凝管中,室温下血样放置2 h后进行3000 r/min离心20 min,离心半径为8 cm,分离血清,置于-80 ℃保存以用于检测血清炎症细胞因子水平。待所有样本收集完毕后冷链运输(温控条件:-25~-15 ℃)至武汉莱康生物科技股份有限公司,采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测所有样本的炎症细胞因子水平,操作步骤严格遵循武汉伊莱瑞特生物科技股份有限公司的试剂盒说明书进行。检测的炎症细胞因子包括促炎细胞因子白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、干扰素γ(interferon-γ,INF-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)、肿瘤坏死因子受体2(tumor necrosis factor receptor 2,TNFR2),以及抗炎细胞因子白介素4(interleukin-4,IL-4)、白介素10(interleukin-10,IL-10)、白介素13(interleukin-13,IL-13)。
1.3 统计学方法
采用SPSS 26.0进行统计分析。性别、精神疾病阳性家族史采用例数(构成比)描述,组间比较应用χ2检验;BMI等正态分布资料采用x±s描述,组间比较应用单因素方差分析;年龄、发病年龄、总病程、本次病程、HAMD-17总分、HAMA总分及炎症细胞因子等非正态分布资料采用M(QL,QU)描述,两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis H检验,两两比较使用Bonferroni法校正。以单相组、双相组为研究对象,BD为因变量,将单因素分析中有统计学意义的变量作为自变量进行二分类logistic回归分析。检验水准α=0.05,双侧检验。
2 结果
2.1 一般资料
三组间年龄(H=1.245,P=0.537)、性别(χ2=0.112,P=0.946)、BMI(F=1.416,P=0.247)差异无统计学意义。单相组和双相组发病年龄(Z=2.048,P=0.015)、总病程(Z=2.470,P=0.003)、本次病程(Z=4.347,P<0.001)、HAMD-17总分(Z=2.410,P=0.008)、HCL-32总分(Z=3.755,P=0.001)差异有统计学意义,单相组和双相组的精神疾病阳性家族史(χ2=0.699,P=0.403)、HAMA总分(Z=0.584,P=0.579)差异无统计学意义。见表1。
表1 三组间一般资料比较Tab.1 Comparison of general data among the three groups

注:BMI,体质指数;HAMD-17,17项汉密尔顿抑郁量表;HAMA,汉密尔顿焦虑量表;HCL-32,32项轻躁狂症状清单。1)与单相组比较,经Wilcoxon秩和检验,P<0.05。
2.2 炎症细胞因子水平
三组间IL-1β(H=24.930,P<0.001)、IL-6(H=8.304,P=0.016)、INF-γ(H=22.941,P<0.001)、TNF-α(H=17.122,P<0.001)、IL-4(H=31.214,P<0.001)、IL-10(H=15.741,P<0.001)、IL-13(H=28.715,P<0.001)、TNFR2(H=11.595,P=0.003)水平比较差异有统计学意义。两两比较显示:单相组和双相组的促炎细胞因子IL-1β、IL-6、TNF-α高于对照组(均P<0.05),而抗炎细胞因子IL-4、IL-10、IL-13低于对照组(均P<0.05);双相组INF-γ(P<0.001)、TNFR2(P=0.003)高于对照组;双相组INF-γ(P=0.010)、IL-13(P=0.018)高于单相组。三组间TNFR1差异无统计学意义(H=1.843,P=0.398)。见表2。
表2 三组间炎症细胞因子水平比较Tab.2 Comparative of inflammatory cytokines among the three groups

注:IL-1β,白介素1β;IL-6,白介素6;INF-γ,干扰素γ;TNF-α,肿瘤坏死因子α;IL-4,白介素4;IL-10,白介素10;IL-13,白介素13;TNFR1,肿瘤坏死因子受体1;TNFR2,肿瘤坏死因子受体2。细胞因子水平用M(QL,QU)描述。1)与对照组比较,经Kruskal-Wallis H检验,Bonferroni法校正,P<0.05;2)与单相组比较,经Kruskal-Wallis H检验,Bonferroni法校正,P<0.05。
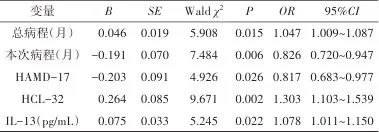
2.3 单、双相抑郁障碍患者的多因素logistic回归分析 以双相抑郁障碍为因变量,以发病年龄、总病程、本次病程、HAMD-17、HCL-32、炎症细胞因子为自变量对单、双相组进行多因素logistic回归分析,结果显示,总病程(OR=1.047,95%CI:1.009~1.087,P=0.015)、本次病程(OR=0.826,95%CI:0.720~0.947,P=0.006)、HAMD-17(OR=0.817,95%CI:0.683~0.977,P=0.026)、HCL-32(OR=1.303,95%CI:1.103~1.539,P=0.002)、IL-13(OR=1.078,95%CI:1.011~1.150,P=0.022)与双相抑郁障碍独立相关。见表3。
表3 双相抑郁障碍多因素logistic回归分析Tab.3 Multivariate logistic regression analysis of bipolar depression
3 讨论
本研究发现,在青少年群体中,单、双相抑郁障碍患者促炎细胞因子IL-1β、IL-6、INF-γ、TNF-α水平高于对照组,而抗炎细胞因子IL-4、IL-10、IL-13水平低于对照组,这与成年患者中的研究结果类似。针对成年人的多项研究表明,抑郁障碍患者炎症细胞因子IL-1β、IL-6、INF-γ和TNF-α水平增高,而IL-4、IL-10和IL-13表达下降[7-12]。BD患者中,血清炎症因子TNF-α、IL-8高于健康对照组[13]。目前关于青少年情绪障碍细胞因子水平的研究较少。我国一项横断面研究发现与健康对照相比,首发青少年抑郁症患者的IL-6、IL-2、IL-1β和TNF-α显著升高[14]。另外,针对首发和复发青少年抑郁症患者的研究发现,首发组血浆IL-6水平较健康对照组显著升高,且较高水平的血浆IL-6与首发青少年抑郁症患者较严重的抑郁症状具有相关性,是重度抑郁的危险因素[15]。目前有限的研究表明,BD青少年的IL-1β血浆水平显著高于健康对照[16]。与对照组相比,双相躁狂和MDD急性期患者血清中IL-6、TNF-α两种细胞因子水平显著升高[17]。本研究发现,双相组TNFR2高于对照组。TNFR2在免疫细胞、内皮细胞和神经元细胞中表达,能优先与TNF-α结合,负责将TNF-α的信号转导为细胞内信号,可能反映了TNF-α的活性[18-19]。ZAZULA等[20]发现血清TNFR2水平和神经认知功能呈负相关。TEIXEIRA等[21]报道双相障碍抑郁发作患者的血浆TNFR2较对照组明显升高。既往研究均在成年患者群体中进行,本研究进一步证明青少年BD患者亦存在TNFR2的改变。这些研究表明无论是青少年MDD还是BD患者均存在体内免疫炎症失调,而这可能是青少年情感障碍疾病发生和发展的重要因素。
本研究发现,在青少年群体中,双相组INF-γ、IL-13高于单相组。既往SKIBINSKA等[22]研究表明,BD青少年IL-8与TNF-α水平高于抑郁障碍青少年,而本研究未发现TNF-α水平存在差异,与既往研究结果不一致,分析原因可能是由于研究样本量偏少、检测血液样本不同(血清、血浆)和检测方法的不同。另外,本研究发现,双相组INF-γ水平高于单相组。INF-γ具有抗病毒、调节细胞生长和分化、调控免疫功能等多种作用[23]。有研究表明,约25%的慢性丙型肝炎患者在接受促炎细胞因子INF-γ治疗后出现类似抑郁症的表现[24]。KIM等[25]发现,与健康对照相比,未经治疗的成年躁狂症患者在入院时INF-γ水平升高。本研究进一步证实在青少年BD抑郁发作患者中同样存在INF-γ水平的升高。
本研究进一步以单相组和双相组患者为研究对象进行分析,logistic回归分析显示总病程、本次病程、HAMD-17、HCL-32、IL-13水平与BD独立相关。IL-13是由活化的T淋巴细胞分泌产生的具有免疫抑制和抗炎作用的细胞因子。在大鼠小胶质细胞离体实验中,IL-13可通过激活c-Jun氨基端蛋白激酶(c-Jun N-terminal protein kinase,JNK)信号通路,促进环氧合酶2表达升高,进一步诱导小胶质细胞凋亡,缓解大脑炎症反应[26]。既往有研究表明,MDD成年患者的自杀未遂史和血浆IL-13水平之间存在关联,提示IL-13可能作为MDD患者自杀的新候选标志物[27]。国内研究也发现,IL-13明显降低可能是青少年伴自杀自伤患者的生物学指标之一[28]。然而目前BD中关于IL-13的研究鲜有报道,未来还需要更多的研究来验证。另外,本研究还发现,与MDD相比,BD总病程长、本次抑郁发作期短、抑郁程度轻、HCL-32评分更高,这与既往研究结果一致[29-31]。
综上所述,青少年单、双相抑郁障碍患者存在炎症细胞因子的改变,这为进一步研究炎症因素在青少年单、双相抑郁障碍发生机制中的作用提供了基础。本研究中,双相组IL-13、INF-γ水平高于单相组,较高水平的IL-13与BD具有相关性,未来若能将IL-13和INF-γ的监测纳入青少年抑郁障碍患者的常规检查项目,有望提高对BD的早期识别率,从而为早期干预策略的制定提供依据。本研究也存在一定的局限性:一是横断面研究,缺乏动态监测,无法推断在青少年群体中单、双相抑郁障碍与炎症的因果关系;二是研究样本量较小;三是没有区分BD的不同亚型及不同发作期。今后的研究将扩大样本量,纳入不同分型分期患者进行长期随访。
参考文献:
1. SHOREY S, NG E D, WONG C. Global prevalence of depression and elevated depressive symptoms among adolescents: A systematic review and meta-analysis[J]. Br J Clin Psychol, 2022, 61(2): 287-305.
2. 吴百川, 孙晨寅, 张慧凤, 等. 重视炎症细胞因子研究在青少年抑郁症临床实践中的价值[J]. 中华精神科杂志, 2024, 57(1): 8-11.
3. SKIBINSKA M, RAJEWSKA-RAGER A, DMITRZAK-WEGLARZ M, et al. Interleukin-8 and tumor necrosis factor-alpha in youth with mood disorders-A longitudinal study[J]. Front Psychiatry, 2022, 13: 964538.
4. KÖHLERKÖHLER C A, FREITAS T H, MAES M, et al. Peripheral cytokine and chemokine alterations in depression: A meta-analysis of 82 studies[J]. Acta Psychiatr Scand, 2017, 135(5): 373-387.
5. GOLDSMITH D R, RAPAPORT M H, MILLER B J. A meta-analysis of blood cytokine network alterations in psychiatric patients: Comparisons between schizophrenia, bipolar disorder and depression[J]. Mol Psychiatry, 2016, 21(12): 1696-1709.
6. 吕楠, 李金红, 付冰冰, 等.外周血免疫炎症指标在疾病早期区分单双相抑郁的价值[J]. 神经疾病与精神卫生, 2023, 23(4): 234-239.
7. SUNESON K, GRUDET C, VENTORP F, et al. An inflamed subtype of difficult-to-treat depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2023, 125: 110763.
8. MYINT A M, LEONARD B E, STEINBUSCH H W, et al. Th1, Tp, and Tp cytokine alterations in major depression[J]. J Affect Disord, 2005, 88(2): 167-173.
9. SONG C, HALBREICH U, HAN C, et al. Imbalance between pro- and anti-inflammatory cytokines, and between Th1 and Tp cytokines in depressed patients: The effect of electroacupuncture or fluoxetine treatment[J]. Pharmacopsychiatry, 2009, 42(5): 182-188.
10. DHABHAR F S, BURKE H M, EPEL E S, et al. Low serum IL-10 concentrations and loss of regulatory association between IL-6 and IL-10 in adults with major depression[J]. J Psychiatr Res, 2009, 43(11): 962-969.
11. MIN X, WANG G, CUI Y, et al. Association between inflammatory cytokines and symptoms of major depressive disorder in adults[J]. Front Immunol, 2023, 14: 1110775.
12. HOWREN M B, LAMKIN D M, SULS J. Associations of depression with C-reactive protein, IL-1, and IL-6: A meta-analysis[J]. Psychosom Med, 2009, 71(2): 171-186.
13. 刘显林, 李春阳. 双相障碍与白细胞介素及肿瘤坏死因子的相关研究进展[J]. 中外医学研究, 2023, 21 (15): 173-177.
14. 杨磊, 牛琪惠, 连楠, 等. 首发青少年抑郁症患者认知功能与细胞因子的关联性研究 [J]. 中国实用医刊, 2021, 48(2): 1‐4.
15. 杨铖, 夏磊, 田英汉,等. 首发和复发青少年抑郁症患者血浆细胞因子水平与疾病严重程度的相关性分析[J]. 中华精神科杂志, 2023, 57(1): 18‑24.
16. HATCH J K, SCOLA G, OLOWOYEYE O, et al. Inflammatory markers and brain-derived neurotrophic factor as potential bridges linking bipolar disorder and cardiovascular risk among adolescents[J]. J Clin Psychiatry. 2017, 78: e286-e293.
17. CHEN M H, HSU J W, HUANG K L,et al. Inflammatory cytokines in and cognitive function of adolescents with first-episode schizophrenia, bipolar disorder, or major depressive disorder[J].CNS Spectrums, 2021, 28(1): 70-77.
18. BARBOSA I G, HUGUET R B, MENDONCA V A, et al.Increased plasma levels of soluble TNF receptor 1 in patients with bipolar disorder[J]. Eur Arch Psychiatry Clin Neurosci, 2011, 261(2): 139-143.
19. BRENNER D, BLASER H, MAK T W. Regulation of tumour necrosis factor signalling: Live or let die[J]. Nat Rev Immunol, 2015, 15(6): 362-374.
20. ZAZULA R, DODD S, DEAN O M, et al. Cognition-immune interactions between executive function and working memory,tumour necrosis factor-alpha (TNF-alpha) and soluble TNF receptors (sTNFR1 and sTNFR2) in bipolar disorder[J]. World J Biol Psychiatry, 2022, 23(1): 67-77.
21. TEIXEIRA A L, DE SOUSA R T, ZANETTI M V, et al. Increased plasma levels of soluble TNF receptors 1 and 2 in bipolar depression and impact of lithium treatment[J]. Hum Psychopharmacol, 2015, 30(1): 52-56.
22. SKIBINSKA M, RAJEWSKA‑RAGER A, DMITRZAK‑WEGLARZ M,et al. Interleukin‑8 and tumor necrosis factor‑alpha inyouth with mood disorders‑a longitudinal study[J]. Front Psychiatry,2022, 13: 964538.
23. 杨娟, 许华斌, 张光满, 等.抑郁症患者外周血T细胞亚群、Tregs及细胞因子水平变化及意义[J]. 国际免疫学杂志, 2024, 47(1): 46-51.
24. PAYNE J L, MAGUIRE J. Pathophysiological mechanisms implicated in postpartum depression[J]. Front Neuroendocrinol, 2019, 52: 165-180.
25. KIM Y K, MYINT A M, LEE B H, et al. T-helper types 1, 2, and 3 cytokine interactions in symptomatic manic patients[J]. Psychiatry Res, 2004, 129: 267-272.
26. YANG M S, JI K A, JEON S B, et al. Interleukin-13 enhances cyclooxygenase-2 expression in activated rat brain microglia: Implications for death of activated microglia[J]. J Immunol, 2006, 177(2): 1323-1329.
27. VAI B, MAZZA M G, CAZZETTA S, et al. Higher Interleukin 13 differentiates patients with a positive history of suicide attempts in major depressive disorder[J]. J Affect Disord Rep, 2021, 6: 100254.
28. 崔利军, 杨永涛, 崔伟, 等. 伴自杀自伤行为的青少年情感障碍患者炎性细胞因子水平对照研究[J]. 实用医学杂志, 2022, 38(12): 1522-1526, 1532.
29. BEGLYANKIN N I, BURYGINA L A, LEVIN M E, et al.Features of depressive episodewith onset in adoIescence and the risk of developing bipo1ar depression[J].Neurosci Behav Physiol, 2020, 50: 35-39.
30. ANMELLA G, GIL-BADENES J, PACCHIAROTTI I, et al.Do depressive and manic symptoms different ially impact on functioning in a cute depression? Results from a large, cross-pal study[J]. J Affect Disord, 2020, 261: 30-39.
31. 甄文凤, 马辛, 王红星. 老年单双相抑郁障碍探索性眼球运动和促肾上腺皮质激素及皮质醇水平比较[J]. 中国神经精神疾病杂志, 2019, 45(11): 647-651.
【引用格式】贾海玲 ,杨永涛 ,崔利军 ,等.青少年单、双相抑郁障碍患者周血炎症细胞因子水平差异[J]. 中国神经精神疾病杂志,2025,51(5):286-294.
【Cite this article】JIA H L,YANG Y T,CUI L J,et al.Differences in peripheral blood inflammatory cytokine levels between adolescent patients with unipolar and bipolar depression[J]. Chin J Nervous Mental Dis,2025,51(5):286-294.
DOI:10.3969/j.issn.1002-0152.2025.05.005
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)