首页 > 医疗资讯/ 正文
结直肠癌 (CRC) 是全球五大癌症之一。对于局部晚期 CRC,建议术前同步放化疗。放射治疗 (RT) 是一种传统的癌症治疗方法,它不仅可以控制局部肿瘤生长,还可能诱导免疫原性细胞死亡,从而引发全身免疫反应。鉴于 CRC 的放射敏感性较差,提高放射增敏率是一项亟待满足的关键需求。尽管术中成像技术取得了进展,但实时完整切除边缘清晰的结直肠肿瘤仍然是一项重大的临床挑战。
2025年7月21日,厦门大学附属翔安医院何伟,中国科学院福建物质结构研究所王培园、Luo Qiang共同通讯在Advanced Science 在线发表题为“Lutetium-Based Nanoprobes for Radiosensitization with Immune Microenvironment Remodeling and NIR-II Fluorescence Imaging-Guided Surgery in Colorectal Cancer”的研究论文。该研究介绍了一种新型的多功能荧光纳米探针RVLu@ICG,该探针在第二近红外(NIR-II)范围内发射。
研究表明,RVLu@ICG 通过环状精氨酸-甘氨酸-天冬氨酸 (c(RGDfK)) 五肽修饰,具有肿瘤特异性靶向性,并在电离辐射照射下诱导活性氧 (ROS) 生成增加。这种协同机制不仅增强了放射增敏效果,还促进了放射诱导的肿瘤免疫微环境重塑。此外,NIR-II 荧光图像引导技术有助于在微肿瘤模型、肌内肿瘤侵袭模型和腹膜转移模型中进行精准手术导航。值得注意的是,该纳米探针在体内外均表现出优异的生物相容性。因此,RVLu@ICG 为结直肠癌(CRC)的治疗建立了一个强大的精准治疗平台。

根据2022年全球癌症统计数据,结直肠癌 (CRC) 是全球最常见的恶性肿瘤之一,占癌症总诊断数的9.6%,占癌症相关死亡数的9.3%。新辅助放疗或放化 (RT/CRT) 是临床推荐的局部晚期CRC患者的新辅助治疗方案。该干预措施可缩小肿瘤体积,以便进行手术切除,尤其适用于局部晚期或解剖受限的病变。新兴证据表明,除了直接杀伤肿瘤细胞的作用外,RT还对肿瘤微环境 (TME) 发挥多效性免疫调节作用。值得注意的是,电离辐射可促进肿瘤相关抗原 (TAAs) 的呈递,并触发TME中损伤相关分子模式 (DAMP) 的释放。这一过程促进了树突状细胞 (DCs) 表达的模式识别受体的识别,从而启动信号级联,最终导致恶性细胞的免疫原性细胞死亡 (ICD)。
由于结直肠癌 (CRC) 的放射敏感性适中且肿瘤微环境缺氧,通常需要更高且可能有害的放射剂量才能达到足够的杀灭肿瘤效果。然而,强化治疗可能会对正常组织产生负面影响,例如破坏血管通透性、诱发纤维化和加剧缺氧。解决这些局限性的有效策略是增强放射治疗 (RT) 的疗效,同时通过在肿瘤微环境中 (TME) 内加入放射增敏剂来增强 RT 诱导的 ICD。金、硒和钆等高原子序数 (Z) 元素通过增强 X 射线的吸收和保留,展现出良好的放射增敏特性。这些金属在辐照后会释放二次电子,促进细胞内水分子的辐解,从而产生能够诱导DNA双链断裂(DSBs)的自由基,并降低脱靶毒性。稀土纳米粒子已被广泛证明是有效的放射增敏剂。与上述报道的元素相比,镥(Lu)的原子序数更高(Z = 71),对放射治疗(RT)的敏感性更高。这一基本特性赋予了镥基纳米增敏剂在精准放射治疗(RT)中卓越的转化潜力,尤其适用于需要优化放射剂量沉积的深部恶性肿瘤。
新兴证据表明,放射增敏的疗效源于其重塑肿瘤微环境(TME)、增强细胞对电离辐射的敏感性以及增强抗肿瘤免疫激活的能力。然而,这些策略仍然不足以完全根除肿瘤组织。因此,根治性手术切除仍然是局部晚期结直肠癌治疗的核心组成部分。手术切除所有可见肿瘤组织,保证阴性切缘(R0切除),可显著降低术后局部复发和远处转移的风险,提高患者的长期生存率。目前术中肿瘤切缘的确定主要依靠冰冻切片病理诊断,但该分析无法在术中实时识别切缘,且取材点有限,不能全面反映肿瘤切缘的整体情况。约5%的结直肠癌(CRC)病例为阳性切缘,且随着肿瘤进展,该比率显著升高,在局部晚期患者中可高达28%,从而增加了复发风险。此外,据估计,3%-20%的CRC患者会发生腹膜转移(PM),这使临床结果更加复杂。
令人鼓舞的是,基于荧光的成像技术提供了非侵入性且可重复的体内可视化,并能提供实时反馈,同时具有卓越的时间和空间分辨率。它有望实现区分恶性组织和良性组织的目标。过去几年中,FDA 批准的近红外区 (NIR,650-1700 nm)荧光团吲哚菁绿 (ICG) 因其优异的光学特性,已在近红外二区 (NIR-II,1000-1700 nm) 的图像引导手术中得到广泛研究。NIR-II 的组织吸收、自发荧光和光子散射更少,组织穿透更深,空间分辨率更高,肿瘤背景比 (TBR) 也更高。然而,ICG 有限的抗光漂白和肿瘤组织识别能力仍然存在担忧。幸运的是,作者之前的研究表明,将 ICG 负载到纳米载体的介孔中可显著增强其光稳定性能。因此,能够响应TME并装载ICG的介孔纳米载体的设计,为实现NIR-II荧光引导的外科手术干预提供了一种有前景的策略。
分子影像引导的癌症治疗作为一种提高治疗效果的有前景的策略,已获得广泛关注。这种方法能够实现肿瘤的精确定位,并促进治疗药物在体内的持续积累。为了追求更高效的影像引导模式,多功能治疗药物的开发已成为关注的焦点。各种无机纳米材料,例如氧化铁基纳米颗粒、金纳米结构、金纳米结构和钆-铋复合材料已被研究。尽管它们具有潜力,但由于对生物稳定性、生物相容性和合成复杂性的担忧,许多此类纳米平台的临床转化仍然有限。值得注意的是,作者之前的研究引入了一种基于钕(Nd)的可降解、模拟病毒的空心纳米颗粒,它在生理条件下可分解为约5纳米的Nd2O3纳米颗粒。值得注意的是,约40%的纳米探针在24小时内经肾脏清除,彰显了其良好的体内安全性。
此外,作者发现这种独特的病毒样介孔纳米粒子比普通介孔二氧化硅纳米粒子具有更高、更快的内化速率。因此,作者策略性地将ICG掺入具有中空病毒样形态的可生物降解Lu2O3纳米探针(VLu@ICG)中。特别地,鉴于αvβ3整合素在CRC中过表达,作者将肿瘤靶向肽——环状精氨酸-甘氨酸-天冬氨酸(c(RGDfK))基序(RVLu@ICG)——与制备的新型Lu基病毒样介孔RT敏化剂偶联,以寻求与αvβ3整合素受体的特异性结合,从而提高CRC的精准靶向能力。
最后,该研究成功开发了一种多功能纳米试剂RVLu@ICG,用于增强放疗、重塑免疫微环境和荧光成像。这种高效的放疗和免疫激活技术可在体内外彻底抑制结直肠癌(CRC)。此外,在NIR-II荧光引导下,残留肿瘤组织被成功切除,术后28天内局部复发或远处转移的迹象几乎为零。总而言之,这些发现凸显了NIR-II可生物降解的放射增敏剂在临床前应用中的良好前景,该技术可通过有效的放疗、重塑免疫微环境和增强肿瘤边缘的精准检测来改善治疗结果。
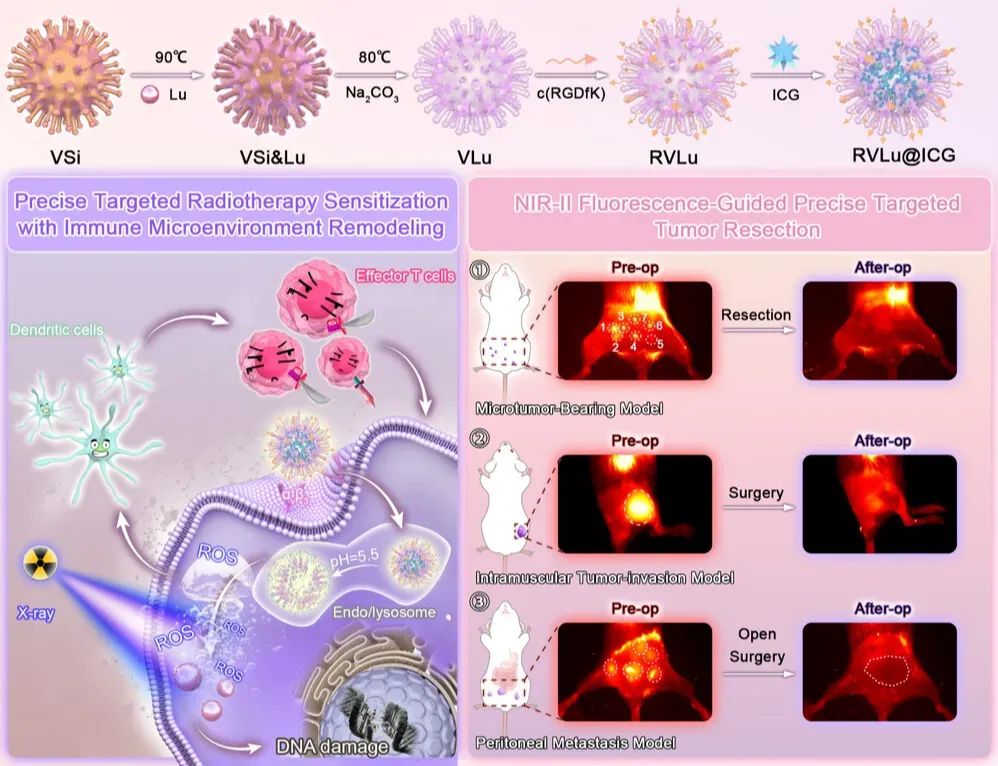
图1 RVLu@ICG纳米探针的合成及应用示意图(图源自Advanced Science)
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202510136
猜你喜欢
- 胶原蛋白是功效和作用,女性补充胶原蛋白的好方法
- 重大发现!湖北中医大学揭秘神奇草药如何修复酒精伤害的胃黏膜
- 【Leukemia】放疗可改善年轻高危侵袭性B细胞淋巴瘤患者预后
- 好文推荐 | 高原吉兰-巴雷综合征临床和电生理特点分析
- 长期不去角质会怎样 去角质多久一次好?
- 这几种蔬菜是抗癌“高手”,吃起来不亏
- 吃什么东西能防止血管堵塞
- 华科刘卫教授/南工大陈思渊教授团队《ACS AMI》:包载共输送纳米脂质体的微针递送系统用于雄激素性脱发治疗
- 蒸苦瓜的做法-苦香味蒸菜谱
- J Clin Oncol:PACIFIC-2 III 期试验结果公布,同步放化疗联合度伐利尤单抗,PFS/OS 未显著提升,早期致命毒性还更高
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)