首页 > 医疗资讯/ 正文
JHO:双重免疫检查点抑制在复发难治性鼻咽癌及实体瘤疗效探索——抗LAG-3抗体LBL-007联合抗PD-1抗体Toripalimab的临床进展
来源 2025-07-09 12:10:36 医疗资讯亮点总结
- 首次报道抗LAG-3抗体LBL-007与抗PD-1抗体Toripalimab联合治疗晚期鼻咽癌(NPC)及其他实体瘤的安全性及有效性,展示对免疫治疗初治NPC患者显著的抗肿瘤活性。
- LAG-3高表达患者客观缓解率(ORR)显著优于低表达群体,提示LAG-3表达有潜力成为疗效预测生物标志物。
- 双免疫检查点抑制方案耐受性良好,3/4级治疗相关不良事件发生率低,未见治疗相关死亡,免疫相关不良事件可控。
免疫检查点抑制剂(ICI)革命性改变多种恶性肿瘤治疗格局,尤其是PD-1/PD-L1单抗取得突破性疗效。然而,单一PD-(L)1通路抑制在晚期实体瘤中整体缓解率有限,多数患者存在耐药或反应不足,亟需新的联合免疫策略优化疗效。LAG-3作为T细胞耗竭表面抑制分子,与PD-1常在肿瘤浸润淋巴细胞中共表达,抑制T细胞有效免疫功能。已有研究显示LAG-3和PD-1双重阻断能协同激活耗竭CD8+T细胞,增强其增殖及细胞毒性,从而提升抗肿瘤响应。RELATIVITY-047试验在黑色素瘤中证实了此机制的临床价值,获得FDA批准,但外推至鼻咽癌等高LAG-3表达实体瘤的疗效与安全性尚待验证。
一项放标签、单臂、多中心Ib/II期临床试验(注册号NCT05102006),评估了新型全人源抗LAG-3单克隆抗体LBL-007联合抗PD-1抗体Toripalimab疗法在晚期既往治疗失败的鼻咽癌(NPC)患者及多种实体瘤患者中的安全性和抗肿瘤活性。研究于2021年11月至2023年12月间完成,纳入80例患者,涵盖鼻咽癌、小细胞肺癌、非小细胞肺癌、食管癌、头颈鳞癌及宫颈癌等多种实体瘤。试验结果发表于Journal of Hematology & Oncology杂志。

本研究招募具有组织学/细胞学确诊的晚期(转移性和/或不可切除)恶性肿瘤患者。纳入患者必须既往接受过标准治疗且病情进展,免疫治疗状态分为初治(IO-naive)或既往免疫治疗失败(IO-treated)。参与者ECOG评分为0-1,具备可测量病灶,器官功能良好。
Ib期采取LBL-007 200 mg或400 mg(每3周静脉注射)联合Toripalimab 240 mg,10例剂量递增评估安全性及确定推荐Ⅱ期剂量(RP2D);Ⅱ期中选定LBL-007 400 mg联合Toripalimab 240 mg治疗70例患者。疗程最长达2年,至疾病进展或不可耐受毒性终止。疗效主要评估客观缓解率(ORR),安全性包括不良事件(AE)、治疗相关不良事件(TRAEs)、免疫相关不良事件(irAEs),并探索LAG-3及PD-L1表达对疗效的预测价值。
研究结果
患者特征与随访
共80例患者入组,鼻咽癌30例(37.5%),其他实体瘤50例(62.5%),包括小细胞肺癌、非小细胞肺癌、食管鳞癌、头颈鳞癌及宫颈癌等。患者中58.8%接受既往免疫治疗,43.8%接受过≥2线化疗。截止随访(2024年7月),中位随访时间26.0个月,治疗中位持续时间5.0个月(0.3-24.7个月)。全部患者因疾病进展、同意撤回等原因停药,5例完成2年疗程。
安全性分析
Ib期未发现剂量限制性毒性(DLT),LBL-007 400 mg被确定为Ⅱ期推荐剂量。全部80名患者均纳入安全分析,76.3%发生治疗相关不良事件(TRAEs),11.3%为3/4级。常见3/4级TRAEs包括贫血(2.5%)、低钠血症(2.5%)、谷丙转氨酶升高(2.5%)、谷草转氨酶升高(1.3%)、及乏力(1.3%)。治疗相关严重不良事件发生率10%,7.5%因TRAEs停药,未见治疗相关死亡。免疫相关不良事件中以甲状腺功能减退(10%)、肝酶升高及乏力最常见。所有免疫相关不良事件均可通过糖皮质激素有效控制。
抗肿瘤活性
除5例无疗效评估资料患者外,75例患者可评估疗效,10例(13.3%)达部分缓解(PR),其中NPC患者6例占主导,其他肿瘤包括肺鳞癌、小细胞肺癌、头颈鳞癌、食管鳞癌各少数例。无完全缓解(CR)病例。病情控制率(DCR)达54.7%。
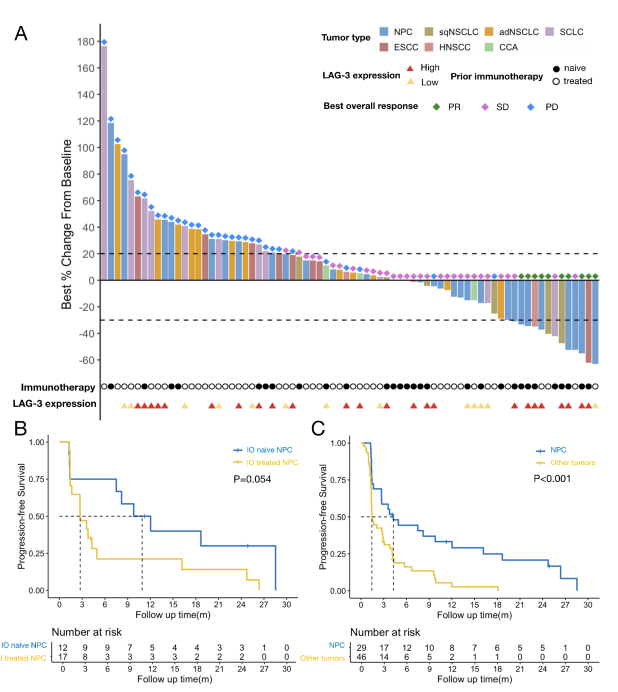
Kaplan-Meier 生存曲线:LBL-007 联合Toripalimab在晚期实体瘤患者中的疗效
值得注意的是,IO-naive NPC患者疗效明显优于既往IO治疗组。此外,83.3%的NPC缓解患者缓解持续超过12个月,显示联合免疫治疗持久抗癌能力。
LAG-3及PD-L1表达与疗效相关性
38名患者具有完整的基线肿瘤样本及免疫标志物数据。高LAG-3表达(2+及以上)者ORR达28.0%,低表达组仅7.7%。在NPC患者中,高表达组ORR为40%,低表达者为20%。PD-L1表达差异对ORR影响有限,表明LAG-3可能是更敏感的治疗反应预测因子。
表. LAG-3和PD-L1表达水平与治疗反应的关系

研究价值与意义
本研究统评估抗LAG-3抗体LBL-007联合抗PD-1抗体Toripalimab在晚期鼻咽癌及其他实体瘤患者中的临床应用,填补了抗LAG-3联合免疫治疗在NPC领域的空白。联合方案对于免疫治疗初治的NPC患者显示出明显优于既往单药PD-1抑制剂的客观缓解率及无进展生存期,缓解持续时间长,表明联合阻断LAG-3和PD-1可以有效逆转肿瘤免疫耐受、克服T细胞耗竭。
此外,数据提示高表达LAG-3肿瘤微环境的患者可能从该联合治疗中获益更多,这为后续患者筛选及个体化治疗提供了依据,推动精准免疫疗法的发展。安全性分析显示联合治疗总体耐受良好,不良事件发生率与此前报道相似,无新增安全隐患。
该研究结果不仅对NPC免疫治疗策略优化具有重要指导意义,也为探索其他高LAG-3表达肿瘤的免疫治疗新组合提供有力证据。结合未来大样本、多中心随机试验,有望进一步确立臨床价值及指导临床实践。
原始出处
Chen G, Sun DC, Ba Y, et al. Anti-LAG-3 antibody LBL-007 plus anti-PD-1 antibody toripalimab in advanced nasopharyngeal carcinoma and other solid tumors: an open-label, multicenter, phase Ib/II trial. Journal of Hematology & Oncology. 2025;18(15). https://doi.org/10.1186/s13045-025-01666-6
猜你喜欢
- 张泓:“1+N”模式体现了保险助力精准脱贫的优势
- 中国公共卫生信息化现状与趋势分析,《全国公共卫生信息化建设标准与规范(试行)》解读
- 智能手机成为孩子近视的主因
- J Cosmet Dermatol:785 nm皮秒激光衍射光学元件模式下局部应用吲哚菁绿实现亚洲女性的皮肤年轻化
- Nat Nanotechnol:武汉大学张先正团队利用口服基因编辑纳米颗粒实现结直肠癌的化学免疫治疗!
- 天然治疗男人早泄的好方法
- 调理内分泌的保健品常见的有哪些
- 血压忽高忽低不能全怪药物
- 当身体的“顶梁柱”发出求救信号:解读脊柱问题与日常养护
- Cell Med:我国学者揭示常染色体隐性遗传性耳聋9型患者基因治疗后的听力学特征
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)