首页 > 医疗资讯/ 正文
溴结构域和末端外结构域(Bromodomain-and-extraterminal-domain,BET)蛋白是三阴性乳腺癌(triple-negative breast cancer,TNBC)等难治性实体肿瘤的重要治疗靶点。然而,BET抑制剂(BET inhibitor,BETi)获得性耐药仍是当前临床面临的重大挑战,因此阐明其耐药机制至关重要。
2025年7月1日,四川大学彭勇独立通讯在PNAS在线发表题为“A circular RNA overcomes acquired resistance to BET inhibitors by antagonizing IGF2BP2-mediated c-MYC translation in TNBC”的研究论文。该研究发现,RNA结合蛋白IGF2BP2通过增强c-MYC mRNA的翻译,成为TNBC获得性BETi耐药的关键驱动因子。
鉴于IGF2BP2并非小分子药物的理想靶点,作者通过RNA免疫沉淀测序(RNA immunoprecipitation sequencing,RIP-Seq)鉴定出环状RNA-BISC(circRNA-BISC)可作为IGF2BP2的高效抑制剂,该分子能同时阻断c-MYC翻译和BETi耐药。值得注意的是,BISC含有特异性结合IGF2BP2(而非IGF2BP1或IGF2BP3)的"CAC-linker-XGGX"特征基序。基于BISC对IGF2BP2的选择性抑制作用,作者进一步开发了针对TNBC的RNA治疗策略。体外转录环化制备的BISC与BETi OTX-015联用时,在BETi耐药TNBC模型中展现出显著的肿瘤消退效果且未观察到毒性反应。本研究不仅证实BISC是IGF2BP2的高效抑制剂,更为克服TNBC中BETi耐药的环状RNA治疗策略提供了理论依据。
溴结构域和末端外结构域(Bromodomain and extraterminal,BET)蛋白家族成员(包括BRD2、BRD3、BRD4和BRDT)作为乙酰化组蛋白的关键识别因子,可全局激活癌基因表达。这些蛋白已成为癌症治疗中极具吸引力的表观遗传学靶点,过去二十年已有超过50项针对淋巴瘤和实体瘤的临床试验。然而,BET抑制剂(BETi)的临床研发受到固有耐药性和获得性耐药性的严重阻碍。例如,前列腺癌和非小细胞肺癌(NSCLC)通常对BET抑制表现出固有耐药性,在治疗初期即显示有限疗效;而三阴性乳腺癌(TNBC)和急性髓系白血病(AML)虽初期对BETi有响应,但六个月内会迅速产生获得性耐药。值得注意的是,约半数评估BETi单药治疗实体瘤的临床试验因获得性耐药而终止。因此,开发合理可行的耐药克服策略对提升BETi临床疗效至关重要。
目前关于BETi耐药机制的研究已取得重要进展。在前列腺癌中,SPOP基因的体细胞突变通过损害泛素降解系统导致BRD4上调,从而产生固有耐药性。作者前期研究进一步揭示了NSCLC中非突变驱动的固有耐药机制:BETi对BRD3的非选择性抑制会意外激活癌基因BCL6,进而增强mTOR通路介导的细胞增殖。虽然不同癌种的固有耐药机制各异,但获得性耐药主要归因于c-MYC的重新激活。作为BRD4的关键靶基因,c-MYC水平的反弹通过帮助肿瘤细胞逃避药物诱导的细胞凋亡和细胞周期阻滞,显著削弱BETi疗效。鉴于c-MYC再激活在获得性耐药中的核心作用,亟需开发能选择性抵消这种适应性效应的策略。
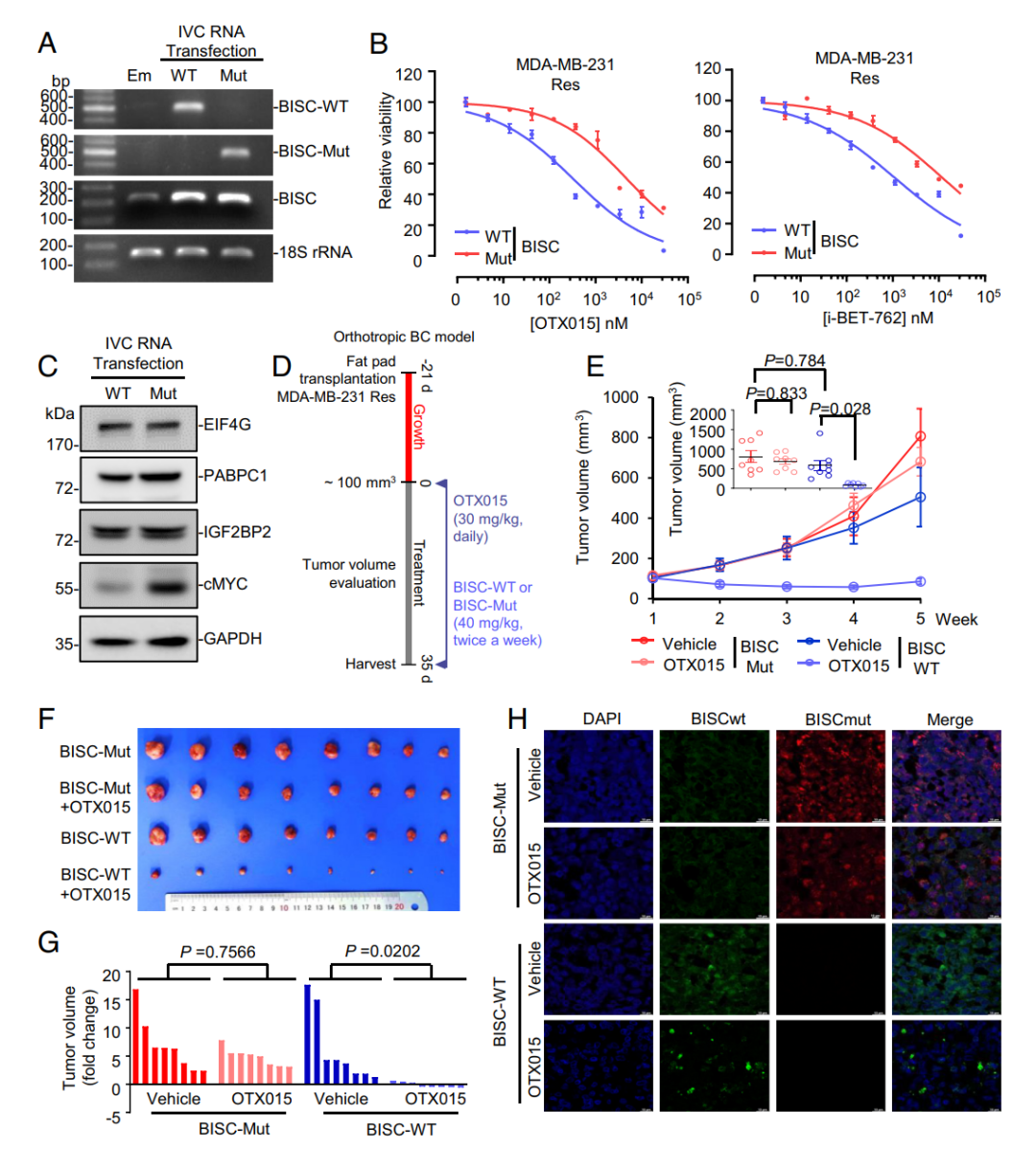
BISC治疗在TNBC中克服了BETI耐药(图片源自PNAS)
既往研究已深入探讨BET抑制条件下c-myc转录再激活的机制,但转录后调控同样作为维持c-MYC蛋白高水平的重要补偿机制。RNA结合蛋白(RBP)IGF2BP2在调控多种mRNA靶标(包括c-MYC、KRAS和HOXB4等关键转录调控因子)的定位、稳定性和翻译过程中起核心作用。研究表明IGF2BP2可促进肌肉分化期间的c-MYC翻译。此外,IGF2BP家族近期被鉴定为m6A阅读器,能增强数千种mRNA的稳定性与储存。除结合mRNA靶标外,IGF2BP2及其家族成员还可与环状RNA(circRNA)相互作用——这些circRNA并非作为RNA底物,而是通过影响蛋白质降解过程或促进IGF2BP对mRNA靶标的识别发挥调控作用。虽然IGF2BP2在肿瘤发生发展中的作用已较明确,但其在化疗耐药中的参与机制直至近年才被认知,而在BETi耐药中的具体贡献仍不清楚。
基于IGF2BP2在肿瘤发生和耐药性中的明确作用,开发靶向IGF2BP2的小分子抑制剂成为癌症治疗的重要方向。然而,RBP固有的结构特征(如缺乏小分子化合物结合所需的疏水口袋)为开发高效IGF2BP2抑制剂带来显著挑战。尽管如此,RNA疗法为选择性靶向功能性RBP提供了新思路。其中,circRNA因其对核酸外切酶降解的天然抗性及相较于线性RNA更低的免疫原性而具有独特优势,这些特性使其成为RNA治疗领域的理想候选分子。
本研究首次证实IGF2BP2介导的c-MYC翻译是驱动TNBC获得性BETi耐药的关键机制,并发现通过恢复IGF2BP2相互作用circRNA(hsa_circ_0001573,命名为BISC)可逆转该耐药性。机制上,BISC通过拮抗c-myc mRNA与IGF2BP2的结合来抑制c-MYC翻译。值得注意的是,作者成功建立体外转录环化法制备大规模BISC的方案,并在BETi耐药TNBC模型中验证了BISC联合BETi的治疗效果。本研究不仅阐明IGF2BP2抑制性circRNA-BISC在TNBC中的关键抗肿瘤作用,更为circRNA联合疗法克服BETi获得性耐药提供了理论依据。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2504320122
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)