首页 > 医疗资讯/ 正文
心脏肥大导致心室功能障碍和心力衰竭。去泛素化酶负责保持底物蛋白的稳定性,对心肌肥大至关重要。
2025年7月1日,温州医科大学药学院王怡、梁广共同通讯在Nature Communications上在线发表题为“Cardiomyocyte-derived USP13 protects hearts from hypertrophy via deubiquitinating and stabilizing STAT1 in male mice”的研究论文。研究旨在探讨心肌细胞来源的去泛素化酶USP13在心脏肥大中的作用和调节机制。在这里,研究表明USP13在肥厚性心肌中增加,并且主要分布在心肌细胞中。
心肌细胞特异性Usp13敲除加重了雄性小鼠TAC或AngII诱导的心肌肥大和功能障碍。相应地,AAV9在心脏中过表达USP13对雄性小鼠的心脏肥大产生治疗作用。机制上,研究通过相互作用组分析将STAT1鉴定为USP13的底物。USP13去泛素化STAT1,从而减少其降解。随后,USP13促进了STAT1靶向Nppb基因的转录并增强了心肌细胞中的线粒体功能。本研究阐明了USP13对肥厚型心肌细胞的有益作用,并确定了心肌细胞特异性USP13-STAT1轴在调节心脏肥大方面的作用。

病理性心脏肥大导致心室扩张伴收缩功能障碍,并经常导致充血性心力衰竭。心肌肥大通常伴有心肌细胞大小增加、胎儿基因表达和间质纤维化。尽管临床治疗可用于抑制心脏肥大,但到目前为止,它们的治疗效果似乎有限。考虑心肌细胞终末分化和再生不良的特点,维持细胞内关键蛋白的稳态可能是决定心脏肥大命运的重要因素。最近,人们越来越关注心肌细胞病理生理学中涉及的关键蛋白质的翻译后修饰(PTM)的潜力。
泛素化是调节26S蛋白酶体降解蛋白质和其他非降解功能的动态PTM,由一系列泛素化酶依次催化,并由去泛素化酶(DUBs)反向调节。DUBs主要负责从底物上切割泛素分子并维持底物的稳定性。研究团队专注于DUBs在心脏肥大发病机制中的调控机制,并确定了两种DUBs通过维持关键Ca2+-处理蛋白SERCA2a的稳定性来保护心肌细胞。因此,DUBs有望成为确定治疗心脏肥大和心力衰竭靶点的重要分子库。
在目前的研究中,通过大量转录组、单细胞mRNA测序(scRNA-seq)分析和系列实验验证,研究确定心肌细胞来源的DUB,泛素特异性肽酶13(USP13),可能是心脏肥大的关键因素。USP13作为USP家族的一员,包含一个锌指结构域和一个USP催化结构域。USP13的USP结构域结合泛素分子并催化K27、K48和K63连接的泛素链从底物蛋白中水解。在生理功能方面,USP13主要与自噬、细胞周期调控和DNA损伤修复有关。在病理学上,USP13通过去泛素化特定底物参与癌症和神经退行性疾病的发病机制。然而,目前尚不清楚USP13是否与心脏病理生理学相关。
本研究使用心肌细胞特异性USP13敲除小鼠和重组腺相关病毒血清型9(AAV9)介导的USP13过表达,进一步探讨了心肌细胞来源的USP13对心脏肥大的影响。机制上,研究通过心肌细胞中的相互作用组确定信号转导和转录激活因子1(STAT1)是USP13的关键底物。USP13促进STAT1的转录功能,并通过去泛素化和稳定心肌细胞中的STAT1来保护线粒体功能。研究阐明了USP13对肥厚型心肌病的有益作用,并确定了心肌细胞特异性USP13-STAT1轴在调节心脏肥大方面的作用。
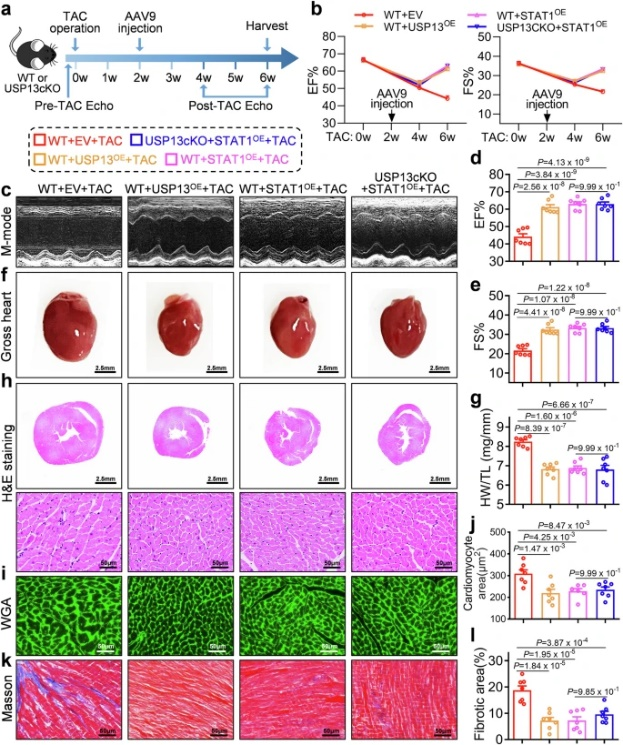
图1心肌细胞特异性的USP13过表达可改善已建立的心功能障碍,而无论USP13存在与否,STAT1均可抑制心肌功能障碍(摘自Nature Communications)
参考消息:
https://doi.org/10.1038/s41467-025-61028-1
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)