首页 > 医疗资讯/ 正文
癌症长期被视为遗传疾病,由累积突变引起。研究表明,衰老组织常具有复杂致癌背景的克隆体,与正常组织和谐共存。携带高突变负荷的癌细胞在健康胚胎内,能使无肿瘤小鼠正常生长。相反,近期证据显示,成年组织细胞仅表达一个或少数致癌基因,在某些情况下可生成具恶性侵袭性癌症特征的肿瘤。这些观察结果较难调和,除非引入环境信号触发可抑制或推动恶性转化的表观遗传变化。2024年4月《Nature Reviews Cancer》杂志上发表了一篇名为《Beyond genetics: driving cancer with the tumour microenvironment behind the wheel》的综述。作者着重阐述某些致癌基因如何引发干细胞与其环境的双向沟通障碍,这种障碍非遗传地重新布局下游事件,倾向于组织形态发生过程。此外,作者回顾了肿瘤微环境中起作用的细胞、分子及物理力,它们能深刻影响转化细胞行为。最后,文章还讨论了突变负荷与肿瘤微环境相对重要性及其临床意义。

介绍
一个多世纪来,癌症被视为遗传疾病,多数人类癌症含2 - 8个驱动突变,不少研究聚焦突变顺序,如结直肠癌进展与APC等突变依次增加有关。这些研究催生一种观点:体细胞突变时间累积达致癌症负荷阈值,是肿瘤发生及进展至转移的基础。但小鼠研究表明,携带一两个致癌突变细胞也能变成恶性肿瘤(表1);在人类中,儿童癌症突变少于成人却一样具侵袭性,说明少量突变结合表观遗传变化可触发肿瘤发展,且转移至次级部位不总与更高突变负担相关,未转化上皮细胞也能扩散存活。某些癌症的器官趋向性表明,环境决定转移灶形成,非遗传途径控制转移特征获得。很早前就有迹象显示癌症不只是遗传问题。20世纪70年代研究证明,恶性畸胎癌细胞可在嵌合小鼠促进健康组织形态发生;感染Rous肉瘤病毒的鸡或转基因表达TGFα的小鼠皮肤在受伤前没有明显表型,受伤后伤口处会形成肿瘤,TGFα和TGFβ可在无基因改变时发挥旁分泌转化功能。相反,老化人类皮肤中紫外线累积产生致癌突变但癌变的表皮细胞不一定克隆。这些研究表明,受非致癌突变影响细胞是否引发肿瘤取决于情境,涉及组织微环境等因素。过去十年,研究人员聚焦肿瘤微环境(TME)及转化细胞在癌症进展中的时空变化,揭示多种癌症驱动因素,包括基因和非基因改变。多数癌症微环境复杂,含多种细胞和细胞网络。癌症干细胞(CSCs)像信号交换中枢,整合和输出信号,塑造癌症预后。鉴于复杂性,TME能适应癌症行为多样性,如侵袭有时由促肿瘤免疫细胞的TGFβ驱动,而肺腺癌肿瘤-免疫特征相对稳定,说明免疫系统是否抑制或促进侵袭取决于具体环境。除局部环境,饮食也影响肿瘤形成进展,如肥胖者患癌风险高但治疗反应和预后好。血管和神经支配提供长距离信号传导途径。研究肿瘤起始和转移发现众多非遗传因素是恶性肿瘤关键驱动因素。本文回顾单个致癌突变细胞通过与环境作用驱动表观遗传重编程获多种恶性特征的研究进展,探讨非遗传因素推动肿瘤进展的方式,阐明癌症突变负担有时低的原因,最后探讨微环境和表观遗传驱动因素作为癌症治疗靶点的潜在价值。
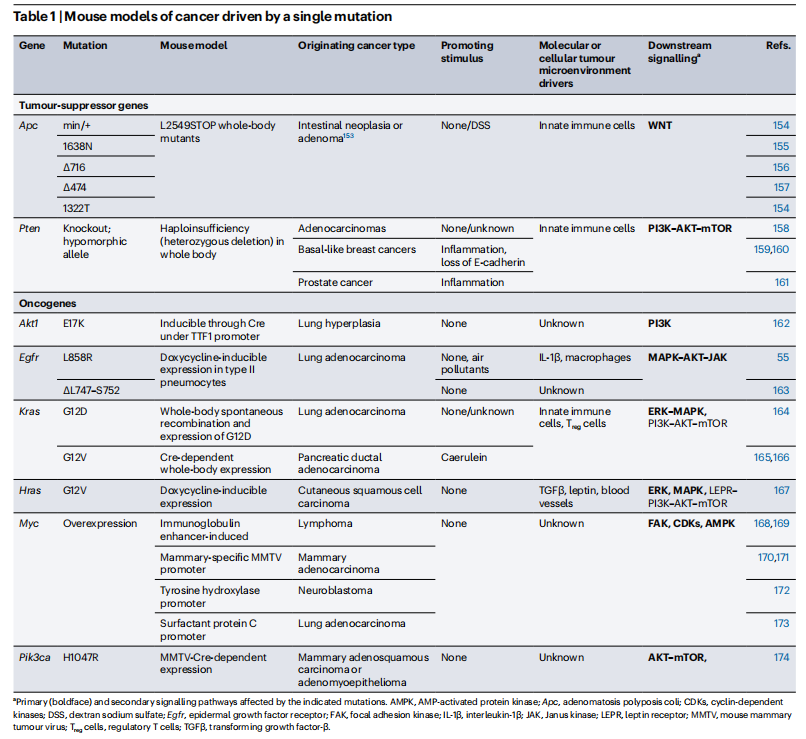
表1.由单一突变驱动的癌症小鼠模型
恶性肿瘤的细胞外驱动因素
TME包括免疫细胞、癌症相关成纤维细胞(CAF)、血液和淋巴管、神经及细胞外成分,如细胞外基质(ECM)、基底膜、生长因子和代谢物,这些都影响肿瘤发生与进展。携带单一致癌突变的上皮细胞,为解析突变负荷的多元影响提供了可能,还揭示影响早期肿瘤起始CSCs的环境因素及其在肿瘤发生和进展中的作用。
转化细胞与其健康邻里的竞争
细胞在哺乳动物上皮内的竞争是自然生理过程,发生于组织形态发生期。该过程最初在果蝇翅膀发育中被描述,由适应性强的细胞识别并杀死较弱的邻居,再将其从组织排出。此现象常被误解为仅增殖优势,但哺乳动物组织也有类似经典细胞竞争现象。研究人员通过活体成像技术,观察到毛囊、胰管及腺泡区域健康细胞对外来转化细胞的竞争。虽缺乏机制见解,但这些研究强调转化细胞需胜过健康邻近细胞以避免死亡和挤出,从而形成肿瘤。最近,研究人员在乳腺类器官研究细胞竞争在人类癌症中的作用,发现转化细胞需被转化邻近细胞包围才能高效增殖,且要产生足够旁分泌信号阻止健康邻居竞争。例如,肠隐窝中携带KRAS或PI3K突变的转化肠细胞分泌骨形态发生蛋白配体抑制正常干细胞活性,获得竞争优势。这些研究表明,肿瘤发生早期,无遗传突变积累时,转化上皮细胞也须改变周围上皮细胞才能发展为恶性肿瘤。此外,特定突变如TP53和NOTCH1在皮肤和食道可长时间积累表型变化而不恶变或被清除,说明除致癌突变外,还需微环境重塑促进肿瘤发生。总体而言,克隆竞争可能促进并加剧肿瘤内异质性,推动肿瘤进化。
炎症作为肿瘤发生的加速器
炎症是组织癌症发生和进展的关键驱动因素。炎症与癌症的联系,最早源于经典皮肤化学致癌研究。实验中,用诱变剂DMBA处理小鼠致Hras突变和乳头状瘤,再用炎症刺激物TPA加速向恶性SCC进展。同样,胰腺炎诱导剂蓝斑素使携带致癌KrasG12D突变小鼠易患导管腺癌。炎症在促进癌症中的作用,取决于组织干细胞活性。表皮更新恒定,致癌RAS可单独驱动恶性皮肤SCC;胰腺更新不频繁,需炎症预处理使RAS细胞进入胰管腺癌状态。近期研究证实二者联系深远。如Apcmin小鼠肠道受DSS处理,肠道肿瘤发生加速;携带Egfr或Kras突变小鼠在空气污染加剧时,肺腺癌形成加速。这些例子表明,炎症刺激可替代恶性肿瘤进展所需的额外自发遗传事件。表达KRASG12D的胰腺导管腺癌细胞分泌IL - 33,与皮肤癌中该细胞因子作用于巨噬细胞不同,胰腺肿瘤中IL - 33影响Treg,信号结果是癌症进展。炎症与癌症关系还有一有趣发现,炎症刺激后,干细胞获得表观遗传的炎症记忆,能加速伤口反应,使造血祖细胞偏向髓系谱系,这部分解释二者联系。此外,致癌HRASG12V表达可触发失调信号致肿瘤,小鼠皮肤中,CSCs分泌IL - 33引发系列反应走向癌症。通过这种方式,癌症干细胞(CSCs)无需依赖高突变负荷或炎症即可构建其促肿瘤微环境,从而真正成为肿瘤发生生态的"建筑师"——尽管这些因素无疑会加速其恶性进程(图1)。
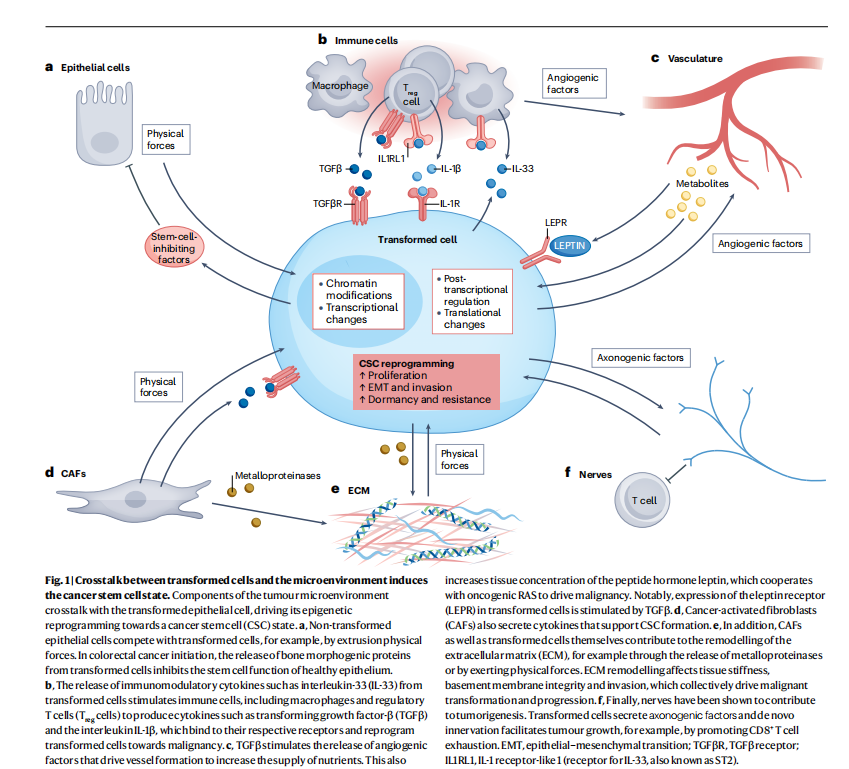
图1:转化细胞与微环境之间的相互作用诱导癌症干细胞状态的形成
间质成纤维细胞作为肿瘤发生的驱动因素
CAFs是具有肿瘤内异质表型的TME细胞,包括多种亚型和亚专业,它们在细胞外基质沉积和重塑中起着关键作用,同时与癌细胞和浸润的白细胞广泛交流。最早的一个例子是摩西的研究,他观察到当使用由间质成纤维细胞表达的Cre驱动条件性敲除必需的TGFβ共受体基因Tgfbr2时,小鼠自发地发展出上皮前胃肿瘤。此后不久,研究显示CAF,而非正常成纤维细胞,足以驱动前列腺中转化上皮细胞的肿瘤发生,从而减少了癌症中高突变负荷的需要。CAFs对上皮肿瘤发生具有强大的影响,这一点在基因正常的成纤维细胞中也得到了证实。CAF对TGFβ和Yes相关蛋白(YAP)信号强烈响应,这会诱导细胞类型特异性地改变ECM的产生和免疫抑制能力。在Apcmin小鼠中,成纤维细胞通过激活髓系分化原反应基因88蛋白-Toll样受体-4(MYD88-TLR4)介导的炎症通路,促进肠道肿瘤的发生,这一过程曾被认为仅限于固有免疫细胞。微生物群在这些早期Apcmin病变中浸润,可能参与触发CAFs中的固有免疫反应,但这一点还需未来研究证实。最后,CAF能够围绕某些肿瘤,例如胰腺癌,编织一个密集的矩阵网,从而改变TME的代谢和缺氧环境,进而改变CSCs的微环境。
机械力作为TME的一部分
尽管间质与转化上皮细胞间部分相互作用受分泌的细胞因子和生长因子影响,其他相互作用可能由细胞-细胞和细胞-细胞外基质的急性变化或致癌突变引发。CAF分泌I型胶原蛋白,负责间质细胞外基质形成。肿瘤细胞侵袭力取决于周围环境硬度。年轻健康组织中,基质细胞外基质较硬阻碍肿瘤发生,常需降解酶促进侵袭;组织老化,基质细胞外基质变脆弱,可能加剧年龄相关肿瘤发生率。基底膜硬度也影响肿瘤进展,如基底细胞癌中,基底膜蛋白快速分泌形成柔软有弹性基底膜,容纳病变保持肿瘤良性,其对Hedgehog抑制剂的抵抗性由肿瘤结构决定,与基底膜接触细胞构成抗性群体;而携带HRASG12V突变的皮肤上皮形成的皮肤鳞状细胞癌,基底膜薄且僵硬,易在硬角质珍珠机械力下破裂。这些表明特定致癌基因早期生物学基础变化对肿瘤进展有深远非遗传效应。研究还发现局部机械力作为肿瘤进展非遗传因素的重要性,如不同模式和水凝胶硬度培养癌细胞系,几何线索可增强克隆性类肿瘤CSCs特征,该原理在胰腺导管腺癌模型中得到体内验证,胰腺肿瘤起源导管直径决定病变生长方向,外生性病变与肿瘤微环境互动,招募促肿瘤CAF。人肝癌细胞系研究显示,ECM硬化诱导分泌外泌体,导致NOTCH激活和生长增强;细胞外体外液体粘度可将乳腺癌细胞重编程为利于转移表型。模拟肿瘤生长机械压力的研究发现,β-连环蛋白在Tyr654位点磷酸化,使E -钙黏蛋白不稳定,释放β-连环蛋白激活WNT信号通路,机械力转录调节因子YAP被α-连环蛋白隔离在细胞质中。这些例子阐明CDH1基因失活突变与人类癌症相关,揭示改变粘附连接等的非遗传方式的机制。总之,肿瘤细胞、其TME和内部机械力中,环境很重要,外部和癌症本身的机械力对塑造癌症特性都重要,有时后者更重要。
血管生成、淋巴管生成和神经发生
其他已知的TME对癌症的影响包括血管生成和淋巴管生成,由CSCs信号触发,如在小鼠皮肤肿瘤模型中,敲除编码VEGFA的基因,VEGFA是肿瘤血管生成诱导剂,可由早期肿瘤微环境多种因素诱导,包括整合应激反应、缺氧和TGFβ信号传导。血管系统能输送营养、激素和免疫细胞到肿瘤,是CSCs生存关键,还能产生肿瘤异质性,促进治疗抵抗。在皮肤鳞状细胞癌中,TGFβ信号使CSCs上调VEGFA等促血管生成因子表达时,血管系统上升。TGFβ靶基因包括编码上皮-间质转化蛋白及瘦素受体(LEPR)的基因。对鳞状细胞癌这类不接触脂肪组织的肿瘤,血管系统更重要,因循环需提供瘦素触发LEPR信号传导,激活途径提升PI3K - AKT - mTOR通路,维持能量平衡,且LEPR信号传导促进胆固醇生物合成,可增强RAS活性。虽转移常始于癌细胞迁移到淋巴结,但人们对淋巴毛细血管在肿瘤发生中的作用了解甚少。近期研究表明,黑色素瘤细胞可能利用淋巴管减少铁死亡,淋巴管对调节正常组织干细胞行为至关重要,鉴于其对癌症特性影响大且肿瘤生长可能影响淋巴管,因此研究其在CSCs中的作用。近期研究探索神经在癌症进展中的作用,其作用具环境依赖性。在单癌基因Apcmin结直肠癌模型中,迷走神经切断减少肿瘤数量,表明内脏感觉神经元可能驱动肿瘤发生和进展,且神经元可在免疫系统中发起抗肿瘤反应,如黑色素瘤中痛觉传导诱导CD8 + T细胞分泌CGRP致其耗竭。这些发现展示了环境输入在协调肿瘤促进反应中的作用,鉴于相关途径在转移性癌症中常突变,可推测癌症中突变负担增加反映了TME与CSCs之间通信已建立的致癌途径的锁定。
细胞内在的非遗传驱动因素
TME与肿瘤细胞相互作用塑造癌症表观基因组,包括DNA、组蛋白及其他染色质相关蛋白的翻译后修饰。这些改变留持久标记,影响CSCs转录和翻译。虽表观遗传修饰与基因突变常引发相似细胞行为,但因其可逆,对未来开发抗癌疗法意义重大。
TME诱导的转录因子失调
TME触发的促肿瘤信号传导常致转化细胞中转录因子失调。酪氨酸激酶受体如EGFR激活MAPK通路,进而激活RAS和/或RAF,改变JUN、FOS等转录因子表达,β-连环蛋白是WNT信号通路中LEF1(也叫TCF1)的共调节因子。虽然该通路基因在癌症中常突变,但TME可使其过度活化。比如,致癌的RAS驱动胰腺癌中,SOAT1增强RAS膜定位与功能致过度活化;Soat1也是皮肤鳞状细胞癌中因富含血管的TME9产生高TGFβ信号而激活的转录变化之一(图2)。
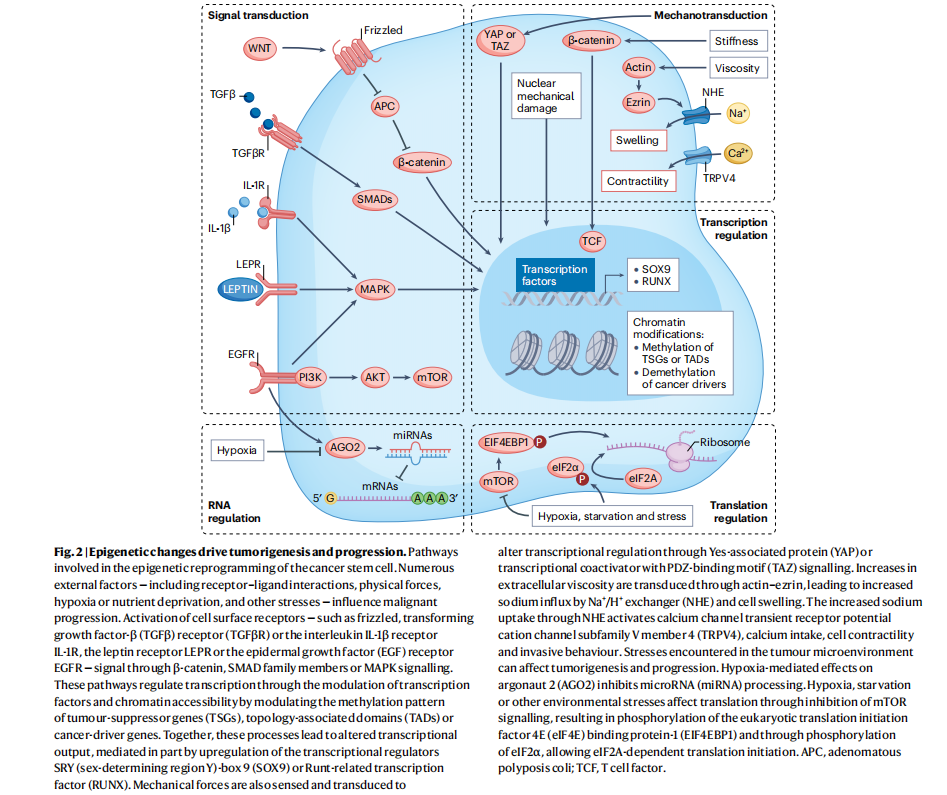
图2.表观遗传学改变驱动肿瘤发生与进展
染色质动力学的影响
随着肿瘤发生,外部因素与下游转导信号通路相互作用改变CSCs染色质组织。近期高通量技术进步,能绘制相关染色质图谱,揭示非遗传性变化影响染色质促进肿瘤发生发展,如小鼠肺腺癌研究。致癌过程中,染色质失调致癌症转化等可塑状态,结直肠癌证实这点,先驱因子持续激活也有此效应,如SOX9引导表皮干细胞类似基底细胞癌。新生肿瘤与微环境动态作用产生选择压力,触发转录因子,如RUNX引发表观基因组变化与肿瘤进展转移有关。TME代谢状态影响癌症表观基因组学,许多去甲基化酶活性依赖辅助因子α-酮戊二酸,受其与琥珀酸比例影响,比例低时H3K27me3积累,EZH2过度活跃常见于癌症,它在干细胞包括CSCs中含量高,可抑制分化促进增殖,TME可使EZH2升高致乳腺肿瘤转移,虽多数潜在途径待研究,但这些表明TME驱动染色质重塑在肿瘤启动重要,拓宽对致癌突变触发分子连锁反应理解。此外,癌症中三级染色质拓扑结构变化有作用,DNA甲基化增加掩盖CTCF结合位点,重塑三维拓扑结构,使增强子与致瘤基因启动子接触,TME介导的染色质拓扑结构变化对癌症影响尚未探索,若识别可能提供新治疗调控模式。
癌症进展的转录后控制
在染色质结构和转录下游,调节转录本稳定性机制(如miRNAs)及翻译被视为表观遗传调节因子。癌症中,TME外部线索可诱导途径劫持这些机制,促进转化、肿瘤发生与进展。许多miRNAs与癌症相关,其失调可由突变调节。例如,miRNA能抑制编码特定载脂蛋白E变异的mRNA,该变异自然存在,缺失时增加转移性黑色素瘤易感性。癌细胞环境在调控这些转录后调节因子表达中起关键作用,如缺氧和EGFR信号通路调节AGO2蛋白磷酸化,影响miRNA成熟。在krasg12d驱动的胰腺癌模型中,Ago2缺失不阻止良性病变形成,但病变不会进展为全胰导管腺癌,除非p53丢失,突显miRNA机制作为肿瘤驱动替代经典致癌突变的重要性。
癌细胞需制定策略在压力条件下生存并抑制抗肿瘤免疫反应。敌对肿瘤微环境引发内质网应激,癌细胞通过激活内质网应激传感器和适应性应激反应抵御攻击,增强转移和耐药能力,核心是翻译机制。癌细胞抑制整体翻译,允许关键应激响应mRNA翻译以应对环境压力。RAS - MAPK和PI3K - mTOR信号级联对eIF4B磷酸化限制帽依赖性翻译,eIF2α磷酸化由应激激酶介导,与癌症进展相关,其磷酸化后翻译机制导向非传统起始位点,致癌转录本可在整体翻译抑制时被翻译。这些例子说明癌细胞无需累积突变负担,劫持转录后机制驱动肿瘤发生和进展。
TME驱动肿瘤的临床考虑
CSCs与TME间通讯回路的混淆效应在癌症治疗中作用重要,从免疫疗法发展可见。TME信号可增强CSCs免疫治疗能力,但免疫治疗又能促进肿瘤干细胞特性、激活CSCs促转移转录本。数据强调阐明治疗药物对CSCs及肿瘤微环境影响的重要性。因肿瘤微环境异质性和动态适应,针对它具挑战性。健康饮食、规律运动和低压力可改善治疗反应。如抗PI3K癌症药物在特定饮食患者中有效。许多人类癌症LEPR水平升高,瘦素激活可触发PI3K通路,肥胖使血浆和TME中瘦素水平上升,还会致多种组织变化促进癌症发展。饮食影响免疫系统,西方饮食引发小鼠骨髓炎症,影响造血祖细胞命运。西方饮食及其引发炎症能力影响广泛有害,因炎症与癌症关联及组织干细胞有炎症表观遗传记忆,且孕期炎症可传给后代。干细胞有迁移、可塑性等表观遗传记忆,影响对癌症易感性。表观遗传记忆持久原因待解,研究重点在组蛋白修饰,DNA甲基化影响或更持久,且受多种因素影响,还可调节关键肿瘤抑制基因,如散发性乳腺肿瘤中DNA甲基化与肿瘤抑制结合,SRC通路调节雌激素受体阳性乳腺癌中p53活性。对影响癌症表观遗传学宿主因素的了解很重要,饮食、压力等影响肿瘤进展和治疗反应,如情绪困扰影响黑色素瘤免疫治疗,昼夜节律影响乳腺癌转移,绝经后激素替代疗法增加癌症风险。虽全面针对宿主因子不可行,但新发现带来癌症管理新希望。
结论和展望
这篇综述重点关注肿瘤生物学的非遗传驱动因素。许多驱动因素早被发现,但在基因组革命和癌症遗传学兴起初期被忽视。当突变负担无法解释癌症诸多特征时,癌症遗传学家才转向非遗传变异寻找解释。复杂分子工具、高通量技术及特定动物模型,提升了我们对TME及其对癌症进展重要性的认知。近十年数据表明,对多数癌症,干细胞初始致癌突变后,非遗传驱动因素可能促进肿瘤起始与进展。小鼠肿瘤及人类癌症研究显示,仅将癌症视为遗传疾病并不充分。组织干细胞获致癌基因后,与微环境沟通障碍,激活新信号级联,伴染色质和转录后变化,这些通信回路分子细节待解,加剧因素对癌症的贡献或部分归因于组织遗传特性。对不同组织,炎症重要性有别。虽诸多问题未解决,但新证据为癌症治疗带来希望。非遗传因素在肿瘤发展中的作用对新型疗法开发至关重要,因多数癌症患者死于复发和转移。干细胞积累表观遗传记忆并增强反应,影响非遗传因素对可塑性和癌症的作用。该领域开始改变对突变负担看法,未来可能锁定表观遗传途径。过去研究集中于癌症基因组测序,未来十年或更关注通过空间高通量配体-受体分析理解细胞通讯网络。先进计算工具及人类类器官培养、小鼠遗传学进展,为探究发现的生理重要性提供手段。在研究肿瘤结构驱动机械力改变癌症表观基因组方面也有进展。虽该新生领域多在体外研究,但新体内技术为研究力学与肿瘤生物学相互作用铺平了道路。癌变和肿瘤进展可视为遗传与非遗传因素的动态平衡(图3),将癌症置于此谱系,能更准确捕捉癌细胞行为复杂性,有助于未来研究揭示新突破点用于癌症治疗。
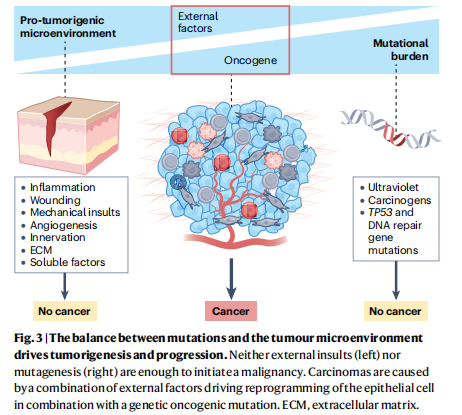
图3.基因突变与肿瘤微环境的平衡驱动肿瘤的发生和进展
述评
这篇文章《Beyondgenetics:drivingcancerwiththetumourmicroenvironmentbehindthewheel》由ShaopengYuan、JorgeAlmagro和ElaineFuchs撰写,发表在《NatureReviewsCancer》上,深入探讨了肿瘤微环境(TME)在癌症发生和发展中的关键作用,强调了非遗传因素在肿瘤进展中的重要性。
文章首先指出,癌症长期以来被视为一种遗传性疾病,研究多聚焦于基因突变的积累。然而,越来越多的证据表明,肿瘤微环境在癌症的发生和进展中扮演着至关重要的角色。例如,一些仅携带单个或少数癌基因突变的细胞在特定环境下也能发展成具有侵袭性的肿瘤。这表明,环境因素触发的表观遗传变化可能在恶性转化中起到关键作用。文章详细讨论了肿瘤微环境中的多种细胞和分子,包括免疫细胞、癌症相关成纤维细胞(CAFs)、血管、淋巴管、神经以及细胞外基质(ECM)等,这些成分通过复杂的相互作用影响肿瘤细胞的行为。例如,炎症被认为是癌症的一个重要驱动因素,它可以加速肿瘤的形成和进展。此外,CAFs通过分泌细胞因子和重塑ECM来促进肿瘤的发生和发展。文章还强调了机械力在肿瘤进展中的作用,如组织硬度、细胞间相互作用以及外部机械压力等,这些因素可以影响肿瘤细胞的侵袭性和转移能力。
文章进一步探讨了肿瘤微环境对肿瘤细胞内部表观遗传学的影响。例如,TME中的信号可以通过改变染色质结构、影响转录因子活性以及调节miRNA和翻译过程来驱动肿瘤的发生和进展。这些表观遗传变化通常是可逆的,为未来的癌症治疗提供了潜在的靶点。在临床方面,文章指出,肿瘤微环境的复杂性和动态性给癌症治疗带来了挑战。例如,免疫治疗可能通过激活免疫细胞来促进肿瘤的干性特征,从而导致治疗抵抗。此外,饮食、肥胖、激素变化等全身性因素也会影响肿瘤微环境和癌症的进展。文章强调,未来的癌症治疗需要综合考虑遗传和非遗传因素,以开发更有效的治疗策略。
总体而言,这篇文章为我们提供了一个全面的视角,让我们认识到肿瘤微环境在癌症发生和发展中的核心地位。它不仅挑战了癌症仅仅是遗传疾病的传统观念,还揭示了非遗传因素在肿瘤进展中的关键作用。这些发现为癌症的预防、诊断和治疗提供了新的思路和潜在的靶点,有望推动癌症研究和临床治疗的进步。
参考文献
Yuan S, Almagro J (2024) Beyond genetics: driving cancer with the tumour microenvironment behind the wheel. 24: 274-286.doi:10.1038/s41568-023-00660-9 PMID: 38347101
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)