首页 > 医疗资讯/ 正文
T细胞恶性肿瘤是一类高度侵袭性的血液系统恶性肿瘤,晚期及复发患者5年总生存率极低,治疗选择有限。近年来,CAR-T细胞疗法在B细胞肿瘤中取得突破,但针对T细胞肿瘤的CAR治疗受限于肿瘤及正常T细胞共同表达的靶点,导致CAR细胞在体外扩增过程中发生自体杀伤,难以获得效能稳定的疗效细胞产品。CD7是一种在95% T-ALL及部分T细胞淋巴瘤中高度表达的表面糖蛋白,也是NK细胞表面分子,成为CAR靶向T细胞肿瘤的重要候选标靶。
然而,CD7在正常NK细胞与T细胞的表达带来了显著的自体杀伤问题,限制了CD7 CAR免疫细胞的临床应用。目前,基于组织来源的NK细胞面临异质性大、转导效率低及生产成本高等挑战。人多能干细胞(hPSCs)作为无限来源的可编辑细胞,为制备规模化、均一化且基因稳定改造的CAR-NK细胞提供理想基础。尽管如此,提升CAR-NK细胞的体内持久性及归巢能力仍是制约疗效的关键因素。CXCR4-SDF-1轴在NK细胞骨髓归巢中起重要作用,其表达的上调有望改善CAR-NK细胞的体内分布及长效杀伤功能
近期,发表在Journal of Hematology & Oncology的一项研究中,发布了一种基于hPSCs的工程化CD7 CAR-NK细胞,成功避免了由于CD7靶点在NK细胞上的同源表达所引发的自相残杀,并显著提升了这些细胞对CD7阳性T细胞恶性肿瘤的抗杀伤能力。研究利用CRISPR/Cas12i技术敲除CD7基因,并构建含有CD7特异性CAR的基因修饰材料,随后采用高效的类器官诱导方法实现iNK细胞分化。通过表达趋化因子受体CXCR4,进一步增强CAR-NK细胞骨髓的归巢和体内持久性,有效抑制了T-ALL动物模型中的肿瘤生长,延长了动物寿命。该研究为解决T细胞恶性肿瘤临床治疗中由于共表达靶点CD7引发的CAR免疫细胞自体杀伤问题提供了新思路,也为大规模标准化生产高效CAR-NK细胞提供了技术平台。

。
研究方法
鉴于本为基础与转化医学研究,且研究方法部分偏重技术步骤,本文将简要提及。研究团队首先采用CRISPR/Cas12i系统,在hPSCs水平敲除CD7基因,防止CAR表达后出现自体杀伤。利用PiggyBac转座体系将CD7 CAR序列导入CD7 KO-hPSCs,随后采用类器官技术诱导其分化为iNK细胞。为增强骨髓归巢及体内存活,基因工程改造CD7 KO-CD7 CAR-hPSCs使其过表达CXCR4,获得CRO-CD7 CAR-iNK细胞。功能评价涵盖体外杀伤活性、多轮杀伤实验、细胞分泌因子分析及体内B-NDG hIL15小鼠T-ALL模型的治疗效果检测。
研究结果
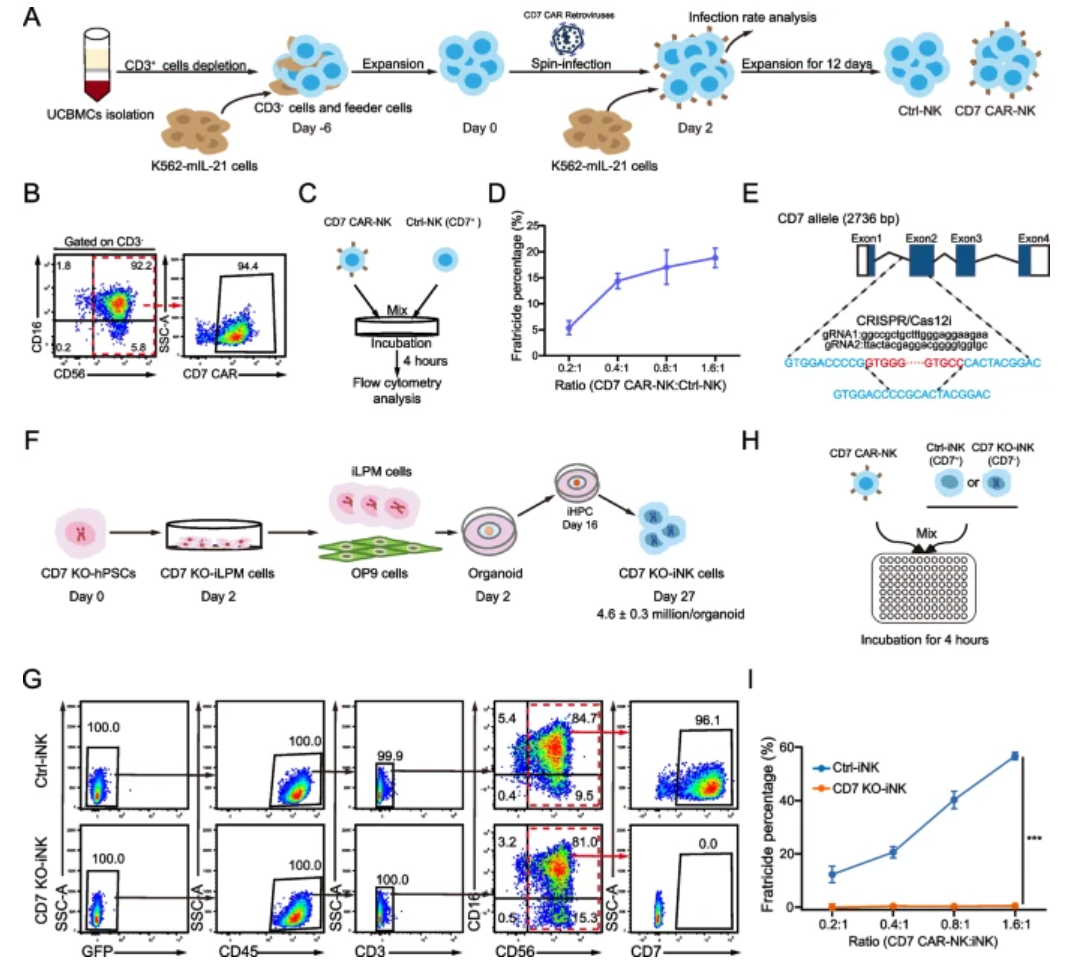
1. UCB来源CD7 CAR-NK细胞存在严重自体杀伤,CD7 KO避免自相残杀
实验结果显示,利用脐带血(UCB)来源NK细胞经CD7 CAR修饰后,面对自体天然NK细胞存在强烈杀伤活性,导致CAR-NK细胞扩增能力严重受限。基于此,研究利用两对CRISPR/Cas12i引导RNA靶向CD7基因第一内含子及第二外显子,实现基因敲除并验证成功。敲除CD7的hPSCs通过类器官法分化为iNK后,CD7表面标志显著消失。体外共培养实验表明CD7 KO-iNK细胞能有效逃避CD7 CAR NK细胞自体杀伤,而对照组CD7+ iNK则被显著杀伤。
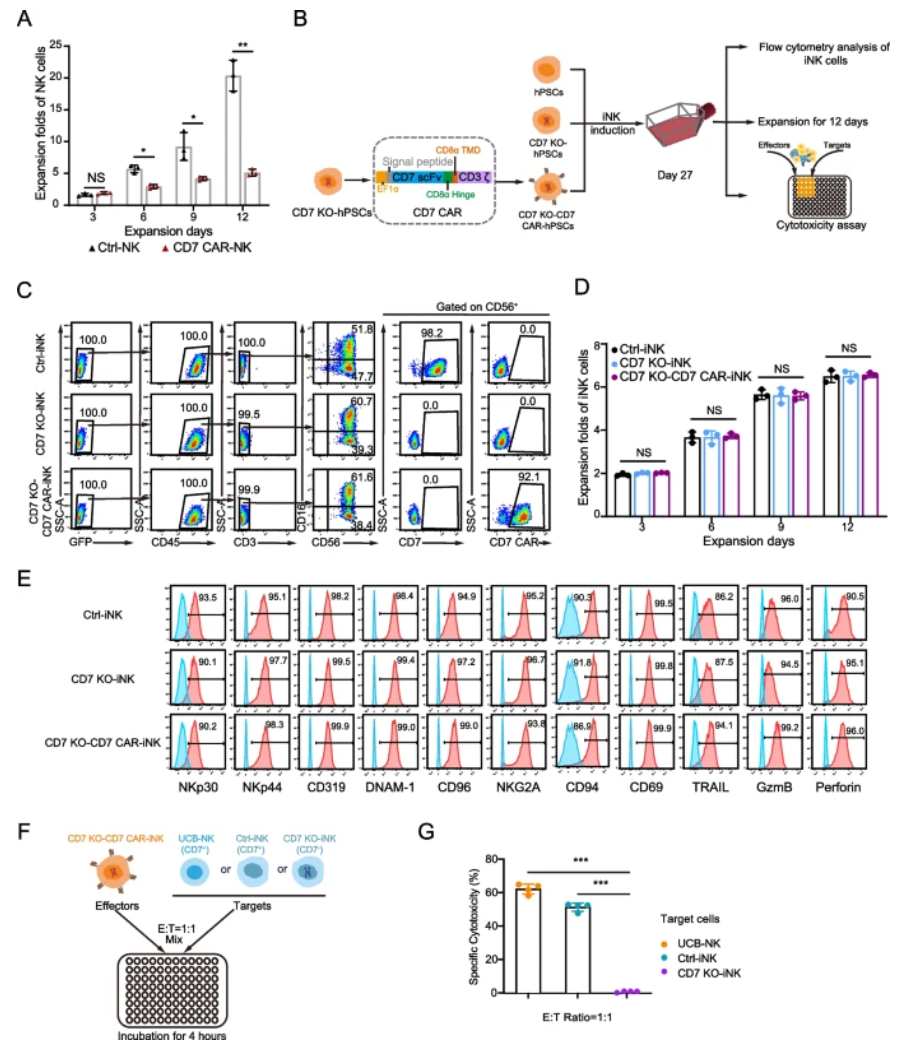
2. CD7基因敲除恢复CD7 CAR-iNK细胞扩增能力并保持活性特征
在hPSC水平实现CD7 KO并导入CD7 CAR后,获得了表达高达99%的CD7 KO-CD7 CAR-iNK细胞。这些细胞扩增倍数与未修饰iNK无显著差异,明显优于UCB来源的CAR NK细胞低扩增能力。此外,激活受体(NKp30、NKp44、DNAM-1等)、抑制受体(NKG2A、CD94)、激活分子CD69及细胞毒分子(颗粒酶B、穿孔素)表达均未受负面影响,显示NK功能完整。针对照组NK细胞,CD7 KO-CD7 CAR-iNK表现出强烈杀伤,但对CD7 KO-iNK无杀伤,进一步印证了fratricide规避成功。
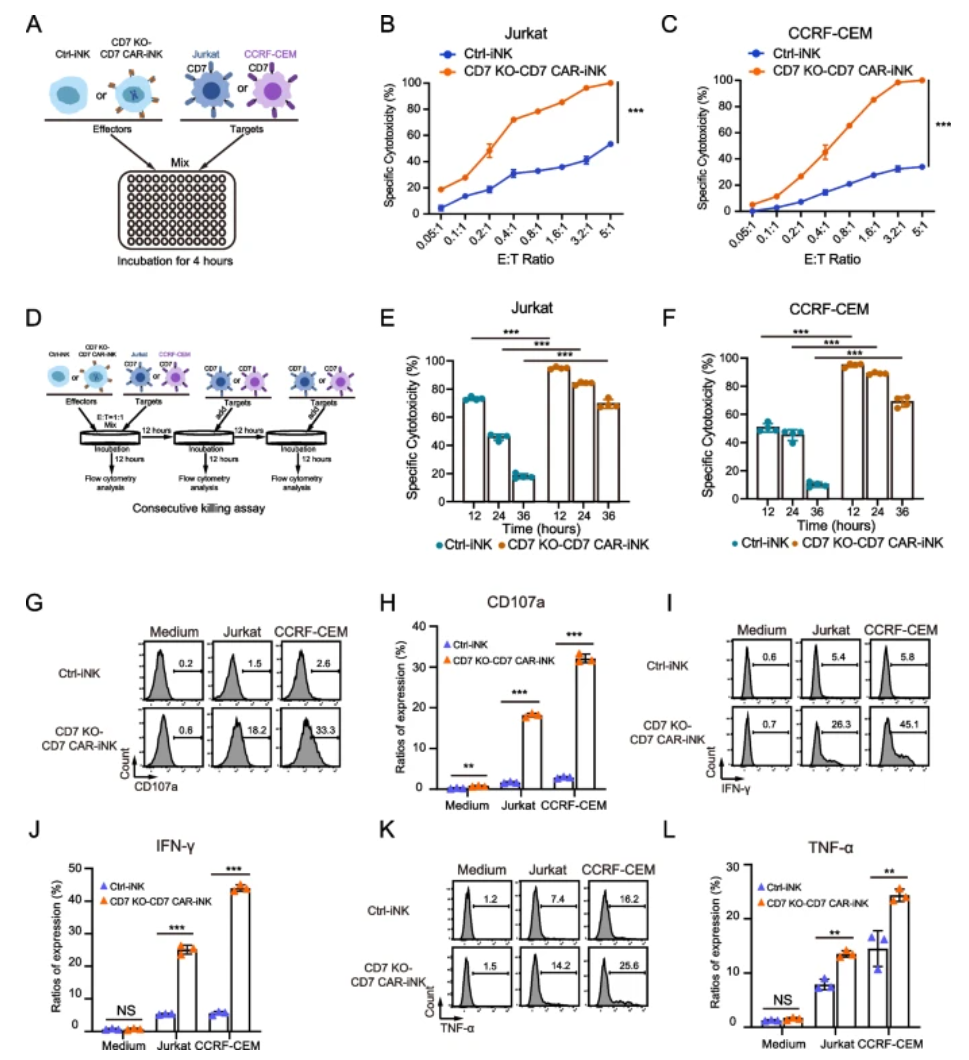
3. CD7 KO-CD7 CAR-iNK细胞对CD7+肿瘤细胞和T-ALL原代细胞表现强效杀伤
以高表达CD7的T-ALL细胞系Jurkat和CCRF-CEM为靶标,CD7 KO-CD7 CAR-iNK细胞在不同效靶比下均展现显著优于对照iNK的杀伤活性,能快速诱导肿瘤细胞凋亡,且多轮连续杀伤实验显示其持续杀伤能力明显增强。细胞表面CD107a脱颖而出,细胞因子IFN-γ与TNF-α分泌水平显著提高,表明CAR激活下杀伤效应发挥充分。
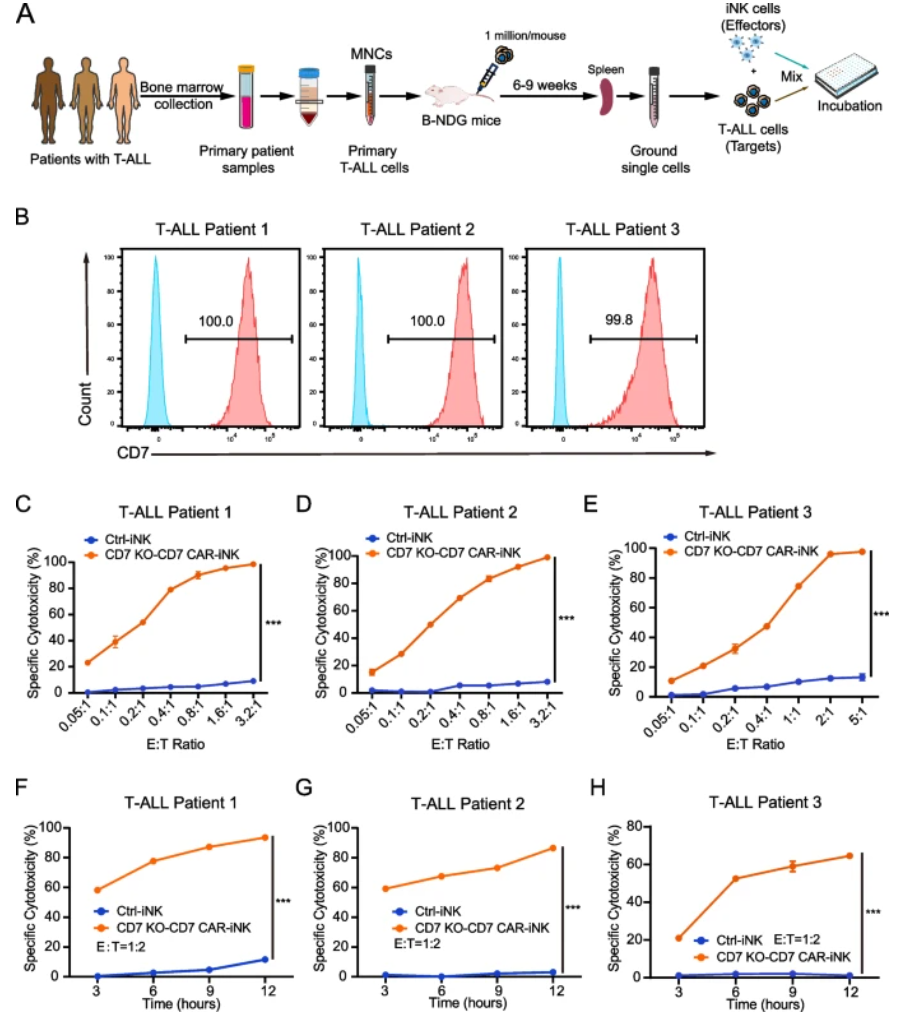
随后,采用自体患者骨髓单核细胞生物样本建立异种移植小鼠模型,获取CD7+原代T-ALL细胞。CD7 KO-CD7 CAR-iNK细胞对三位患者来源的T-ALL细胞均展现强大杀伤活性,特别在时程追踪中杀伤率持续上升,表明其对原代瘤细胞具持续、稳定的杀伤潜能。
4. CXCR4过表达增强CD7 CAR-iNK骨髓定向归巢及体内持久性
将CXCR4基因导入CD7 KO-CD7 CAR-hPSCs,获得CRO-CD7 CAR-hPSCs并诱导分化,所获得的CRO-CD7 CAR-iNK细胞成功表达CXCR4。向B-NDG hIL15小鼠尾静脉输注带有荧光素酶的CD7 KO-CD7 CAR-luci-iNK及CRO-CD7 CAR-luci-iNK细胞,利用活体成像技术发现两类细胞初期在肺部集聚,24小时后CXCR4表达细胞显著转移至骨髓及脊椎部位,存活时间超过60天显著长于对照组。流式分析证实,CXCR4过表达极大提升骨髓及外周血中CAR-iNK细胞比例。这揭示CXCR4可作为调控CAR-NK细胞归巢骨髓、增强抗肿瘤持续作用的有效策略。
5. CRO-CD7 CAR-iNK细胞显著延长T-ALL异种移植模型存活期,抑制肿瘤进展
在B-NDG hIL15免疫缺陷小鼠T-ALL模型中,注射CRO-CD7 CAR-iNK细胞显著抑制了CCRF-CEM-luci细胞生长,生物发光信号低于PBS、Ctrl-iNK及CD7 KO-CD7 CAR-iNK组。在多次移植后,接受CRO-CD7 CAR-iNK治疗的动物中位存活期延长至36天,显著优于其他对照组(29-32天),表明CXCR4辅助的CD7 CAR-iNK细胞疗效更优。该模型初步验证高扩增能力、无自体杀伤且具归巢优势的CAR-iNK细胞具备临床治疗潜力。
研究价值与意义
本研究提出并验证了一套创新的工程方案,通过CRISPR敲除CD7基因解决了传统CD7 CAR免疫细胞因共表达CD7所导致的自体杀伤瓶颈,确保了细胞的高效扩增与活性维持。基于多能干细胞的类器官分化体系既保证了 CAR-NK产品的均一性和大规模制造潜力,也显著降低了生产成本。同时,CXCR4的基因过表达策略成功赋予CAR-NK细胞骨髓归巢能力,解决了过去体内存活短暂、归巢效率低的问题,在临床恶性肿瘤治疗中具重要意义。该技术创新为T细胞相关血液肿瘤破解治疗难题开辟了新途径,不仅提升了CAR免疫细胞治疗的安全性和有效性,也为其他免疫靶点设计提供了可借鉴的方案。未来,这一平台有望进一步结合细胞因子自源表达、免疫抑制微环境改造等多重手段,推进CAR免疫细胞治疗的临床转化及个性化精准治疗。
原始出处
Lin et al. Engineered CRO-CD7 CAR-NK cells derived from pluripotent stem cells avoid fratricide and efciently suppress human T-cell malignancies. Journal of Hematology & Oncology (2025) 18:57. https://doi.org/10.1186/s13045-025-01712-3
猜你喜欢
- 女人每日吃葛根粉好吗 葛根粉的作用与功效是什么
- 知识卡片 | 13种心电图波段异常的可能病因
- 最新数据:1990-2021 年中国抑郁/焦虑障碍流行病学分析
- J Thorac Oncol:埃万妥单抗对EGFR突变型NSCLC的疗效和安全性研究
- 体内尿酸指数高的人可以吃螃蟹吗
- “人生最后一次骨折”麻醉方式怎么选择?
- 减肥该吃什么面
- eClinicalMedicine:警惕!林奇综合征 40% 患者罹患非结直肠癌/子宫内膜癌,首发表现易致漏诊错失干预时机
- 自体存储脐带血救治19岁再障患者,创我国脐血应用纪录
- Blood:Enasidenib vs 常规疗法治疗IDH2突变的复发性/难治性AML老年患者
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)