首页 > 医疗资讯/ 正文
[摘要]背景与目的:肿瘤患者血浆游离DNA(cell-free DNA,cfDNA)高通量检测广泛用于肿瘤靶向治疗相关基因的筛选。本研究探讨cfDNA中Ⅰ类及Ⅱ类靶向治疗相关基因变异类型及数量与非小细胞肺癌(non-small cell lung cancer,NSCLC)患癌预后的关系。方法:收集2021年—2023年在中山大学肿瘤防治中心进行血浆cfDNA高通量测序项目的NSCLC患者的测序结果及临床资料,并对入组患者从2021年6月1日采集血浆当天开始截至2024年5月27日进行生存随访,并使用GraphPad Prism 8.0及SPSS Statistics 25.0对患者生存期与临床资料及测序结果中Ⅰ类与Ⅱ类靶向治疗相关基因类型及数目进行单因素及多因素统计学分析(伦理批号:B2024-359-01)。结果:313例NSCLC患者中确诊时分期Ⅰ期25例(7.98%)、Ⅱ期20例(6.39%)、Ⅲ期38例(12.14%)和Ⅳ期230例(73.48%);组内NSCLC分型包含腺癌(90.10%),鳞癌(5.11%),大细胞癌(2.87%)及其他分型(1.92%);入组的NSCLC患者血浆cfDNA中Ⅰ类与Ⅱ类靶向治疗相关基因数及占比分别为:0个(25.24%)、1个(17.57%)、 2个(19.17%)、3个(14.38%)、4个(8.31%)、5个及以上(15.34%)。患者血浆cfDNA高通量测序检测结果中,突变频率最高的3个基因分别为EGFR、 TP53、ERBB2基因,其中EGFR基因突变频率为36.04%,TP53基因突变频率为30.63%,ERBB2基因突变频率为4.95%。患者生存期不仅与热点靶向基因表达情况相关,与血浆cfDNA高通量测序中Ⅰ类和Ⅱ类靶向相关位点基因变异个数也呈正相关。经过治疗后无靶向治疗相关基因的位点变异比有靶向治疗相关基因的位点变异的患者的生存期长,死亡风险可降低63.2%。而单纯一个基因位点变异比多个驱动基因位点变异的患者的生存期长,死亡风险更低,所测得的Ⅰ类及Ⅱ类靶向治疗药物在3个基因数以内,基因数目越少,患者的生存期越长。结论:血浆cfDNA高通量测序中Ⅰ类和Ⅱ类靶向相关位点基因变异个数对经过治疗后的NSCLC患者的生存期有影响。血浆cfDNA高通量测序检测可作为患者预后的评估指标。
[关键词] 非小细胞肺癌;血浆游离DNA;高通量测序;基因突变位点;靶向治疗药物筛选;生存分析
[Abstract] Background and purpose: High-throughput detection of plasma cell-free DNA (cfDNA) is widely used for multi-cancer targeted therapy drug screening, and this study investigated the relationship between the type and number of plasma cfDNA class Ⅰ and Ⅱ targeted therapy-related gene variants and cancer survival in patients with non-small cell lung cancer (NSCLC). Methods: The sequencing results and clinical data of NSCLC patients who underwent tumor plasma cfDNA high-throughput sequencing projects in Sun Yat-sen University Cancer Center from 2021 to 2023 were collected. The survival follow-up of enrolled patients was carried out from the day of plasma collection on June 1, 2021 to May 27, 2024, and GraphPad Prism 8.0 and SPSS Statistics 25.0 were used. Univariate and multivariate statistical analyses were conducted on the types and numbers of class Ⅰ and class Ⅱ targeted therapy-related genes in the survival and clinical data of patients and sequencing results (Ethical approval: B2024-359-01). Results: A total of 313 patients included in this study with NSCLC were categorized into stage Ⅰ 25 patients (7.98%), stage Ⅱ 20 patients (6.39%), stage Ⅲ 38patients (12.14%), and stage Ⅳ 230 patients (73.48%). Pathological diagnosis results showed that adenocarcinoma accounted for 90.10%, squamous cell carcinoma accounted for 5.11%, large cell carcinoma accounted for 2.87% and other classifications accounted for 1.92%. The number and the percentage of class Ⅰ and class Ⅱ targeted therapy drug-related genes in the plasma cfDNA NSCLC patients were 0 (25.24%), 1 (17.57%), 2 (19.17%), 3 (14.38%), 4 (8.31%), and 5 or more (15.34%). The results of statistical analysis showed that 3 genes with the highest mutation frequencies were EGFR, TP53 and ERBB2, and the mutation frequency of EGFR gene was 36.04%. The mutation frequency of TP53 gene was 30.63%. The mutation frequency of ERBB2 gene was 4.95%. The survival time of patients is related to not only the expression of hotspot targeted genes, but also the number of class Ⅰ and Ⅱ target-related gene variants detected by plasma cfDNA high-throughput sequencing. The survival time of the patients with no targeted therapy-related locus variants after treatment was longer compares with targeted therapy-related locus variants, which can reduce the risk of death by 63.2%. However, patients with a single gene locus variant had longer survival time and lower risk of death than those with multiple driver locus variants, and the measured class Ⅰ and Ⅱ targeted therapy drugs were within 3 genes. Overall, the smaller the number of genes, the longer the survival. Conclusions: The number of class Ⅰ and class Ⅱ targeted therapy-related gene variants in plasma cfDNA high-throughput sequencing also has an effect on the survival of patients after treatment. Plasma cfDNA level detected by high-throughput sequencing could be a prognostic factor for the NSCLC patients.
[Key words] Non-small cell lung cancer; Plasma cell-free DNA; High-throughput sequencing; Gene mutation sites; Targeted therapy drug selection; Survival analysis
肺癌是目前全球发病率及死亡率最高的恶性肿瘤之一,对人类健康构成严重威胁[1-2]。肺癌中,约85%为非小细胞肺癌(non-small cell lung cancer,NSCLC),且70%的NSCLC患者在确诊时已是晚期[3]。晚期肺癌因肿瘤增长会出现坏死的情况,在坏死过程中,坏死组织会释放出大量的DNA进入外周血,致使肿瘤患者血浆中游离DNA(cell-free DNA,cfDNA)水平升高。cfDNA是一种通过坏死、凋亡、吞噬或主动分泌等方式释放到血液中的片段化DNA。cfDNA也包括了从癌细胞中释放的循环肿瘤DNA(circulating tumor DNA,ctDNA)[4]。另外,肿瘤坏死过程所释放的DNA片段一般较长,即DNA完整性较好,而正常人群循环游离的DNA以细胞凋亡产生的DNA为主,其DNA完整性较差。因此,肺癌患者的cfDNA含量及完整性均高于正常人群。
本研究拟对经过治疗后NSCLC患者的cfDNA高通量测序结果进行分析,探讨靶向治疗相关基因突变类型及数量与患者生存期的关系,以明确血浆cfDNA高通量测序检测作为NSCLC患者预后预测标志物的价值。
1 资料和方法
1.1 临床资料
选取于2021年6月—2023年6月在中山大学肿瘤防治中心就诊检查肿瘤血浆cfDNA高通量测序项目的NSCLC患者(伦理批号:B2024-359-01)。纳入标准:① 年龄≥18周岁;② 病理学检查结果确诊为NSCLC;③ 无其他系统严重疾病者。排除标准:① 年龄<18周岁;② 病理学检查未明确诊断为NSCLC;③ 有其他系统严重疾病者;④ 无随访或失访6个月及以上;⑤ 合并其他类型肿瘤;⑥ 其他不适合本研究的情况。
1.2。 cfDNA的提取
将血液样本统一采集到10 mL的Streck采集管(购自美国BD公司)中,上下颠倒混匀,2~8 ℃保存,并于2 h内进行两步离心法处理(1 600×g,15 min,4 ℃,吸取中间层白细胞约1 mL;16 000×g,15 min,4 ℃)。血浆置于15 mL EP管(购自德国Eppendorf公司)内,白细胞置于1.5 mL EP管中,标注好相关信息一同存放于-20 ℃,1周内进行提取处理。取先证者4 mL血浆,使用血浆50人份ctDNA样本核酸提取试剂盒QIAamp Circulating Nucleic Acid Kit(55114)提取cfDNA,提取的DNA浓度使用Qubit3.0测定;并取先证者全血白细胞层使用全血对照样本50人份核酸提取试剂盒QIAamp DNA Mini Kit(51304)提取基因组DNA(购自德国QIAGEN公司),提取的DNA浓度和纯度用NanoDrop 2000分光光度计(购自美国ThermoFisher公司)测定,检测后同时储存于-80 ℃冰箱中,后用冰块保持低温邮寄至武汉华大医学检验实验室进行全外显子组测序。
1.3 文库建立及质量控制
采用硅胶膜离心柱法[6]提取cfDNA,使用Qubit DNA荧光定量仪和Qubit dsDNA HS Assay kit进行ctDNA纯化后定量,要求ctDNA纯化后总量≥60 ng,且纯化回收率为37%~94%。使用Agilent 4150 TapeStation自动化电泳系统检测样品的片段大小范围及浓度,主带在170 bp左右,无明显拖尾,无蛋白、RNA等污染。对白细胞提取的gDNA使用美国Covaris公司M220超声波DNA打断仪剪切基因组DNA,获得长度为180~300 bp的DNA片段;将cfDNA与对照gDNA同时使用688泛癌种多基因检测(联合探针锚定聚合测序法)文库构建试剂盒和杂交捕获试剂盒(购自深圳华大基因股份有限公司)构建DNA测序文库和目标外显子组捕获,捕获探针采用泛癌种多基因检测(联合探针锚定聚合测序法)杂交捕获试剂盒,使用双Barcode环化试剂盒利用DNA纳米球技术将产物模板进行放大,通过Pattern array技术将DNB固定在阵列化的硅芯片上,之后在MGIseq-2000测序平台上进行高通量测序。
1.4 突变分析
对原始读取数据进行预处理,经过测序质量评估后过滤掉低质量数据和接头污染,然后使用BWA软件将reads比对到人类参考基因组(hg19),标记重复序列、碱基质量矫正后检测突变,注释突变位点的详细信息。
1.5 随访与治疗方案
跟踪随访时间截至2024年5月27日,入组患者失访率和删失比例分别为17.9%和30.7%,其中删失主要原因为患者死亡,本研究主要使用Kaplan-Meier统计方法处理失访和删失问题。在不进行正态性检验的前提下,直接采用非参数检验。入组患者从确诊NSCLC到随访结束时间内的治疗,包括手术及用药治疗,且不限于手术与用药治疗同时进行。本研究所指手术仅限定于手术组织的切除或消融手术,不包含取活检、穿刺等手术手段。本研究一线用药包括单纯化疗、单纯靶向治疗、单纯免疫治疗、化疗合并靶向治疗、靶向治疗联合免疫治疗、化疗/靶向治疗/免疫治疗联合治疗。
1.6 统计学处理
采用描述性统计分析方法分析NSCLC患者临床病理学特征。采用Kaplan-Meier方法估计生存率和生存曲线,并使用对数秩检验比较组间生存差异。采用Cox回归进行多因素生存分析。P<0.05为差异有统计学意义。本研究采用GraphPad Prism 8.0 和SPSS Statistics 25.0进行统计学分析。
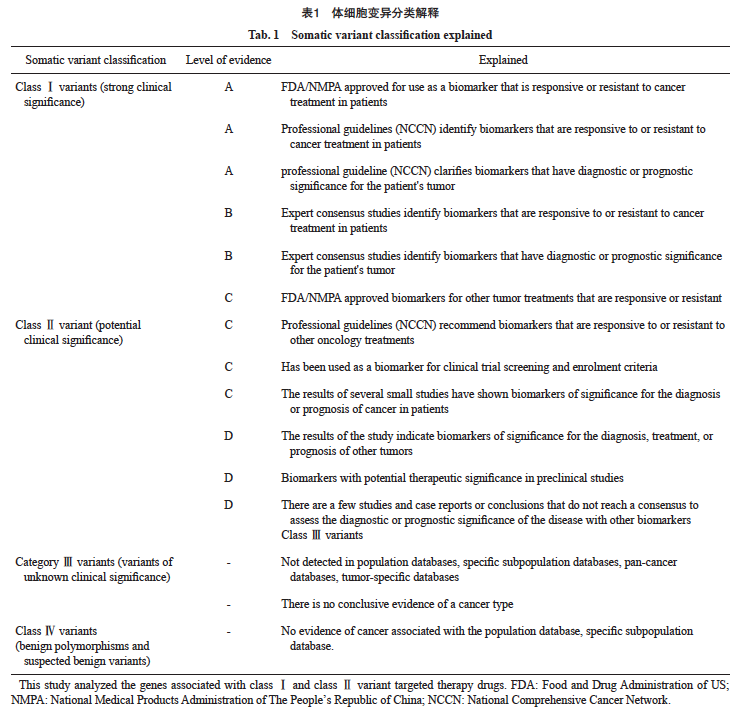
1.7 体细胞变异[7]分类解释
体细胞变异分类解释情况见表1。
2 结 果
2.1 入组患者情况
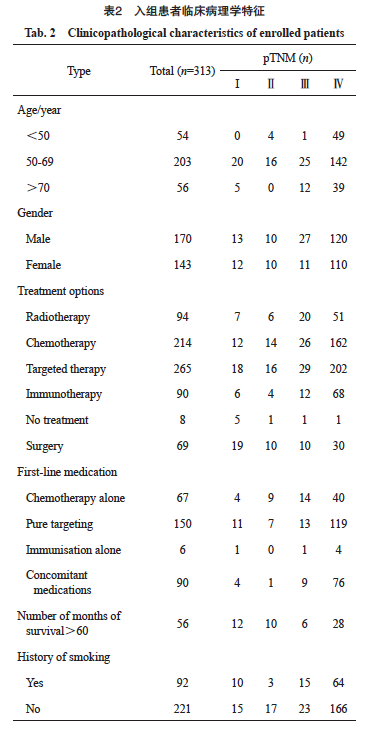
患者纳入和排除标准流程图见图1。最终纳入313例NSCLC患者,包括男性170例,女性143例;年龄范围22~89岁,平均年龄59.7岁。根据国际肺癌研究学会(International Association for the Study of Lung Cancer,IASLC)2023年公布的第9版[5]肺癌TNM分期标准对所有NSCLC患者进行TNM分期,据统计,所有NSCLC患者检查血浆cfDNA高通量测序项目时间都处于Ⅲ期~Ⅳ 期(表2),本研究以病理学检查确诊为NSCLC的时间分期进行分组,入组Ⅰ期25例,Ⅱ期20例,Ⅲ期38例,Ⅳ期230例;其中腺癌282例,鳞癌16例,大细胞癌9例,NSCLC其他病理类型6例。随访日期截至2024年5月27日。
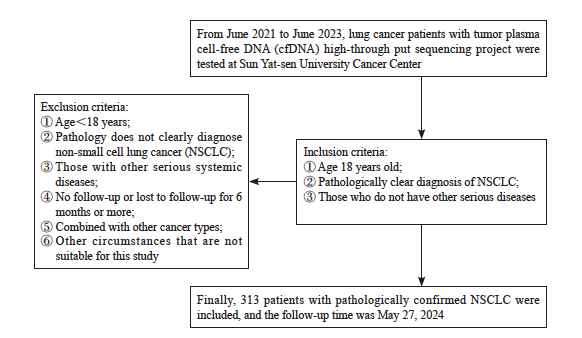
图1 患者纳入和排除标准流程图
Fig. 1 Flowchart of patient inclusion and exclusion criteria
2.2 入组患者靶向治疗相关基因位点突变情况
根据入组患者肿瘤cfDNA高通量测序结果的靶向治疗相关基因位点突变情况,绘制阳性位点比例图(图2)及阳性位点丰度热图(图3)。结果显示,突变频率最高的3个基因分别为EGFR、TP53和ERBB2基因:EGFR基因突变频率为36.04%,TP53基因突变频率为30.63%,ERBB2基因突变频率为4.95%,EGFR与TP53基因突变频率最高,突变频率相当,以EGFR基因与TP53基因为例,基因突变位点对靶向治疗药物筛选的价值。将EGFR基因突变类型(18~21号染色体突变位点,包括EGFR 19del、L858R、T790M[8-9]等及EGFR拷贝数)汇总为1组,TP53基因突变类型汇总为1组,分别进行突变基因位点在同一类型治疗方案的生存分析。
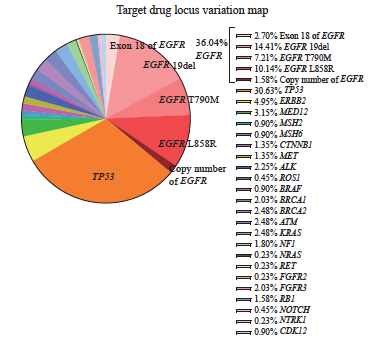
图2 靶向治疗相关基因阳性位点比例图
Fig. 2 Target drug locus variation map
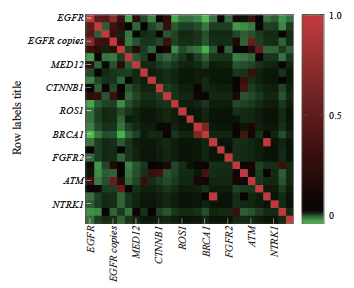
图3 靶向治疗相关基因突变位点位点丰度热图
Fig. 3 Locus abundance map
Targeted therapy-related gene loci only included class Ⅰand class Ⅱ targeted therapy-related gene loci.
2.3 靶向治疗相关基因位点不同突变个数生存分析比较
靶向相关位点基因变异个数对患者生存期的影响,结果显示,差异有统计学意义(P <0.001)。靶向相关位点基因变异个数为0~5个及以上的中位生存期分别为141.1、107.3、53.5、34.9、48.7和54.9个月(图4)。
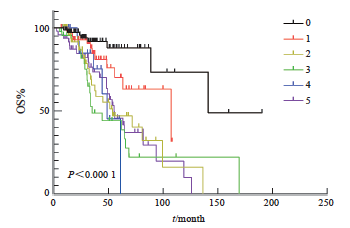
图4 靶向治疗相关基因位点不同突变个数的生存分析比较图
Fig. 4 Survival curves of targeted therapy-related gene mutation locus
Targeted therapy-related gene loci only included class Ⅰ and class Ⅱ targeted therapy-related gene loci. OS: Overall survival.
2.4 热点靶向基因表达与否对患者生存期影响
在肿瘤cfDNA高通量测序检测结果中发现,EGFR基因不表达与EGFR基因表达对患者生存期差异有统计学意义(HR=0.530,P=0.002),EGFR基因不表达与EGFR基因表达的中位生存期分别为118.8和55.6个月(图5A)。抑癌基因TP53不表达(HR=0.304,95% CI: 0.167~0.555,P<0.001)与TP53基因表达对患者生存时长(HR=0.321,95% CI: 0.179~0.579,P=0.005),差异有统计学意义。两者中位生存期分别为99.4和34.4个月(图5B)。单纯EGFR基因(HR=0.399,95% CI: 0.236~0.676,P<0.001)与EGFR基因及TP53基因同时表达对患者生存时长的关系(HR=0.365,95% CI: 0.218~0.611,P <0.001),差异有统计学意义。两者中位生存期分别为80.9和44.7个月(图5C)。有靶向相关位点基因变异(HR=0.368,95% CI: 0.231~0.585,P<0.001)与无靶向位点相关变异对患者生存期的影响(HR=0.226,95% CI: 0.143~0.357,P=0.002),差异有统计学意义。两者中位生存期为61.9与141.1个月(图5D)。
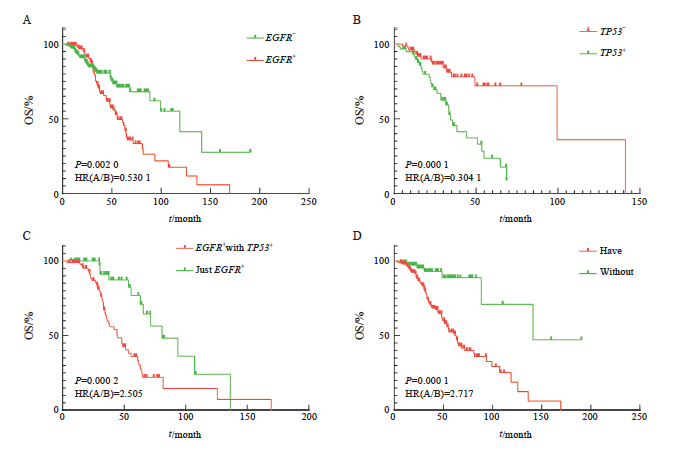
图5 热点靶向基因表达与否对患者生存期影响
Fig. 5 Effect of hotspot target gene expression on patient survival
A: Difference in survival of EGFR gene expression or not; B: Differences in survival of TP53 gene expression and non-expression; C: Differences in survival of EGFR gene expression combined with TP53 gene; D: There was no difference in survival between the expression of gene associated with targeted therapy drugs and those associated with targeted therapy drugs. Targeted therapy-related gene loci only included class Ⅰ and class Ⅱ targeted therapy-related gene loci.
2.5 入组患者生存期差异因素分析:确诊时pTNM分期[5]对生存期的影响
本研究以病理学检查确诊为NSCLC的时间分期进行分组,故先对分期进行统计分析(Ⅲ期与Ⅳ期NSCLC患者268例,Ⅰ期与Ⅱ期NSCLC患者45例)。结果显示,Ⅰ期及Ⅱ期(P=0.003,HR=0.411,95% CI: 0.255~0.663)与Ⅲ期与Ⅳ期(P=0.003,HR=0.366,95% CI: 0.234~0.570) NSCLC中位生存期分别为125.7与64.8个月(图6A)。
对Ⅲ期与Ⅳ期NSCLC患癌期间是否有手术史进行生存分析,其中有手术史43例(P<0.001,HR=0.414,95% CI: 0.253~0.679),无手术史225例(P<0.001,HR=0.321,95% CI: 0.198~0.519)。结果显示,无手术史与有手术史患者的中位生存期分别为53.47和88.50个月,差异有统计学意义。对Ⅰ期与Ⅱ期NSCLC患癌期间是否有手术史进行生存分析,结果显示差异无统计学意义(图6B)。
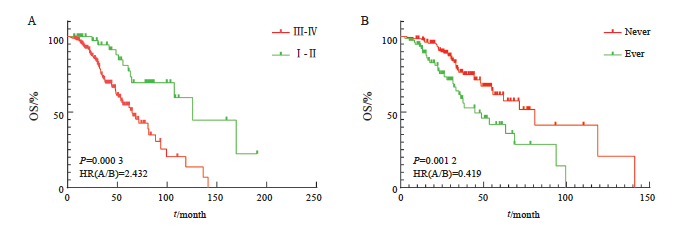
图6 生存期差异的因素分析
Fig. 6 Factor analysis of survival differences
A: Survival differences in pTNM stage at the time of diagnosis; B: Whether there is a history of surgery during the middle and advanced stage of cancer, and the difference in survival time.
2.6 不同影响因素情况下,靶向治疗相关基因位点生存分析
本研究分析在268例Ⅲ~Ⅳ期NSCLC患者组中,不同靶向治疗相关位点基因变异个数对患者生存期的影响。结果显示,靶向相关位点基因变异个数为0~5个及以上的患者的中位生存期分别为141.1、107.3、53.5、33.4、44.2和50.9个月(图7)。
本研究分析在221例无吸烟史NSCLC患者组中,不同靶向治疗相关位点基因变异个数对患者生存期的影响。结果显示,靶向相关位点基因变异个数为0~5个及以上的患者的中位生存期分别为141.1、未明确、71.6、34.9、61.0和63.2个月(P<0.001)。在组内150例接受一线用药方案为单纯靶向用药的NSCLC患者组中,靶向相关位点基因变异个数为0~5个及以上的患者的中位生存期分别为未明确、未明确、71.6、41.2、61.0和81.7个月(P=0.008)。本研究还分析了在组内244例无手术史NSCLC患者组中,不同靶向相关位点基因变异个数对患者生存期的影响。结果提示,靶向相关位点基因变异个数为0~5个及以上的患者的中位生存期分别为141.1、63.2、44.7、 32.8、61.0和49.3个月(P<0.001)。
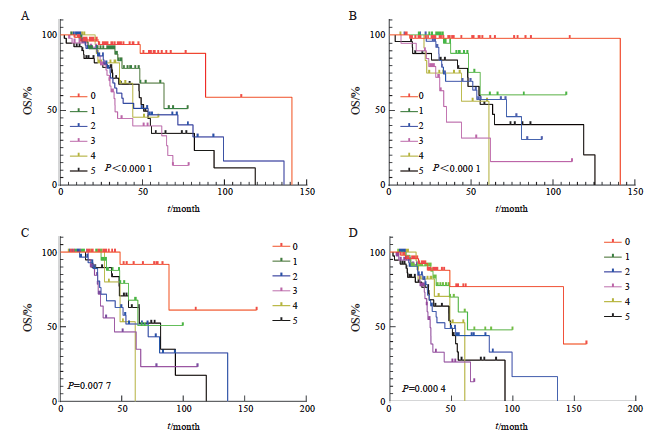
图7 不同影响因素情况下,靶向治疗相关基因位点不同突变个数生存分析
Fig. 7 Survival analysis of different mutations at targeted therapy-related gene loci under different influencing factors
A: Differences in the survival of different mutations in stages Ⅲ-Ⅳ; B: Differences in survival of different mutations in patients without smoking history; C: First-line treatment is the difference in survival of patients with different mutations on targeted therapy alone; D: There was no difference in the survival of different mutations without relevant surgical history. Targeted therapy-related gene loci only included class Ⅰ and class Ⅱ targeted therapy-related gene loci.
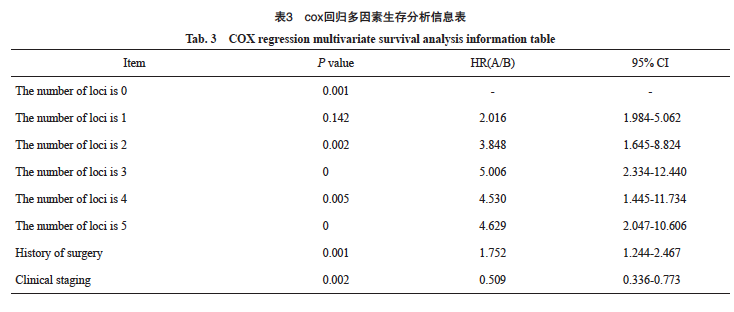
2.7 Cox回归多因素生存分析
对研究数据进行多因素Cox回归分析,结果显示,基因位点数为0的患者比其他变异个数的患者死亡风险更低,HR皆 >1,且在基因位点个数3个以内呈现基因位点个数越少,HR值越大,死亡风险更低的情况。在有靶向位点变异前提下,基因位点变异个数越少,死亡风险越低(图8和表3)。
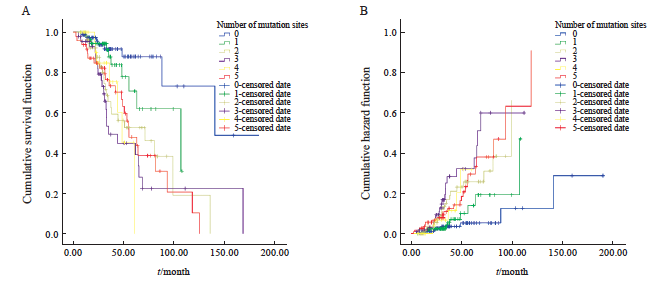
图8 Cox回归多因素生存分析图
Fig. 8 Cox regression multivariate survival analysis
A: Survival analysis of the number of positive sites of different targeted therapy drugs; B: Risk estimation model diagram of the number of positive sites of different targeted therapy drugs. Targeted therapy-related gene loci only include class Ⅰ and class Ⅱ targeted therapy-related gene loci.
3 讨 论
基因检测可以帮助医师根据患者的不同情况制定专属的治疗方案,从而实现个体化治疗。从理论上而言,检测的基因位点数量越多、越全面,越能够为临床医师提供诊断和治疗的信息参考,患者潜在的获益也就越多。基因检测的选择可以根据检测范围(panel)的大小进行调整:小型panel涵盖的基因检测种类较少,医师和患者获得的信息就会相应地少一些;若panel范围较大,则获取的基因检测信息相应地就会多一些。但范围大,费用也会提高,在经济条件有限的情况下,医师要结合患者下一步的治疗药物的意愿选择panel大小。中型panel(几十到百余个基因)包括绝大多数肺癌已知靶点基因。大型panel(几百个基因)包括体细胞突变的所有基因;胚系基因突变,同源重组修复缺陷基因,遗传相关基因;肿瘤突变负荷,微卫星稳定性。此外,大型panel还能预测免疫治疗的效果,涉及免疫治疗的正向基因、负向基因等。肺癌患者cfDNA的特性存在潜在的诊断价值。相对于传统的肺癌诊断方法的局限性[灵敏度和(或)特异性低、创伤大],cfDNA是一种无创或微创的肺癌诊断方法,且血浆cfDNA高通量测序在晚期NSCLC患者中检测基因突变的灵敏度高[10],血浆cfDNA测序与基于组织二代测序一致性较高[11],可能是一种替代方案[12]。肿瘤cfDNA高通量测序检测已广泛用于肺癌及其他肿瘤靶向治疗药物的筛选,血浆、胸腹水、脑脊液等体液的检出率升高,标志着液体活检技术的进展 [13],其具有高特异性和高灵敏度,无创或微创,对基因突变信息全面、系统、准确地解读,对一线治疗靶向治疗药物更加快速、准确、有效地筛选等特点,对临床靶向治疗用药提供更有参考意义的信息。
本研究通过对提取的肿瘤cfDNA进行高通量测序,对688个基因位点突变情况进行统计分析,由Ⅰ类、Ⅱ类靶向治疗相关基因的位点变异情况进行相应的生存分析可知,基因位点变异并非越多越好,无明确靶向治疗相关基因位点变异的患者的生存期相比有靶向治疗相关基因位点变异的患者要长,单个靶向治疗相关基因位点变异的患者的生存期比多个靶向治疗相关基因位点变异的患者要长,这个发现是与以往研究结果不一致的地方。Wang等[14]发现在EGFR突变人群中,纯的突变效果最好;当混杂其他突变基因时,则需要考虑突变基因的生物学背景。
本研究结果显示,确诊时为Ⅰ期、Ⅱ期患者的生存期较Ⅲ期、Ⅳ期患者长,在早期确诊的NSCLC患者总生存期超过5年的占55.56%,而晚期确诊的5年生存率仅为12.69%,Ⅰ期及Ⅱ期NSCLC患者中位生存期为125.7个月,Ⅲ期与Ⅳ 期NSCLC患者的中位生存期为64.8个月,由此可见,早检查、早发现、早治疗可有效延长患者的生存期。患者生存期受各方面因素影响,确诊时肿瘤的分期、患者年龄[1,15]、吸烟史[1,16]、手术史等因素被多数文献肯定。cfDNA高通量测序具有作为肺癌持续监测疗效生物标志物的巨大潜力,在不同类型的癌症中具有不同的诊断价值,cfDNA具有更高的灵敏度,使其更适用于筛查方法和持续监测[17]。靶向治疗、免疫治疗的发展为肿瘤的精准治疗[18-19]提供了新的方向,而cfDNA高通量测序对NSCLC患者靶向治疗药物筛选[20]起到了重要的作用。本研究显示,无靶向治疗基因突变患者的死亡风险比有靶向治疗基因变异的低,靶向基因变异的个数会影响患者的生存期。导致此结果的原因主要可能为:① 患者血浆中的突变位点丰度过低,未被检测出;② 经过治疗后患者体内肿瘤细胞数量减少;③ 靶向位点个数可能由于基因之间的协同或拮抗作用影响了患者的生存期。本研究收集到的腺癌类型占比较多,Ⅰ期、Ⅱ期患者占比较少,临床数据收集的随机性可能令研究结果出现偏倚,后续研究将扩大研究的样本量并加入偏倚分析。
并列第一作者:
邓绮玲,技师;宋迪,技师。
通信作者:
赵卫,博士,教授,南方医科大学公共卫生学院生物安全研究中心主任;吴小延,中山大学肿瘤防治中心主管技师。
作者贡献声明:
邓绮玲负责数据收集和分析并牵头撰写文章;宋迪负责查阅文献及分析、解释数据;奚可欣和谢晓婷负责论文数据的采集、统计;吴小延负责参与研究的设计、研究工作中的重要决策和研究结果的初步报告;赵卫负责课题监管与指导,提供科研经费,行政支持及材料支持和指导。
[参考文献]
[1] NIKITA SANDEEP WAGLE MBBS M, et al. Cancer statistics, 2023[J]. CA A Cancer J Clin, 2023, 73(1): 17-48.
[2] FILHO A M, LAVERSANNE M, FERLAY J, et al. The GLOBOCAN 2022 cancer estimates: data sources, methods, and a snapshot of the cancer burden worldwide[J]. Int J Cancer, 2025, 156(7): 1336-1346.
[3] 张景暄, 付庭吕, 李 宁, 等. 《肺癌的全球负担: 当前状态和未来趋势》要点解读[J]. 中国胸心血管外科临床杂志, 2024, 31(1): 17-23.
ZHANG J X, FU T L, LI N, et al. Interpretation of the global burden of lung cancer: current status and future trends[J]. Chin J Clin Thorac Cardiovasc Surg, 2024, 31(1): 17-23.
[4] RAHADIANI N, STEPHANIE M, MANATAR A F, et al. The diagnostic utility of cfDNA and ctDNA in liquid biopsies for gastrointestinal cancers over the last decade[J]. Oncol Res Treat, 2025, 48(3): 125-141.
[5] SON J W, LEE J, JEON J H, et al. Validation of IASLC 9th edition TNM classification for lung cancer: focus on N descriptor[J]. BMC Cancer, 2024, 24(1): 1460.
[6] 应 超, 蔡燕宁, 郝淑文, 等. 三种游离核酸提取试剂盒对血浆cfDNA提取性能的比较[J]. 实用医学杂志, 2023, 39(12): 1556-1563.
YING C, CAI Y N, HAO S W, et al. Performance comparison of three cell-free nucleic acid extraction kits for plasma cfDNA extraction[J]. J Pract Med, 2023, 39(12): 1556-1563.
[7] 李营歌, 董 熠, 余舒阳, 等. 《2023 CSCO非小细胞肺癌诊疗指南》罕见靶点诊疗更新[J]. 肿瘤防治研究, 2023, 50(12): 1232-1236.
LI Y G, DONG Y, YU S Y, et al. Diagnostic and therapeutic strategy updates of rare oncogenic mutations in Chinese Society of Clinical Oncology guidelines on diagnosis and treatment of non-small cell lung cancer (2023 edition)[J]. Cancer Res Prev Treat, 2023, 50(12): 1232-1236.
[8] CHANG Y S, TU S J, CHEN Y C, et al. Mutation profile of nonsmall cell lung cancer revealed by next generation sequencing[J]. Respir Res, 2021, 22(1): 3.
[9] 林艺聪, 王 悦, 薛倩倩, 等. EGFR T790M突变非小细胞肺癌患者的临床病理学、免疫微环境特征及对预后预测的意义[J]. 中国癌症杂志, 2024, 34(4): 368-379.
LIN Y C, WANG Y, XUE Q Q, et al. Clinical pathological characteristics and immune microenvironment significance of EGFR T790M mutation in non-small cell lung cancer patients and its prognostic implications[J]. China Oncol, 2024, 34(4): 368-379.
[10] SINGH V, KATIYAR A, MALIK P, et al. Identification of molecular biomarkers associated with non-small cell lung carcinoma (NSCLC) using whole-exome sequencing[J]. Cancer Biomark, 2024, 41(3/4): CBM-220211.
[11] AKIRA S, SHINGO M, HIBIKI U, et al. A large-scale prospective concordance study of plasma- and tissue-based next-generation targeted sequencing for advanced non-small cell lung cancer (LC-SCRUM-liquid)[J]. Clin Cancer Res Off J Am Assoc Cancer Res, 2022, 29(8): 1506-1514.
[12] LEE S B, KIM J W, KIM H G, et al. Longitudinal comparative analysis of circulating tumor DNA and matched tumor tissue DNA in patients with metastatic colorectal cancer receiving palliative first-line systemic anti-cancer therapy[J]. Cancer Res Treat, 2024, 56(4): 1171-1182.
[13] BAE J H, LIU R L, ROBERTS E, et al. Single duplex DNA sequencing with CODEC detects mutations with high sensitivity[J]. Nat Genet, 2023, 55(5): 871-879.
[14] WANG Z J, CHENG Y, AN T T, et al. Detection of EGFR mutations in plasma circulating tumor DNA as a selection criterion for first-line gefitinib treatment in patients with advanced lung adenocarcinoma (BENEFIT): a phase 2, singlearm, multicentre clinical trial[J]. Lancet Respir Med, 2018, 6(9): 681-690.
[15] WU X N, ZHAO J, YANG L, et al. Next-generation sequencing reveals age-dependent genetic underpinnings in lung adenocarcinoma[J]. J Cancer, 2022, 13(5): 1565-1572.
[16] PINHEIRO P S, CALLAHAN K E, MEDINA H N, et al. Lung cancer in never smokers: distinct population-based patterns by age, sex, and race/ethnicity[J]. Lung Cancer, 2022, 174: 50-56.
[17] MALHOTRA J, MUDDASANI R, FRICKE J, et al. Clinical utility of a circulating tumor cell-based cerebrospinal fluid assay in the diagnosis and molecular analysis of leptomeningeal disease in patients with advanced non-small cell lung cancer[J]. JCO Precis Oncol, 2024, 8: e2400373.
[18] GEORGE J, MAAS L, ABEDPOUR N, et al. Evolutionary trajectories of small cell lung cancer under therapy[J]. Nature, 2024, 627(8005): 880-889.
[19] AKIN D, KAHRAMAN ÇETI N N, ERDOĞDU İ H, et al. Clinicopathological significance of mutation profile detected by next generation sequencing in different metastatic organs of non-small cell lung cancers[J]. Pathol Res Pract, 2024, 260: 155463.
[20] MIYAUCHI E, MORITA S, NAKAMURA A, et al. Updated analysis of NEJ009: gefitinib-alone versus gefitinib plus chemotherapy for non-small cell lung cancer with mutated EGFR[J]. J Clin Oncol, 2022, 40(31): 3587-3592.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)