首页 > 医疗资讯/ 正文
【摘要】
目的 应用抗苗勒管激素(AMH)建立多囊卵巢综合征(PCOS)样小鼠模型。
方法 选取21日龄C57BL/6雌性小鼠按照随机原则分为4组:对照组:5只,不予处理;脱氢表雄酮(DHEA)组(阳性对照组):5只,予每日皮下注射DHEA(60 mg·kg-1·d-1)干预21 d;低剂量AMH组(L-AMH组):5只,每周予腹腔注射AMH(0.5 mg/kg)1次,持续4周;高剂量AMH组(H-AMH组):5只,每周予腹腔注射AMH(0.5 mg/kg)2次,持续4周。每周称量小鼠体重;DHEA组于造模的第4、5周进行阴道涂片;不同剂量AMH组于造模的第5、6周进行阴道涂片观察动情周期;ELISA法检测各组小鼠性激素水平;HE染色观察卵巢组织形态学改变。
结果 干预完毕后与其他组比较,DHEA组小鼠体重显著增高(P<0.01)。阴道涂片结果显示除对照组外,其他3组小鼠在造模结束后均出现动情周期停滞现象,DHEA组和H-AMH组主要表现为没有规律完整的动情周期。HE染色结果显示,DHEA组及H-AMH组小鼠卵巢组织明显呈多囊样改变。血清性激素水平检测结果显示,DHEA组及H-AMH组血清睾酮(T)、黄体生成素(LH)水平均显著高于对照组,而卵泡刺激素(FSH)、雌二醇(E2)水平均显著低于对照组(P均<0.05);与DHEA组比较,L-AMH与H-AMH组小鼠血清T、LH水平均显著降低,血清FSH、E2水平均显著升高(P均<0.05);与H-AMH组比较,L-AMH组小鼠血清T水平显著降低,血清FSH、E2水平均显著升高(P均<0.001)。
结论 与对照组比较,H-AMH组与DHEA组的模型小鼠所表现出的病理变化相似,均出现与PCOS患者相似的生殖和代谢异常改变。
多囊卵巢综合征(PCOS)是育龄期女性常见的生殖内分泌代谢性疾病,主要临床表现为月经稀发或闭经或不规则子宫出血。越来越多的研究表明,抗苗勒管激素(AMH)在PCOS病理机制中发挥着重要作用。已有研究通过对实验小鼠进行孕晚期腹腔注射AMH,成功诱导出PCOS样子代小鼠,进一步证明AMH在PCOS发病机制中起重要作用。PCOS病因及具体病理机制错综复杂,因此建立多种的、不同的有效PCOS生殖内分泌代谢紊乱动物模型对其发病机制探讨具有重要意义。本研究采用AMH对21日龄C57BL/6雌性小鼠进行干预,进而探讨更为理想的生殖内分泌异常的PCOS造模方法,便于对AMH在PCOS中的病理作用进行更为深入的研究。
材料与方法
一、实验材料
1.实验动物:21日龄健康清洁级C57BL/6雌性小鼠20只,体重13~15 g,来源于黑龙江中医药大学实验动物中心,于黑龙江中医药大学妇科实验室进行饲养,室内温度22~25℃,湿度45%~60%,12 h昼夜交替,予以充足的水和维持型饲料饲养,按时更换垫料,适应性饲养1周以备下一步建立模型。动物实验方案均符合《动物管理规则》及《实验动物护理和使用指南》,并经黑龙江中医药大学伦理委员会批准(编号:2023102601)进行所有动物处理和实验程序。
2.主要药物与试剂:AMH抗原(重组蛋白)(CSB-DP344B,武汉华美);脱氢表雄酮(DHEA)(CD4222,北京酷莱博快);磷酸盐平衡生理盐水(PBS)(P1020,北京索莱宝);苏木素-伊红染液(B1002,江苏艾迪生);芝麻油(上海源叶);舒泰(法国维克宠物保健公司);盐酸赛拉嗪注射液(吉林省华牧动物保健品有限公司);生理盐水(青岛海博);4%多聚甲醛通用型组织固定液(BL539A,北京兰杰柯);无水乙醇(10009218)、盐酸(10011018)、氨水(10002108)、中性树胶(10004160)、二甲苯(10023418)均购自国药集团化学试剂有限公司;雌二醇(E2)ELISA试剂盒(230866M)、黄体生成素(LH)ELISA试剂盒(230882M)、卵泡刺激素(FSH)ELISA试剂盒(230854M)、睾酮(T)ELISA试剂盒(230869M)均购自江苏酶免实业有限公司。
二、实验方法
1.动物分组及处理方法:将20只小鼠按照随机原则分为4组:对照组5只,阳性对照组(DHEA组)5只,低剂量AMH组(L-AMH组)5只,高剂量AMH组(H-AMH组)5只。对照组小鼠不予处理;DHEA组小鼠每日上午9点于颈部皮下注射DHEA(60 mg·kg-1·d-1溶于芝麻油中),持续3周;L-AMH组小鼠每周一上午9点腹腔注射AMH(0.5 mg/kg溶于PBS中)1次,持续4周,共注射4次;H-AMH组小鼠每隔3 d于上午9点腹腔注射AMH(0.5 mg/kg溶于PBS中)1次,持续4周,共注射8次。
2.体重、动情周期观察及判定:开始造模后,每周称量小鼠体重;DHEA组于第4、5周,不同剂量AMH组于第5、6周进行阴道涂片观察动情周期。具体操作步骤:婴儿棉签提前用生理盐水润湿,左手固定小鼠的身体,充分暴露出小鼠的阴道口,将湿润的棉签置于小鼠阴道口内旋转2圈沾取小鼠的阴道分泌物,将其均匀的涂抹在载玻片上,自然晾干后置于光学显微镜下观察,根据小鼠阴道脱落细胞的形态判断小鼠的动情周期阶段,并记录于表格中。
3.动物标本采集:模型构建的第6周结束时禁食禁水12 h,按照舒泰55 mg/kg、盐酸赛拉嗪注射液11.7 mg/kg配置麻药,腹腔注射,待小鼠麻醉后,剪取小鼠眼底静脉血置于干净的EP管中静置15~20 min,然后离心取血清。断颈处死小鼠后,暴露小鼠的两侧卵巢并小心取下,置于PBS中,将血液等杂质冲洗干净后拍照称重,随后将每组5个卵巢组织浸没于装有4%多聚甲醛溶液的冻存管中,充分固定后进行HE切片染色检测;剩余的卵巢组织放于空冻存管中。离心后取出的血清及卵巢组织先放于液氮中速冻后移至于-80℃冰箱冻存,以便用于后续相关实验检测。
4.卵巢组织学检查:卵巢组织置入4%多聚甲醛固定后常规脱水,石蜡包埋后切片,HE染色,中性树胶封片,显微镜下观察各组小鼠卵巢组织学变化。
5.血清性激素水平检测:根据检测试剂盒说明书检测小鼠血清中E2、LH、FSH及T水平。
三、统计学分析
使用SPSS 20.0统计软件进行数据分析。计量资料符合正态分布时,以均值±标准差()描述。多组数据比较如符合正态分布且方差齐,则采用单因素方差分析(one-way ANOVA),组间比较采用Tukey法;若符合正态分布但不具方差齐性,则采用Welch’s ANOVA法,多组间比较采用Games-Howell法。P<0.05为差异有统计学意义。
结 果
一、DHEA及不同剂量AMH诱导PCOS模型小鼠的体重变化
4组小鼠在开始注射即第0周时体重比较无统计学差异(P>0.05)。当各组小鼠干预2周、3周结束时,4组小鼠体重均有所增长,DHEA组的小鼠体重显著高于其他3组(P<0.01);当停止DHEA干预后,DHEA组小鼠体重在第4周、第5周及第6周仍具有增长的趋势,与其他3组小鼠体重比较具有显著性差异(P<0.01)。当L-AMH组与H-AMH组在AMH干预4周结束时,小鼠体重均有增长趋势,但与对照组比较均无统计学差异(P>0.05);当停止AMH干预后,L-AMH组与H-AMH组小鼠体重在第5周、第6周时与对照组比较仍均无统计学差异(P>0.05)(表1)。
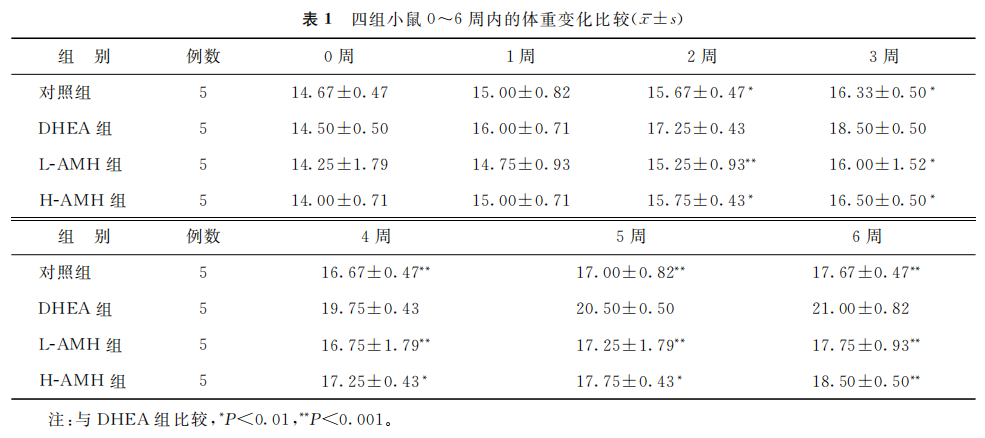
(表1)
二、DHEA及不同剂量AMH诱导PCOS模型小鼠动情周期变化
对照组小鼠经历了3个规律完整的动情周期循环,DHEA组小鼠产生动情周期停滞现象,主要表现为没有规律完整的动情周期,长时间停留在动情期或动情后期。L-AMH组和H-AMH组小鼠在造模结束后第5周开始出现动情周期停滞现象,停滞在动情期或动情后期,但L-AMH组在后期开始出现动情前期和动情间期,H-AMH组小鼠则表现为没有规律完整的动情周期,长时间停留在动情期或动情后期(图1)。
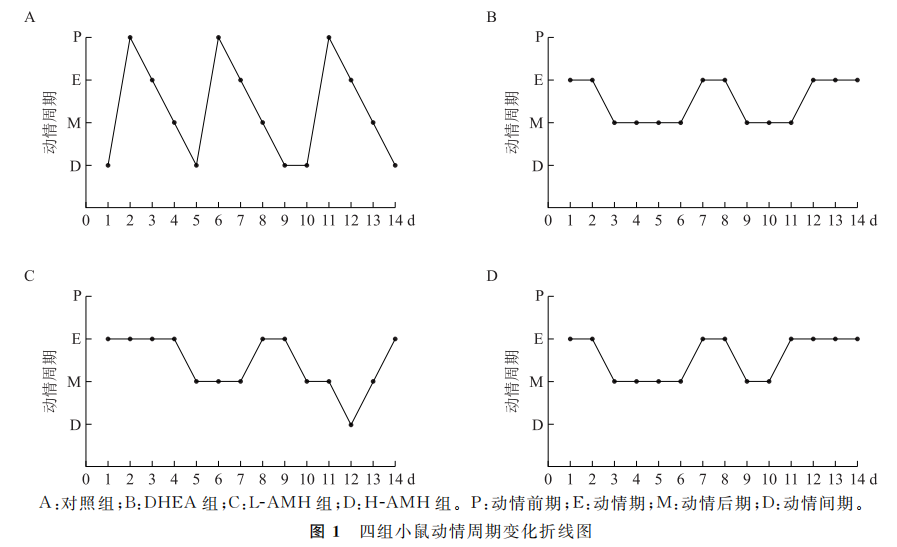
(图1)
三、4组小鼠卵巢组织形态学变化
对照组小鼠卵巢组织结构正常,视野内可见卵泡、黄体,形态完整,数量丰富,未见卵泡扩张,颗粒层细胞排列规则紧密;DHEA组小鼠卵巢组织明显呈多囊样改变,可见卵泡明显扩张,体积变大,颗粒细胞层数明显减少,排列疏松,未见黄体;L-AMH组小鼠卵巢组织内可见局部颗粒细胞层数减少,排列较疏松,视野内可见黄体数量减少;H-AMH组卵巢组织呈多囊样改变,视野内可见较多的早期发育的小卵泡、闭锁卵泡及扩张的囊状卵泡,体积变大,颗粒细胞层数明显减少,排列较疏松,黄体接近消失(图2)。

(图2)
四、4组小鼠性激素水平变化
与对照组比较,DHEA组和H-AMH组小鼠的血清T及LH水平均显著升高,血清E2、FSH水平均显著降低(P均<0.05);L-AMH组各指标与对照组比较均无统计学差异(P>0.05)。与DHEA组比较,L-AMH与H-AMH组小鼠的血清T及LH水平均显著降低,血清FSH、E2水平均显著升高(P均<0.05)。与H-AMH组比较,L-AMH组小鼠血清T水平显著降低,血清FSH、E2水平均显著升高(P均<0.001)(表2)。
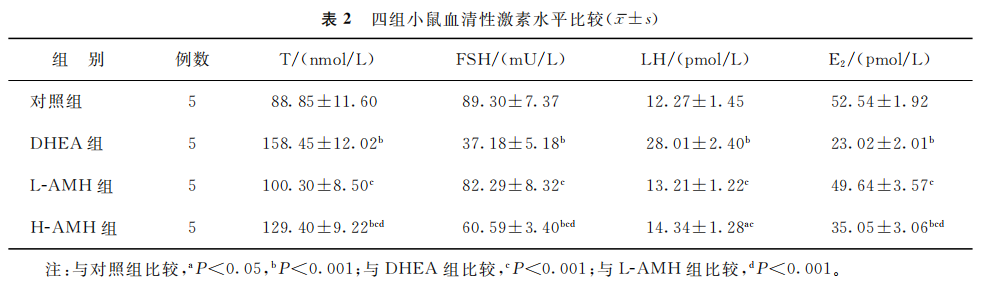
(表2)
讨 论
截至目前,PCOS的发病机制尚不完全清楚,其中高雄激素血症的致病机制理论占主导地位,其作用机制之一是异常升高的雄激素能够抑制卵泡成熟,生长中的卵泡不会成长为优势卵泡。在女性中,AMH抑制原始卵泡从静息卵母细胞库中募集,并可能抑制FSH作用,进而导致排卵障碍。AMH表达一直持续到卵泡直径达到约8 mm,并且在较大的窦卵泡中表达不足。因此,AMH与窦卵泡计数(AFC)之间存在良好的相关性。PCOS的主要病理特征之一是所有生长阶段的卵泡数量增加,其中主要为窦前卵泡和小窦卵泡,AMH由小窦卵泡直接产生,故PCOS患者其血清AMH水平均有不同程度的增加。目前,PCOS诊断标准之一的多囊卵巢形态逐渐存在争议,已有研究提议应用AMH替代AFC成为PCOS的诊断标志物。越来越多的研究认为,AMH在PCOS的发病机制中具有重要作用,因此本研究的主要目的是应用AMH诱导PCOS小鼠模型,以探究AMH在PCOS中的病理作用机制。
AMH属于转化生长因子-β(TGF-β)家族的一种同源二聚体糖蛋白,其基因于1986年在哺乳动物中首次测序和克隆。到目前为止,AMH已确定的主要分泌来源为出生后动物的睾丸支持细胞和卵巢颗粒细胞,且参与卵巢卵泡的生长发育,并在发育的不同阶段影响下丘脑-垂体-性腺轴。研究表明,PCOS女性中其AMH水平均显著高于对照组,其中肥胖组显著高于非肥胖组,高雄激素组显著高于非高雄激素组,胰岛素抵抗组显著高于非胰岛素抵抗组。国内研究表明,肥胖型PCOS不孕症患者其血清AMH、核因子-κB(NF-κB)、血清铁蛋白水平升高,脂联素水平降低,且与胰岛素抵抗和体外受精-胚胎移植(IVF-ET)助孕妊娠结局有关。此外,PCOS表型的严重程度与AMH相关,无排卵期PCOS患者的AMH水平高于排卵期PCOS患者。在自然高雄激素雌性恒河猴中,其血液循环中的AMH水平也明显更高,与PCOS女性临床表现特征相似。研究表明,通过构建PCOS大鼠模型,在一定时间内外源性DHEA可能会促进AMH mRNA表达,造成血液AMH水平升高,对AMHⅡ型受体(AMHR2)mRNA同时有抑制和促进作用,尤其对一种新的AMHR2剪接体(其命名为AMHR2-SV1)影响显著,研究者推断其可能与PCOS发生相关。有研究表明,妊娠期间相对高浓度的AMH本身可能就是PCOS产前编程的原因,暴露于过量的AMH中会导致母体神经内分泌驱动的雄激素分泌过量,进而改变胎儿编程,并导致后代出现一系列类似PCOS的生殖和神经内分泌特征。故AMH对于PCOS病因溯源及临床表型具有重要作用,本研究采用AMH进行动物造模实验,尝试应用最佳剂量及时间建立最佳PCOS-AMH模型,进而为下一步深入研究PCOS与AMH间的作用机制打下基础。
动物模型研究认为,动物实验模型成功的建立是前提,是下一步研究的基础,动物模型的建立对于整个研究具有重要意义,造模成功才能使研究结果具有可信性。目前,有关PCOS动物模型评价使用最多的是单纯阴道涂片,此方法简单易行,可帮助判断动物是否存在规律的性周期变化,是否处于无排卵状态。如果连续2个性周期阴道上皮细胞持续角化现象,并失去规律的动情周期即认为其无排卵;进一步应用生化指标及病理指标进行评价,评价方法包括检测性激素、生化指标及观察卵巢的镜下改变。本研究结果发现,应用DHEA与AMH干预小鼠均能改变其正常的动情周期,HE染色结果显示高剂量的AMH及DHEA干预后卵巢组织均成多囊样改变,性激素水平改变也趋于PCOS化。
目前,PCOS造模以大鼠品系应用最多,药品多采用雄激素及来曲唑构建模型,并且药物剂量及干预时长较统一稳定。应用雄激素及来曲唑造模的实验研究多联合高脂高糖饮食,研究重点均侧重PCOS的糖脂代谢方向。PCOS临床异质性较大,雄激素过多与糖脂代谢异常常互为因果,产生恶性循环,如何解析两者之间的病理作用机制成为PCOS病因溯源中的主要难点。国内有研究指出,PCOS患者血清AMH水平高于正常女性,其原因与高雄激素密切相关,但PCOS患者血清AMH水平与胰岛素抵抗无相关性,故寻找建立独立于性激素与糖脂代谢紊乱之间且确切有效的PCOS动物模型具有重要意义。AMH作为PCOS病理机制中的新兴研究热点,近年来在发病机制、诊断和治疗中均具有重大发现,如何从AMH出发探讨建立PCOS样动物模型尤为迫切,建立多样PCOS动物模型也能为后续研究提供更多思路。
综上所述,本研究应用AMH成功建立PCOS高AMH模型,能够为未来研究高AMH-PCOS病因病理机制溯源打下坚实基础。此外,本研究作为建立PCOS高AMH小鼠模型的实验研究,为PCOS和AMH间的关系研究提供了新的方向和靶标,但更深入的分子机制仍需进一步阐明。
文章来源:李婧,赵珊珊,孙畅,等.抗苗勒管激素诱导多囊卵巢综合征样小鼠表型[J].生殖医学杂志,2025,34(5):648-654.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)