首页 > 医疗资讯/ 正文

溶血葡萄球菌(Staphylococcus haemolyticus)是新生儿重症监护病房(NICU)中早产儿晚发型败血症(LOS)的重要病原体之一,其肠道定植被认为是感染的风险因素。为了深入理解溶血葡萄球菌在早产儿肠道中的多样性及其耐药性机制,本研究通过对英国四家医院22名早产儿的44份粪便样本进行全基因组测序,分析了140株溶血葡萄球菌的基因组特征,并结合126株公开基因组数据,揭示了其克隆传播、耐药基因分布及移动遗传元件的特征。
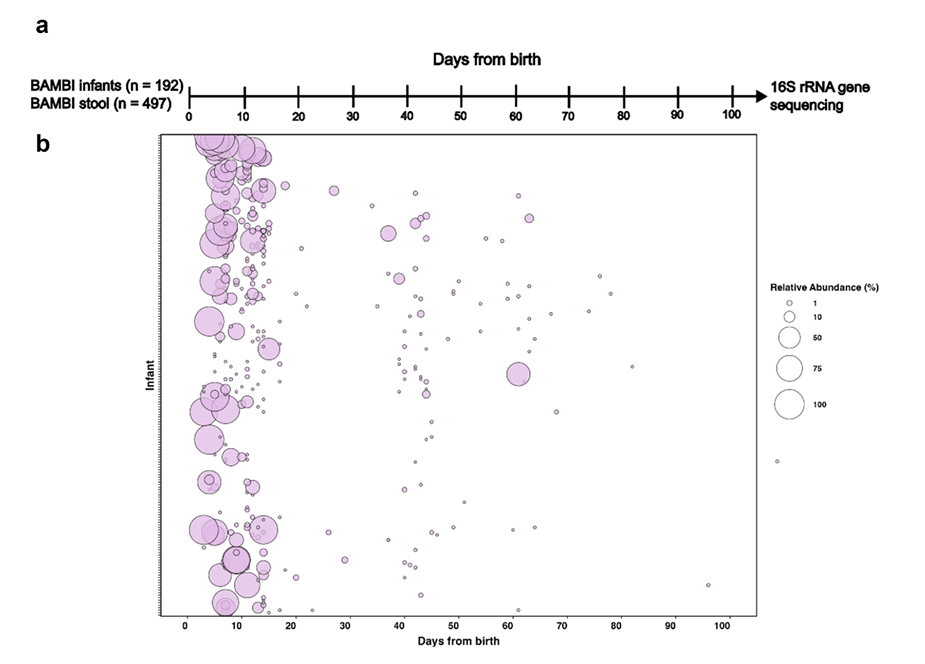
图:基于16S rRNA基因测序数据估计早产儿肠道中溶血葡萄球菌的丰度,气泡图显示192名早产儿的497份粪便样本中溶血葡萄球菌OTUs的相对丰度
研究团队首先通过16S rRNA基因测序数据重新评估了早产儿肠道中溶血葡萄球菌的丰度和流行率。结果显示,在出生后的前10天内,溶血葡萄球菌的丰度最高,随后随婴儿年龄增长逐渐下降。这一发现与其作为机会性病原体的特性相符,尤其在免疫系统未成熟的早产儿中更易定植。随后,通过全基因组测序和核心基因组系统发育分析,发现140株分离株中85株(60.1%)来自三个不同医院的早产儿,形成了一个克隆群(Cluster 1),其中78株(91.7%)属于多位点序列型ST49。这一克隆群的菌株核心基因组单核苷酸多态性(cgSNPs)差异较小(平均64.6个),表明其在医院环境中可能存在跨院传播。此外,研究还发现早产儿肠道中同时存在不同克隆株的情况,但占比仅为8.3%,进一步凸显了克隆群的主导地位。
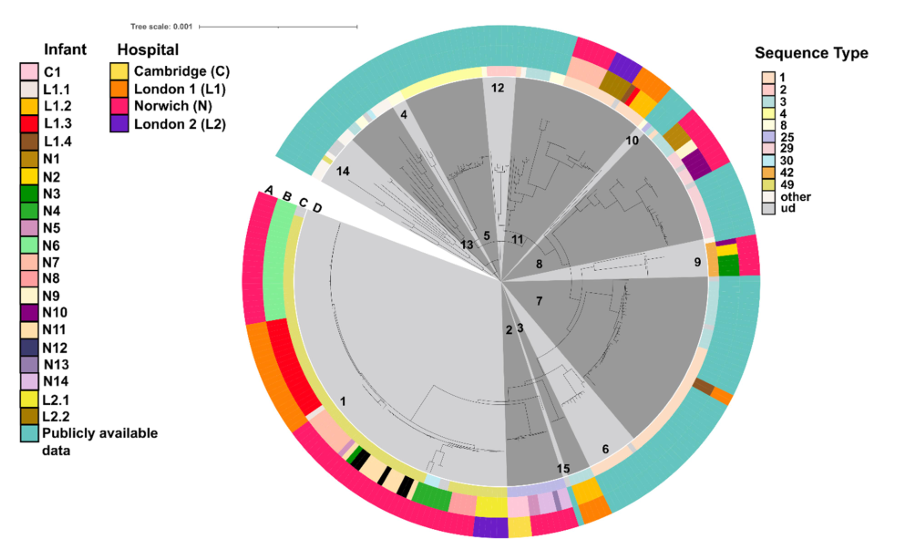
图:核心基因组系统发育树展示本研究分离株与公开菌株的亲缘关系,同心圆环显示分离株的医院来源、婴儿个体信息、MLST分型及fastbaps聚类结果
耐药基因分析显示,分离株中携带多种抗生素耐药基因(ARGs),其中β-内酰胺类耐药基因mecA和氨基糖苷类耐药基因aacA-aphD的携带率分别高达99.3%和99.3%。表型耐药性测试证实,mecA与苯唑西林耐药性显著相关(OR=158.00,p<0.0001),而aacA-aphD与庆大霉素耐药性高度相关(OR=162.00,p<0.001)。值得注意的是,尽管mecA广泛存在,但所有分离株均未携带完整的葡萄球菌染色体盒mec(SCCmec)元件,提示其耐药机制可能依赖于其他遗传背景。此外,研究还发现aacA-aphD基因位于转座子Tn4001上,该转座子可在染色体和质粒间移动,其中27.3%的菌株中Tn4001位于质粒上,且部分质粒(如pBAMBI1、pBAMBI2和pBAMBI4)具有可移动性,可能通过接合作用在不同菌株间传播耐药基因。
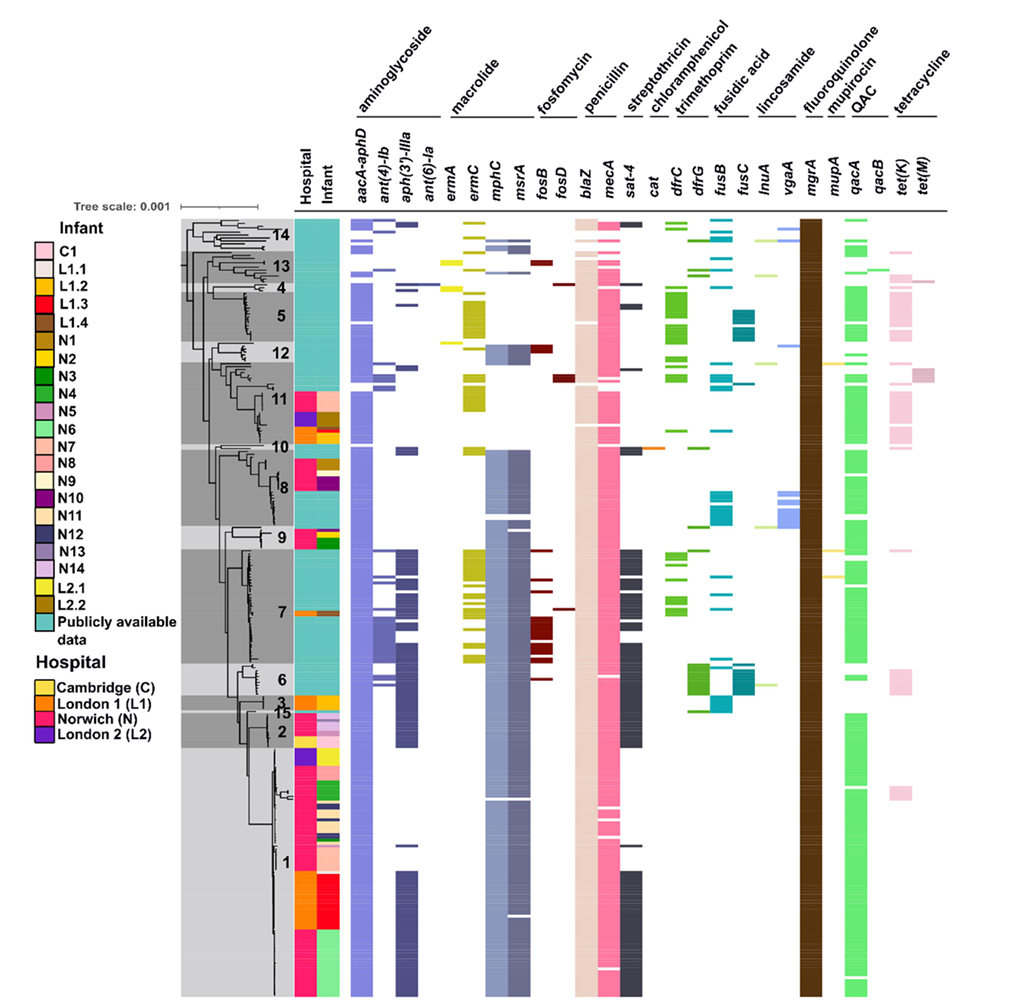
图:溶血葡萄球菌分离株的抗生素耐药基因谱,不同医院来源分离株中ARGs的分布及其关联的抗生素类别
研究还揭示了医院环境中消毒剂使用对耐药基因的选择压力。94.3%的分离株携带消毒剂耐受基因qacA,其与抗生素耐药基因的共选择可能进一步加剧了多重耐药菌株的流行。此外,ST49克隆株在全球范围内的广泛分布(包括动物宿主)提示其可能通过人畜传播链扩散,而其他常见序列型(如ST1和ST25)的临床分离株也表现出多重耐药特征,凸显了溶血葡萄球菌作为医院感染病原体的潜在威胁。
综上所述,本研究通过基因组学手段揭示了早产儿肠道中溶血葡萄球菌的克隆传播模式、耐药基因分布及其移动遗传机制。研究结果强调了医院环境中抗生素和消毒剂使用对耐药性进化的影响,并为早产儿感染的防控策略提供了重要依据。未来研究可进一步探索耐药基因的传播动力学及其对临床治疗的挑战。
原始出处:
Lamberte LE, Darby EM, Kiu R, et al. Staphylococcus haemolyticus is a reservoir of antibiotic resistance genes in the preterm infant gut. Gut Microbes. 2025;17(1):2519700. doi:10.1080/19490976.2025.2519700
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)