首页 > 医疗资讯/ 正文
J Hematol Oncol | 我国学者重大突破:双重 EZH1/2 抑制剂治疗复发/难治外周T细胞淋巴瘤(r/r PTCL),总体响应率高达 67.6%
来源 2025-06-23 12:12:13 医疗资讯【研究亮点】
- 首次系统评估了新型选择性双重EZH1/2抑制剂HH2853在复发/难治外周T细胞淋巴瘤(r/r PTCL)患者中的临床安全性和疗效。
- HH2853治疗显示总体反应率(ORR)高达67.6%,其中29.4%实现完全缓解,且中位反应持续时间长达14.8个月。
- 本药物安全耐受性良好,主要不良反应为可管理的骨髓抑制,对血液学毒性控制有效,未发现严重累及心脏等非血液学毒性。
一、研究核心内容概述
2025年,我国学者在Journal of Hematology & Oncology发表了题为“一项基于HH2853的双重EZH1/2抑制剂治疗复发或难治性外周T细胞淋巴瘤的多中心开放标签Ib期临床试验结果”的研究。研究对34名多线治疗后复发或难治PTCL患者给予不同剂量HH2853(300mg、400mg、600mg BID),综合评估其安全性、药代动力学及初步抗肿瘤疗效。结果显示,该药在400mg BID时安全性最佳,且实现了高达67.6%的总体响应率,反映出该策略的潜在临床益处,为PTCL这一预后较差的恶性肿瘤提供了新的治疗选择。

二、研究背景及临床困境
外周T细胞淋巴瘤(PTCL)是一类起源于成熟T淋巴细胞的异质性恶性肿瘤,主要包括PTCL未分类(PTCL-NOS)、间变性大细胞淋巴瘤(ALCL)、血管免疫母细胞性T细胞淋巴瘤(AITL)等亚型。尽管传统化疗方案如CHOP及其类似方案为一线标准,但PTCL患者预后依旧严峻,尤其是复发及难治型患者的中位总生存期(OS)仅约6个月。近年来,JAK/STAT通路抑制剂、HDAC抑制剂及免疫疗法等新兴治疗手段不断涌现,但其临床有效率仍有限,亟需创新靶向策略。
作为组蛋白甲基转移酶,EZH2在Polycomb抑制复合体2(PRC2)中催化组蛋白H3K27三甲基化(H3K27me3),参与转录沉默调控。EZH2的异常过表达是多种肿瘤包括PTCL的致病关键驱动之一。目前FDA批准的EZH2抑制剂如tazemetostat主要针对EZH2单一靶点,但EZH1的补偿性作用限制了其疗效发挥。因此,靶向EZH1和EZH2的双抑制剂成为PTCL等恶性肿瘤的潜在突破口,前瞻性临床试验的开展正当其时。
三、研究方法简述
本研究为多中心、开放标签、单臂Ib期临床试验,招募符合条件的复发或难治性PTCL患者共34例,涉及15家中国顶尖医院。采用3+3剂量递增设计,口服给予HH2853 300mg、400mg、600mg BID三个剂量水平特别观察剂量限制毒性(DLT),继而选择推荐II期剂量(RP2D)进入剂量扩展阶段,进一步验证381例患者在该剂量水平的安全和疗效。治疗周期为28天,直至不可耐受毒性、疾病进展或患者自主撤出。主要疗效终点为ORR,安全性采用CTCAE 5.0标准评估。还开展了药代动力学和药效学分析,测定血浆内HH2853浓度及细胞内H3K27me3水平变化。
四、研究结果
1. 患者基本特征
纳入的34名患者中,44.1%为AITL,32.4%为PTCL-NOS,8.8%为ALK阴性ALCL,其他亚型较少。男性占73.5%,中位年龄58岁,既往系统治疗线数中位为2(范围1-5),76.5%为难治患者。治疗前多接受CHOP/CHOP-like方案,38.2%使用过HDAC抑制剂chidamide。患者详细基线特征见表1。
表1. 患者人口学及基线特征
2. 安全性评估
- 剂量限制毒性(DLT):300mg及400mg组未观察DLT,600mg组1例(33.3%)发生4级血小板减少症。因而400mg BID被确认为II期推荐剂量。
- 治疗相关不良事件(TRAEs):92.1%患者发生,主要为骨髓抑制(贫血67.6%、血小板减少52.9%、白细胞减少44.1%),非血液学事件以腹泻(38.2%)最常见。20.6%出现3级以上血小板减少。
- 剂量调整及停药:52.9%患者因TEAEs停药暂缓,41.2%为治疗相关。仅1例(2.9%)因TEAE永久停药导致患者死亡(合并症复杂)。大多数不良事件可逆且可控。
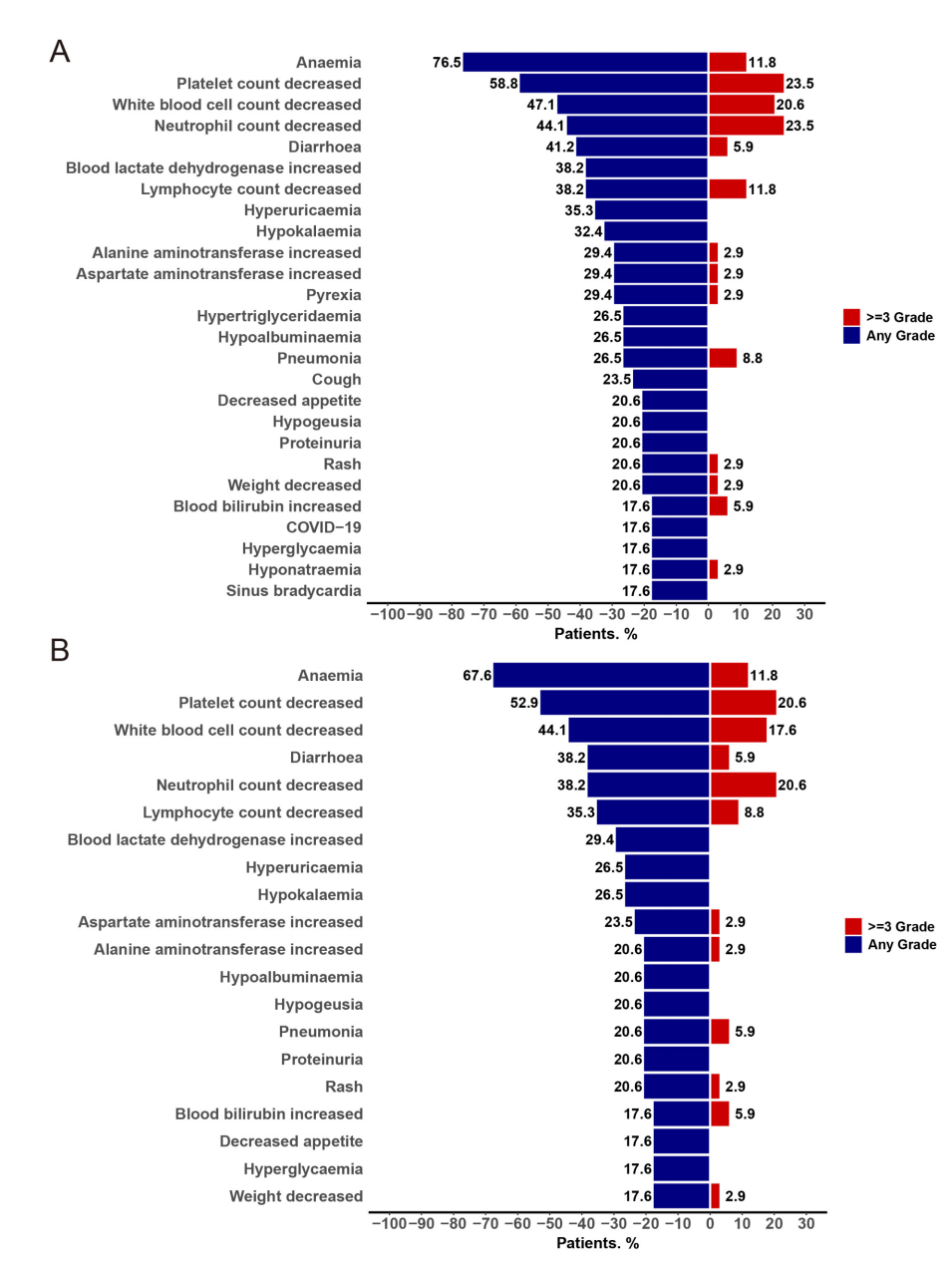
图:TEAEs及TRAEs发生率情况
3. 疗效表现
- 总体反应率(ORR)为67.6%,其中完全缓解(CR)29.4%,部分缓解(PR)38.2%。疾病控制率(DCR)达到73.5%。
- 不同剂量组ORR相似,分别为300mg 66.7%、400mg 68.8%及600mg 66.7%。
- 中位反应维持时间(DoR)14.8个月,中位进展无进展生存期(PFS)6.3个月,中位总生存期尚未达到。
- 特别地,AITL患者ORR高达86.7%,显示对该亚型敏感性更佳。针对既往接受过chidamide等新药患者,HH2853依然展现61.9% ORR,提示耐药后适应证前景广阔。
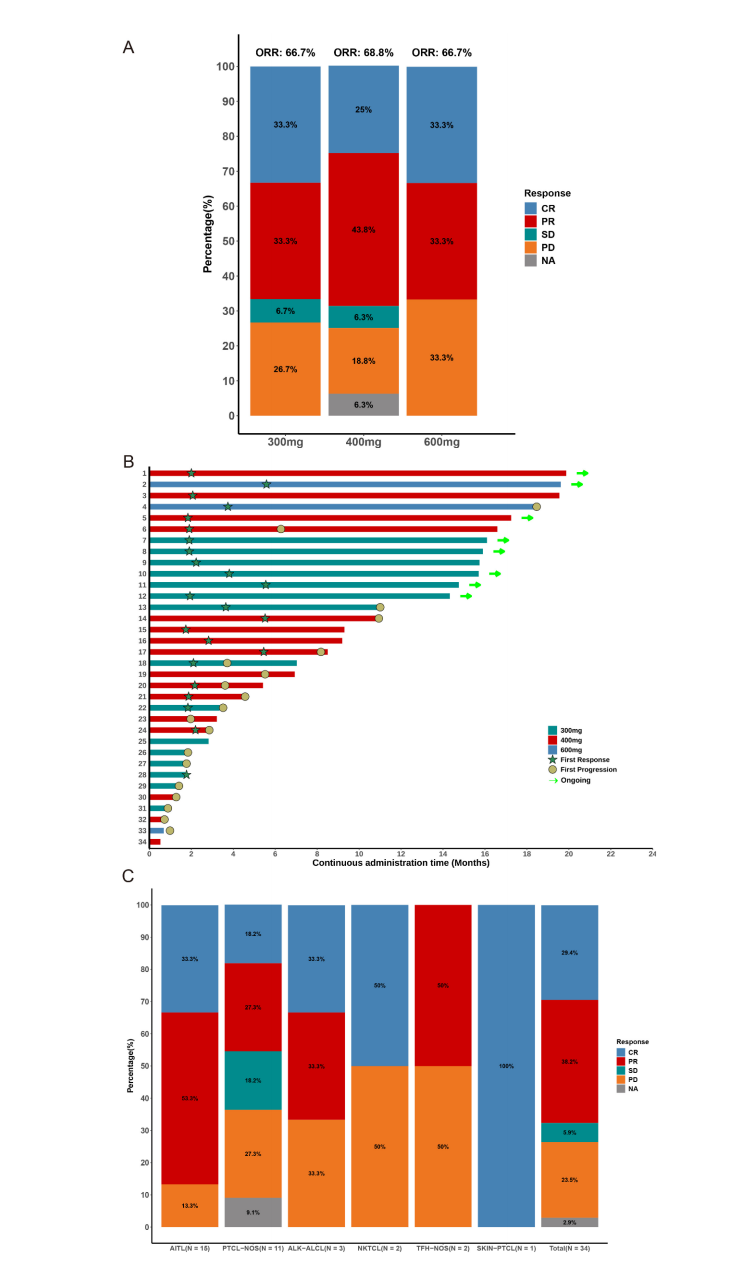
图: HH2853治疗患者最佳反应及治疗持续时间
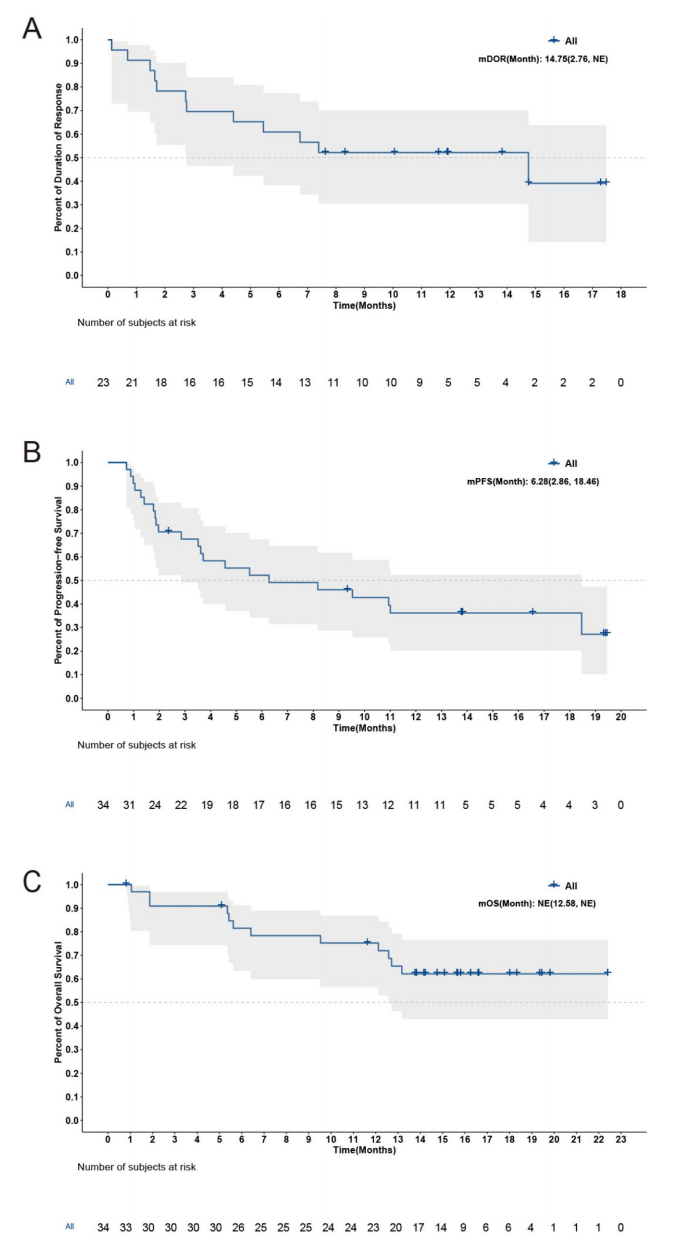
图: 响应者及全部患者的生存统计曲线
4. 药代动力学与药效学
- HH2853口服后迅速吸收,Tmax约为2小时,Cmax与AUC随剂量增加呈一定增加趋势,显现轻微积累。
- 药效学分析显示H3K27me3组蛋白修饰在治疗后明显降低,明确药物作用机理,与参照EZH1/2抑制目标一致。
- 药代及药效指标详见图4。
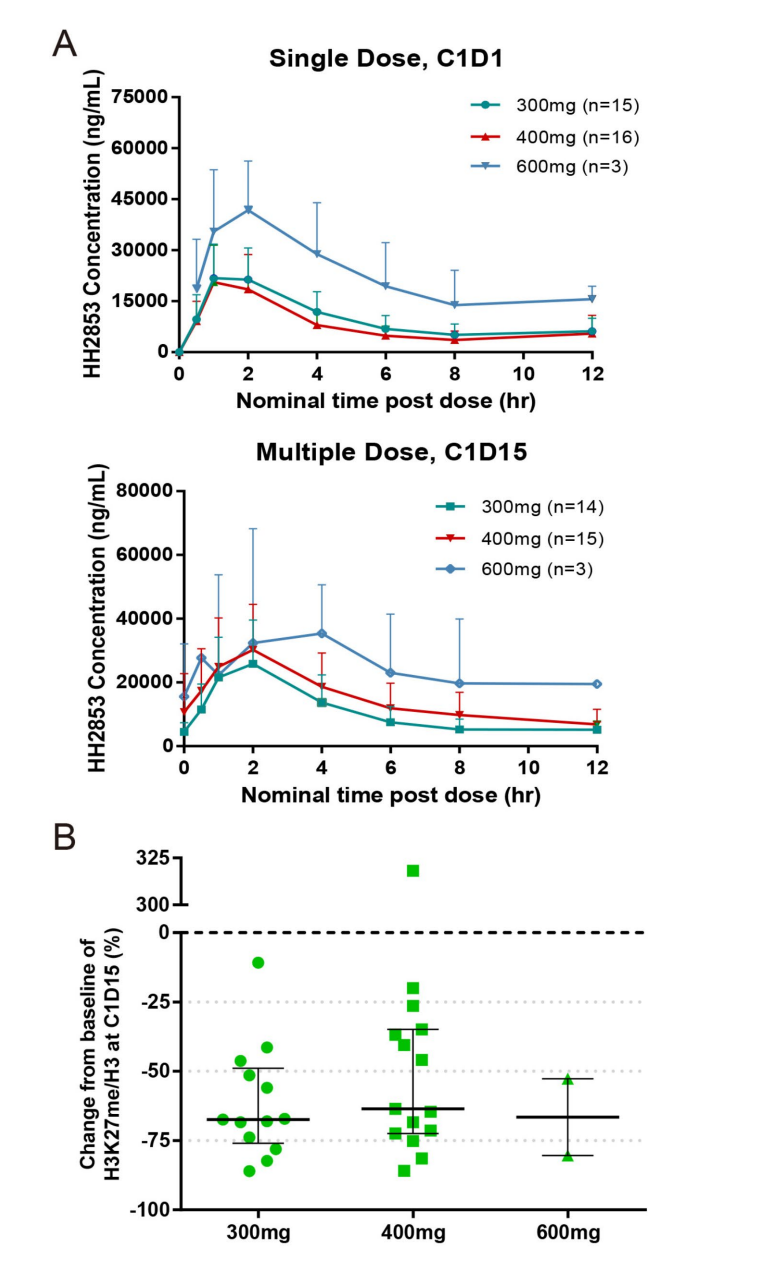
图: HH2853血浆浓度及H3K27me3抑制动态
五、讨论:研究价值与临床意义
本研究首次全面揭示了新一代双重EZH1/2抑制剂HH2853在r/r PTCL患者中的良好耐受性和卓越抗肿瘤活性。当前针对PTCL的治疗选择仍极为有限,FDA批准的单靶点抑制剂和免疫治疗等均未能实现满意疗效,特别是对于难治复发患者,临床需求迫切。HH2853以其优越的双靶点机制克服了EZH2单靶点抑制可能被EZH1功能补偿的障碍,有望成为这一领域的创新疗法。
此外,HH2853在AITL亚型患者中显示出更高的响应率,提示该亚型可能对EZH1/2通路依赖更强,为精准治疗提供方向。药理学指标均显示HH2853能有效抑制PRC2介导的表观遗传甲基化改变,支持其临床前景。
虽然本研究为早期临床探讨,但其内涵价值巨大。未来有望与免疫检查点抑制剂、HDAC抑制剂等联合使用,尝试激活免疫监视及增强抗肿瘤效应。此外,扩大样本人群进行随机对照研究,将更充分评估HH2853的长期安全性及疗效,促进其临床应用转化。
原始出处
Hong M, Chen Z, Zhang M, et al. A multicenter, open-label, single-arm, phase Ib clinical trial of HH2853 treatment in patients with relapsed and/or refractory peripheral T-cell lymphoma. Journal of Hematology & Oncology. 2025;18(50). https://doi.org/10.1186/s13045-025-01697-z
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)