首页 > 医疗资讯/ 正文
残留的癌干细胞样细胞(CSCs)可导致最初肿瘤切除病灶周围狭窄范围内的肿瘤复发,增加术后复发和不可治愈的风险。目前,还没有追踪和根除干细胞的有效策略。
2025年6月16日,新加坡国立大学陈小元、国家纳米中心杨延莲共同通讯在Nature Nanotechnology在线发表题为“A nanovaccine targeting cancer stem cells and bulk cancer cells for postoperative cancer immunotherapy”的研究论文,该研究提出了一种称为NICER的纳米疫苗策略,该策略基于一种纳米囊泡系统,该系统将CSC特异性抗原展示和表观遗传纳米调控剂封装与树突细胞靶向适体整合在一起,以同时根除CSC和大量肿瘤细胞。
具体来说,来源于醛脱氢酶过度表达肿瘤的纳米囊泡可以作为携带CSC特异性抗原和肿瘤相关抗原的整合抗原。靶向YTH N6-甲基腺苷RNA结合蛋白1的表观遗传纳米调控剂可以限制树突状细胞溶酶体蛋白酶活性,以调节整合抗原通过主要组织相容性复合体I类进行免疫反应的有效交叉呈递。

尽管实施了各种治疗,但由于术后复发和转移,侵袭性实体恶性肿瘤患者的治疗效果有限。自我更新的肿瘤干细胞样细胞(CSCs)是肿瘤块中肿瘤细胞的一个亚群,被认为是癌症发生和发展的基础,因此是介导癌症进展和复发的关键因素。与分化的癌细胞不同,由于其静止的细胞周期状态,CSC通常对常规治疗方法有抵抗力。因此,追踪和根除手术后残留的肿瘤干细胞对于预防肿瘤复发至关重要,然而开发有效的策略仍然极具挑战性。
癌症疫苗旨在激活具有高度特异性和最小副作用的特异性免疫反应7,8。针对大块肿瘤细胞上抗原的常规肿瘤疫苗可以有效地诱导肿瘤缩小,但通常不能抑制导致肿瘤复发的残余肿瘤干细胞。因此,非常需要开发靶向或抑制CSC的疫苗。大多数CSC靶向疫苗是基于用CSC裂解物脉冲的树突状细胞(DCs)激活免疫反应。然而,它们的临床疗效受到患者特异性CSC数量不足和复杂的CSC分离程序的限制。
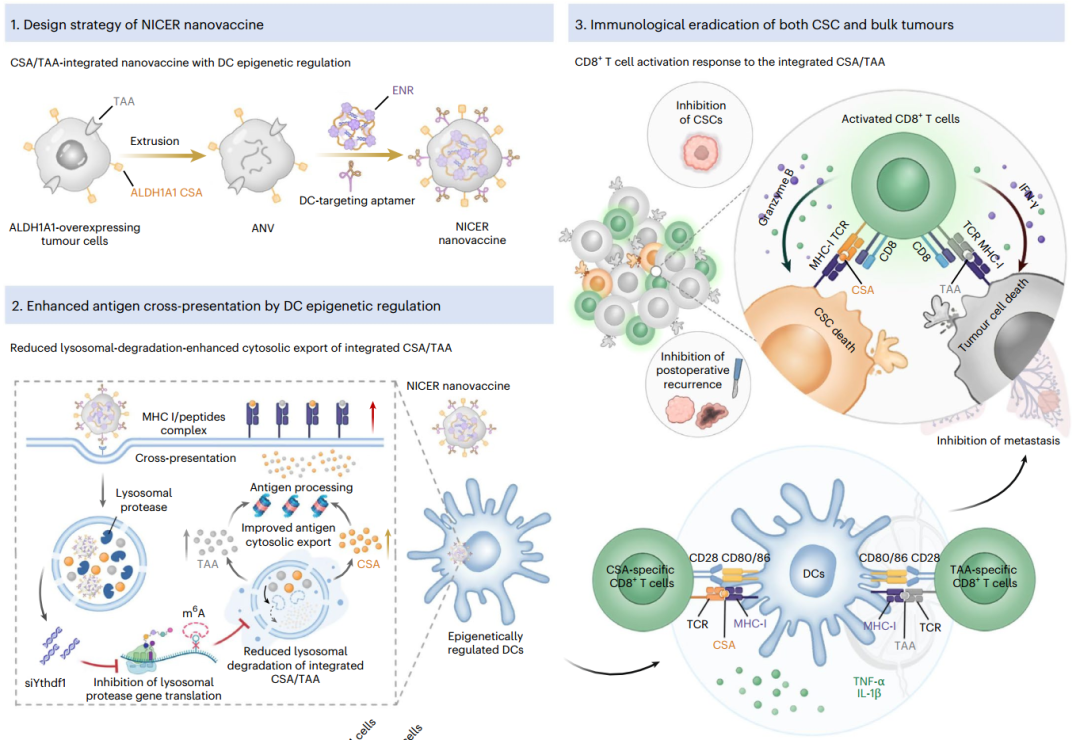
CSA/TAA整合的NICER纳米疫苗示意图(图源自Nature Nanotechnology )
为了克服这些障碍,研究人员试图利用不同类型肿瘤共有的CSC特异性抗原(CsA ),而不是整个CSC抗原库。清除细胞内醛的乙醛脱氢酶(ALDH)是一种广泛用于分离20多种癌症类型中的干细胞的生物标志物。在其同功酶中,ALDH1A1在各种癌症的CSC中普遍存在,特别是乳腺癌和黑色素瘤,并在肿瘤血管生成和进展中发挥关键作用,使其成为有前途的CSA。
在这里,研究人员设计了一种具有DC表观遗传调控(NICER)的TAA/CSA整合型纳米疫苗,通过过表达ALDH1A1的肿瘤纳米囊泡包裹ENR来诱导针对ALDHhigh CSCs和分化的肿瘤细胞的免疫反应。这种简单的疫苗策略克服了传统纳米疫苗在抑制CSC介导的复发和转移方面的局限性,以及单一CSA疫苗消除整个肿瘤的失败。因此,更好的表观遗传学抑制DC溶酶体蛋白酶,并增强整合的CSAs/TAAs的胞质输出以进行有效的交叉呈递,并在4T1肿瘤和黑色素瘤模型中激发针对CSCs和大块肿瘤的放大的免疫反应,表明其作为广谱治疗方法的潜力。使用高侵袭性富含CSC的肿瘤模型,证实了CSC是术后复发和转移的原因,这可以被NICER有效抑制。总的来说,NICER代表了一种针对CSCs和大块肿瘤的广谱疫苗方法,可以显著抑制术后癌症复发和转移,延长生存率。
参考信息:
https://www.nature.com/articles/s41565-025-01952-x#Sec22
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)