首页 > 医疗资讯/ 正文
年龄相关性黄斑变性(AMD)是老年人失明的主要原因,其特征是视网膜色素上皮(RPE)退化,可能发展为脉络膜新生血管(CNV),导致严重和快速的视力丧失。阻止这一进展可能有助于保住视力,但具体机制仍不明确。
2025年6月10日,南京医科大学陈雪,刘庆淮和上海交通大学Biao Yan共同通讯在PNAS在线发表题为“Feedback regulation between histone lactylation and ALKBH3-mediated glycolysis regulates age-related macular degeneration pathology”的研究论文。该研究通过使用临床AMD样本和基因敲除小鼠,我们报告了m1A去甲基化酶ALKBH3如何通过重塑视网膜代谢促进这一进展。
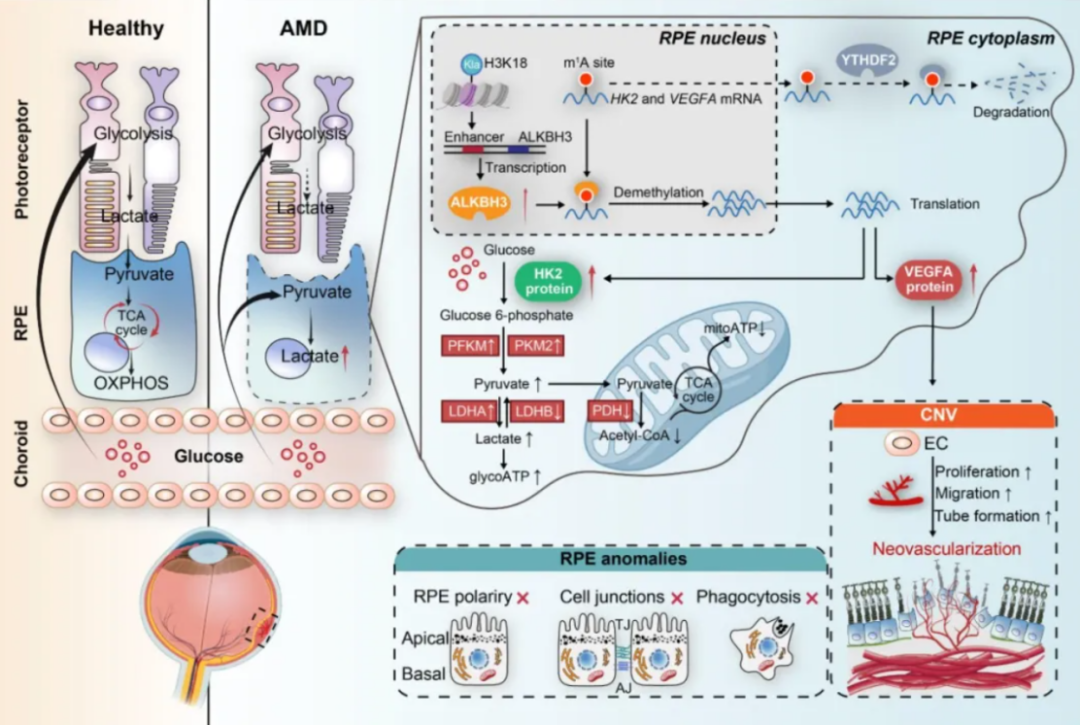
在RPE中,dm1ACRISPR系统表明,ALKBH3去甲基化限速糖酵解酶HK2,激活糖酵解,导致乳酸过量产生。此乳酸促进了H3K18位点的组蛋白乳酸化,而乳酸化的H3K18进一步与ALKBH3结合,放大其转录,形成正反馈回路。ALKBH3抑制剂HUHS015能够破坏这一回路,有效缓解RPE退化。此外,ALKBH3直接靶向促血管生成因子VEGFA,调节RPE与脉络膜毛细血管之间的代谢交叉信号,从而促进CNV。HUHS015与抗VEGF药物Aflibercept联合作用,共同抑制了CNV的形成。总体而言,我们的研究为年龄相关性视网膜疾病中RPE退化到CNV进展的分子机制和代谢事件提供了关键见解,为新的治疗方法奠定了基础。
衰老是一个逐渐发生且不可避免的过程,表现为所有器官的生理功能下降。随着全球人口老龄化,年龄相关疾病已成为致残和死亡的主要原因。其中,年龄相关性黄斑变性(AMD)是老年人视力丧失的主要原因,严重影响健康和经济。AMD主要影响黄斑,这是一块位于中央视网膜的狭小而特化的区域,负责锐利视觉。早期AMD涉及位于视网膜外层的视网膜色素上皮(RPE)细胞的退行性改变,这些细胞支持视网膜的神经元,尤其是感光细胞。随着AMD的进展,RPE及其支持的神经元退化,导致视力逐步下降,这即为干性AMD。约10%的患者可能发展为脉络膜新生血管形成(CNV),即湿性AMD,可引起严重视力损伤。阻断早期AMD向湿性AMD的转变有望预防严重视力丧失,但该转化机制尚不明确。尽管目前无治愈方法,抗血管内皮生长因子(VEGF)治疗可延缓CNV进展,但尚无针对RPE病变的有效治疗,成为现代医学的一大挑战。阐明RPE退化及其向CNV进展的分子事件将为AMD治疗提供新思路。
多种因素导致RPE功能障碍和AMD发生,其中代谢失调尤为重要。RPE与感光细胞之间的正常代谢互作对于视网膜及整个视觉系统的健康至关重要。葡萄糖代谢是将葡萄糖转化为三磷酸腺苷(ATP)的过程,是视网膜高代谢需求细胞的能量来源。生理条件下,RPE从脉络膜吸收并运输葡萄糖至感光细胞以维持其功能和存活。反过来,感光细胞将其产生的乳酸转运回RPE细胞,协助ATP的生成。葡萄糖代谢异常与多种年龄相关疾病相关,因此成为潜在治疗方向。然而,关于衰老RPE中葡萄糖代谢的研究结果存在分歧,一些研究发现糖酵解减弱,另一些观察到向有氧糖酵解转变,亟需进一步探讨。
模式机理图(图片源自PNAS )
N1-甲基腺苷(m1A)修饰是一种RNA的转录后修饰,指在RNA分子中腺嘌呤碱基的N1位置添加甲基。该修饰普遍存在于转运RNA(tRNA)、核糖体RNA(rRNA)和信使RNA(mRNA)中,调节其功能、稳定性和代谢。m1A修饰已在多种疾病中被研究,特别是神经系统疾病。此修饰由特异性酶调控,包括“写入者”(甲基转移酶)、“擦除者”(去甲基酶)和“读取者”(结合蛋白)。ALKBH3是一个m1A去甲基酶,参与多种生物学和病理过程(13)。其功能失调影响RNA完整性和蛋白质合成,导致年龄相关神经退行性疾病。尽管已发现ALKBH3影响RPE纤毛形成,但其在AMD中的作用尚不明确,需进一步研究。
本研究阐明了ALKBH3对AMD视网膜代谢的影响,分析了其调控网络,并强调其治疗潜力。我们检测到AMD患者及模型RPE中ALKBH3表达升高。ALKBH3异常激活RPE糖酵解,扰乱其功能,并调控RPE与血管内皮细胞的信号传导,促进血管生成。小鼠RPE中过表达Alkbh3导致视力受损、RPE异常和CNV进展;而敲除Alkbh3抑制了RPE糖酵解及CNV。机制上,ALKBH3通过影响HK2和VEGFA mRNA的稳定性,以m1A依赖方式调控其表达,YTHDF2作为m1A修饰的读取蛋白参与其中。利用dm1A CRISPR系统靶向去除HK2和VEGFA mRNA中的m1A位点可增强RPE糖酵解。ALKBH3在AMD中上调由组蛋白乳酸化修饰H3K18驱动,形成正反馈环路。此外,ALKBH3抑制剂HUHS015可抑制缺氧诱导的RPE异常,并联合Aflibercept协同抑制CNV。
本研究对于理解导致RPE退化及AMD中CNV形成的分子和代谢机制具有重要意义,为AMD治疗开辟新途径。
原文链接:
https://doi.org/10.1073/pnas.2416046122
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)