首页 > 医疗资讯/ 正文
Highlight
- 本研究首次系统证实,Roux-en-Y胃旁路(RYGB)手术后肠道葡萄糖排泄显著增强,且与术后血糖水平负相关。
- 研究揭示,绕过段(Biliopancreatic Limb, BPL)长度影响RYGB后肠道葡萄糖排泄,长BPL组表现出更佳的血糖控制。
- 通过无菌小鼠粪菌移植证实,肠道菌群的手术诱导变化是促进肠道葡萄糖排泄和改善糖代谢的直接因果因素。
研究核心内容概述
肥胖相关的2型糖尿病(T2DM)患者中,Roux-en-Y胃旁路(RYGB)手术已被证实显著改善血糖控制,且部分作用独立于体重减轻。近期发现术后肠道葡萄糖摄取和排泄增加,可能为影响血糖的重要新机制。但肠道葡萄糖排泄对术后葡萄糖代谢改善的具体贡献及其调控机制尚不清楚。来自中国重庆大坪医院军医大学等机构的Zhigang Ke等人发表在《Gut Microbes》2025年第17卷的最新研究,系统探讨了RYGB术后肠道葡萄糖排泄的变化、生理意义、影响因素(如绕过段长度)及其与肠道菌群的关联。该研究结合临床患者长期随访、动物模型肠道葡萄糖动态监测、PET/CT成像以及无菌动物粪菌移植,深入揭示了肠道菌群介导的葡萄糖排泄促进术后血糖代谢改善的新机制,提示肠道葡萄糖排泄可能成为未来T2DM微生态治疗的新靶点。
研究背景与现状
2型糖尿病是一种基于胰岛素抵抗与β细胞功能障碍的慢性代谢疾病,严重威胁公共健康。虽然各类药物不断开发升级,但代谢手术—特别是RYGB—仍是当前最有效的治疗手段之一,被广泛应用于肥胖合并糖尿病的患者。然而,RYGB术后血糖改善的机理复杂且尚未完全阐明。其中,体重减轻虽是重要因素,但近年的证据表明体重独立机制亦发挥核心作用,例如胰岛素分泌增强、β细胞功能改善、肠促胰素分泌改变、胆汁酸代谢重塑以及肠-胰腺-脑轴信号调控。同时术后肠道结构重塑导致葡萄糖代谢改变,例如肠道葡萄糖摄取增强,被认为对葡萄糖稳态改善具有积极作用。不过,更为新奇的是,肠道摄入的葡萄糖不仅代谢利用,还能以“逆向”形式排泄入肠腔,尚属新发现,这一现象的机制、功能及其调控因素尚待详细研究。此外,RYGB对肠段长度的重塑(主要是AL、BPL和CL三段)长短差异,可能因影响酸碱度、通透性与胆汁成分,调控肠道葡萄糖的吸收与排泄,进而影响血糖控制,但这些肠段长度的影响机制尚缺乏机制性研究。从肠道微生态视角看,RYGB显著重塑肠道菌群,既可能影响营养物质消化吸收,也会产生多种代谢信号调节宿主能量平衡与胰岛素敏感性。已有证据表明肠道菌群改变可以部分复制RYGB的代谢益处,但其是否具体介导肠道葡萄糖排泄仍不明确。基于此,本研究聚焦RYGB术后肠道葡萄糖排泄,从人体与动物实验结合的多层面视角,挖掘BPL长度与肠道菌群介导的代谢调节新机制。
研究方法学概述
本研究综合采用临床患者长期随访数据、动物实验模型及分子影像学技术。纳入92例接受RYGB治疗的T2DM患者,分组分析体重减轻幅度与BPL长度对术后血糖的影响。动物实验使用饮食诱导肥胖(DIO)大鼠及正常小鼠模型,结合RYGB或假手术,采用18F-FDG PET/CT动态监测肠道葡萄糖摄取与排泄。运用组织冲洗技术收集肠道内容物定量分析葡萄糖排泄。利用无菌(GF)小鼠粪菌移植技术,评估RYGB后肠道菌群变化对葡萄糖排泄及代谢的因果作用,辅以肠道菌群谱系测序(16S rDNA及宏基因组)。临床随访含体重、血糖、糖化血红蛋白(HbA1c)及糖耐量等指标。数据统计采用多因素相关与回归分析。
研究结果
1. RYGB术后血糖降幅独立于体重减轻程度
92例患者随访最高达48个月,术后体重及空腹血糖(FPG)、糖化血红蛋白均显著下降(表1)。分组依据一周年体重下降20%分界线,结果显示两组患者术后血糖改善幅度无显著差异,糖耐量显著提升,糖尿病缓解率在12至48个月保持稳定且无跨组差异,提示RYGB改善糖代谢可能涉及体重独立机制。
表1. RYGB术后48个月体重及血糖控制指标变化(均值±SD)
*与基线相比,p<0.05(ANOVA)
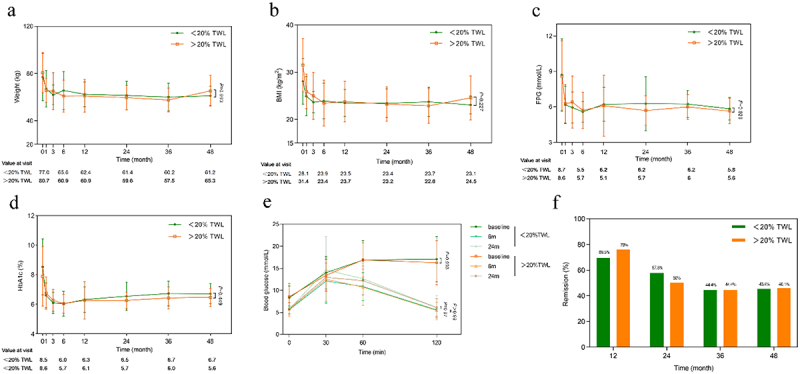
图1标题:不同体重减轻组中糖尿病缓解率及血糖控制指标随访动态
2. RYGB后肠道葡萄糖摄取与排泄显著升高,负相关于血糖水平
动物模型PET/CT成像显示RBGY术后第5周,小鼠和大鼠的肠道(含肠壁及肠腔内容物)FDG摄取显著升高,同时收集肠腔内容物定量显示小肠和结肠葡萄糖排泄明显上升。肠道内容物葡萄糖排泄量与术后空腹血糖呈显著负相关。此外,少量正常饮食软饮组动物也观察到肠糖排泄的存在,提示其为生理现象而非病理状态。人群中一例RYGB患者PET/CT也显示乙状结肠显著FDG摄取聚集,佐证动物数据。
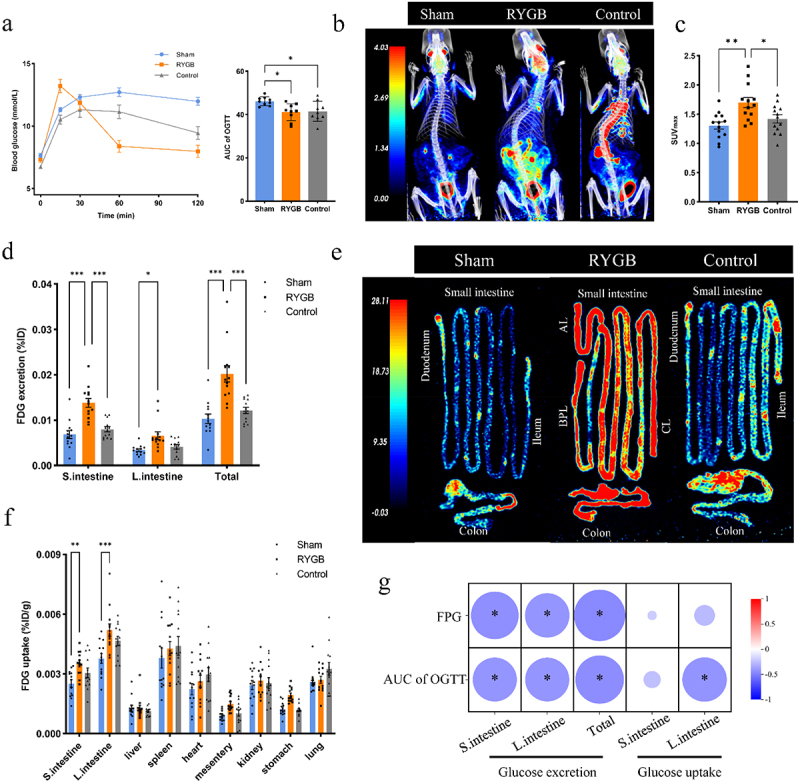
图2标题:RYGB术后动物肠道葡萄糖摄取和排泄定量及其与血糖的相关性
3. 绕过段(BPL)长度影响肠道葡萄糖排泄及血糖改善
动物实验中较长BPL组DIO大鼠术后体重下降更显著,血糖控制优于短BPL组,同时长BPL组肠道FDG摄取及葡萄糖排泄显著高于短BPL组。人体临床研究也显示长BPL患者空腹血糖改善优于短BPL组。BPL长度与葡萄糖排泄及糖耐量测试指标呈明显相关,提示BPL长度通过调节肠道葡萄糖排泄影响血糖控制。
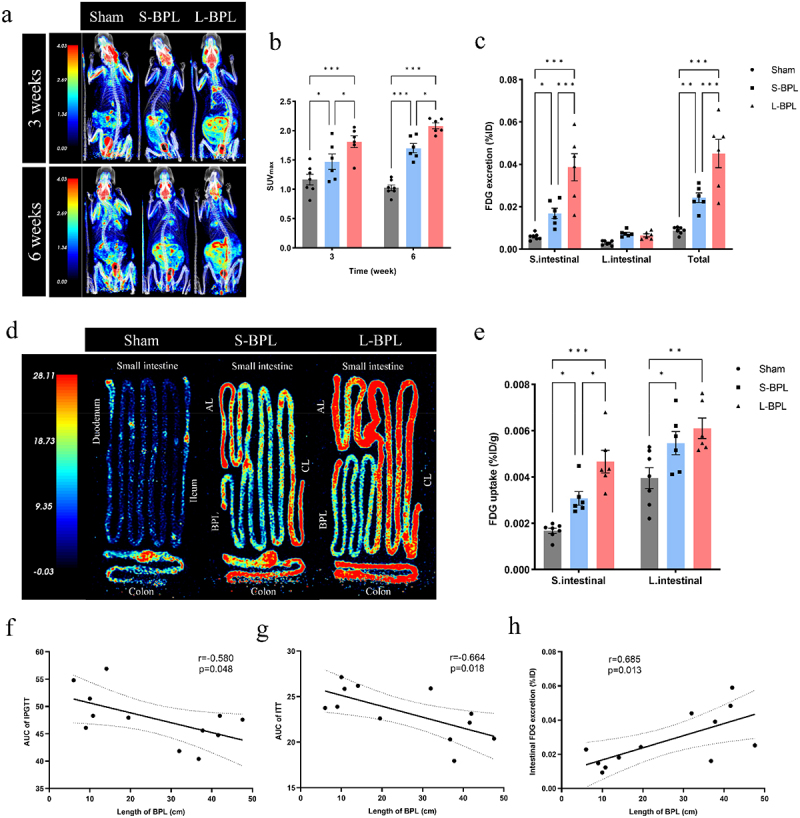
图3标题:不同BPL长度RYGB术后肠道葡萄糖摄取排泄及代谢指标对比
4. 肠道葡萄糖排泄为维持葡萄糖稳态的重要机制,与肠道菌群密切相关
糖尿病模型(db/db)及HFD诱导肥胖SPF小鼠肠道葡萄糖排泄较低,表现出糖代谢障碍;GF小鼠即使高脂饮食下仍维持较高肠道葡萄糖排泄及较佳葡萄糖耐量,展示菌群缺失缓解部分肥胖代谢异常。肠道葡萄糖排泄与OGTT及ITT曲线AUC均呈显著负相关。
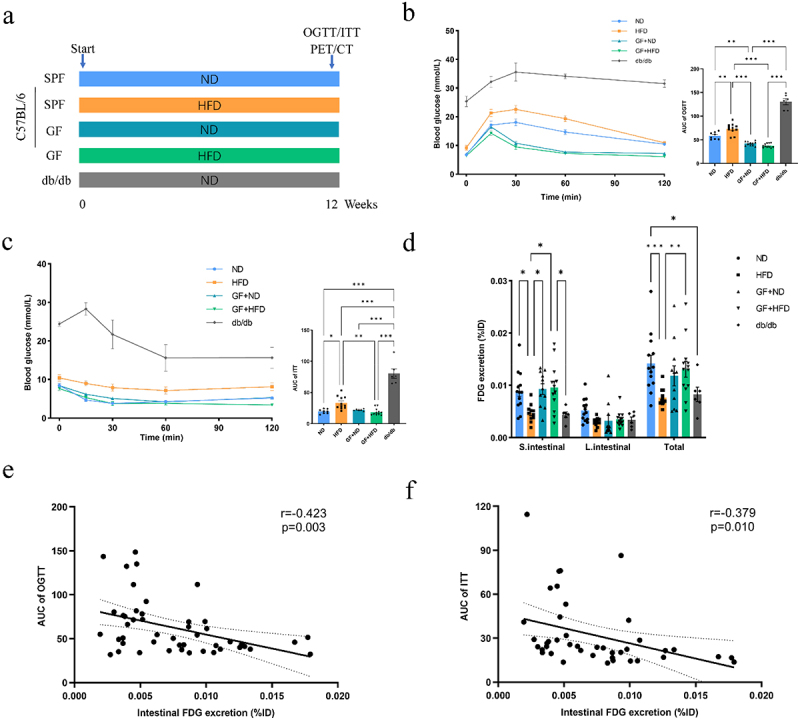
图4标题:不同菌群状态动物模型肠道葡萄糖排泄与糖代谢功能关系
5. RYGB诱导肠道菌群显著改变且粪便菌种移植重现肠道葡萄糖排泄增强及代谢改善
16S测序显示RYGB大鼠肠道菌群丰度多样明显与假手术组分开,特定菌群如Escherichia-Shigella、Streptococcus显著增多。GF小鼠移植RYGB鼠或患者粪菌后,同样出现肠道葡萄糖排泄增强及糖耐量改善,肠道菌群结构局部再现供体特征。提示菌群变化为RYGB促肠道葡萄糖排泄及血糖控制的重要介导因子。
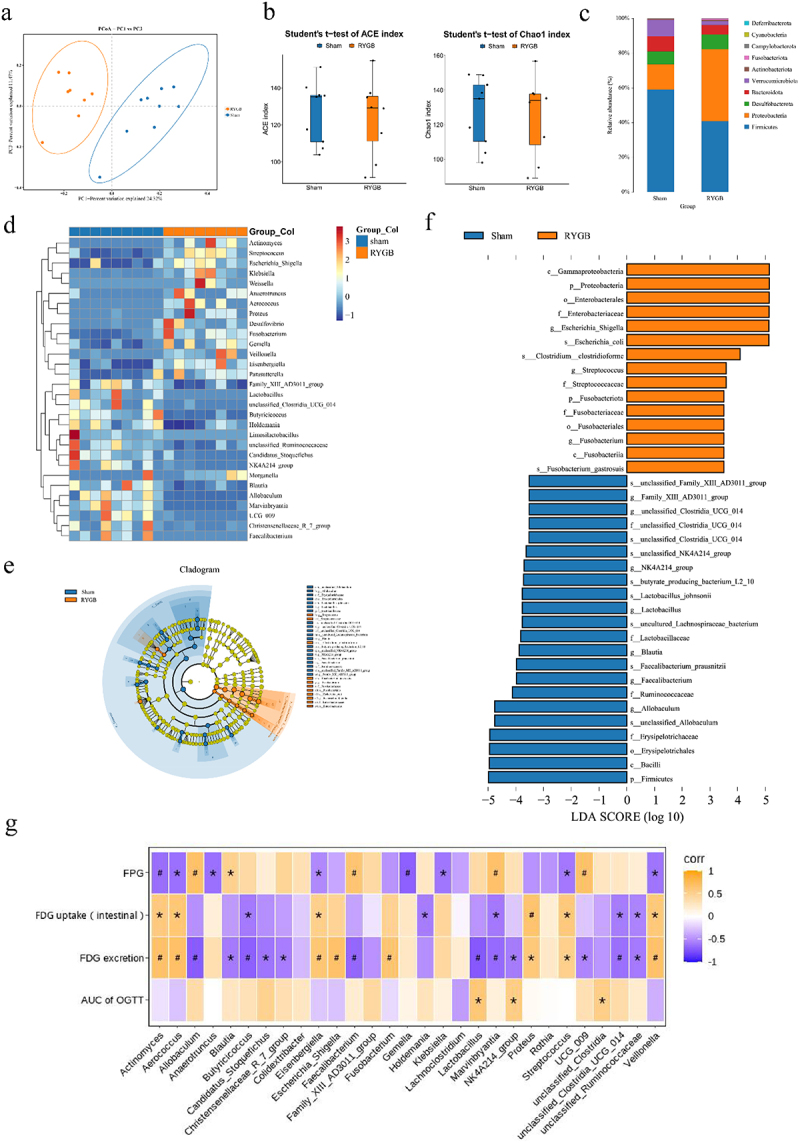
图5标题:RYGB术后肠道菌群组成变化
研究价值与意义
本研究提供了一种RYGB手术促进肠道葡萄糖排泄、进而改善糖代谢的全新机制视角,填补了体重独立代谢改善机制中的关键知识空白。首次明确了绕过段长度作为影响肠道葡萄糖排泄与血糖改善的结构参数,为临床术式优化提供理论依据。尤其通过无菌小鼠粪菌移植证实肠道菌群变化在此过程中起直接决定性作用,提示肠道微生态成为调控葡萄糖稳态的潜在靶点。此发现为未来开发基于肠道菌群或靶向提升肠道葡萄糖排泄的新型糖尿病治疗策略提供了方向,同时启示胃旁路术后胃肠重构对能量代谢影响的微妙机制,有望改善个体化手术方案设计与术后管理。
梅斯编辑点评
这项多学科联合的转化医学研究不仅系统揭示了RYGB术后肠道葡萄糖排泄及其菌群调控机制,且巧妙结合临床数据、动物模型与无菌动物粪菌移植,因果明确,数据充实。未来可进一步挖掘RYGB术后肠道葡萄糖转运蛋白(特别是GLUT家族)的菌群调控机制,筛选关键功能菌种及其代谢产物,丰富机制网络。同时,探索此机制对其他代谢手术或药物(如格列美脲、二甲双胍等)的通用性,将有助于深化糖尿病微生态精准治疗策略。值得注意的是,本研究也为评估肠道葡萄糖排泄作为临床血糖控制标志物提供了新想法,有望推动临床代谢疾病诊疗范式的革新。
参考文献
1. Mingrone G, et al. Metabolic surgery versus conventional medical therapy in patients with type 2 diabetes: 10-year follow-up of an open-label, single-centre, randomized controlled trial. Lancet. 2021;397(10271):293–304.
2. Kwon IG, et al. Serum glucose excretion after Roux-en-Y gastric bypass: a potential target for diabetes treatment. Gut. 2021;70(10):1847–1856.
3. Münzker J, et al. Functional changes of the gastric bypass microbiota reactivate thermogenic adipose tissue and systemic glucose control via intestinal FXR-TGR5 crosstalk in diet-induced obesity. Microbiome. 2022;10(1):96.
4. Debédat J, et al. The human gut microbiota contributes to type-2 diabetes non-resolution 5-years after Roux-en-Y gastric bypass. Gut Microbes. 2022;14(1):2050635.
原始出处:Ke et al., Gut Microbes, 2025, Vol. 17, No. 1, Article 2473519. DOI:10.1080/19490976.2025.2473519
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)