首页 > 医疗资讯/ 正文
甲状腺癌的流行病学与筛查
甲状腺癌(Thyroid Cancer,TC)是内分泌系统和头颈部最常见的恶性肿瘤。过去30年中,全球范围内甲状腺癌发病率大幅增加,成为十大恶性肿瘤之一。世界卫生组织国际癌症研究机构发布的全球185个国家最新癌症负担数据显示,2020年全球新发甲状腺癌58.6万例,位列第九位,其中女性44.9万例,位列第五位。我国甲状腺癌同样增长迅速,2003~2012年期间平均每年增长20.4%;国家癌症中心发布2022年中国恶性肿瘤负担数据显示,甲状腺癌发病率位列男性恶性肿瘤的第七位,女性恶性肿瘤的第三位。欧美发达国家的甲状腺癌5年生存率为98.6%,而我国甲状腺癌年龄标准化的5年相对生存率为92.6%,仍有一定的提升空间。
一、流行病学
甲状腺癌起源于甲状腺滤泡上皮细胞或滤泡旁细胞(又称C细胞)。滤泡细胞源性甲状腺癌包括乳头状癌(Papillary thyroid carcinoma,PTC,占所有甲状腺癌的80%~85%)、滤泡状癌(Follicular thyroid carcinoma,FTC,10%~15%)、嗜酸细胞癌(0ncocytic carcinoma,OCA),低分化癌(Poorly differentiated thyroid carcinoma,PDTC)和未分化癌(Anaplastic thyroid carcinoma,ATC,<2%),前两种类型又称为分化型甲状腺癌(Differentiated thyroid carcinoma,DTC)。滤泡旁细胞源性甲状腺癌即甲状腺髓样癌(Medullary thyroid carcinoma,MTC),约占甲状腺癌的1%~5%。
近年来,全球范围内甲状腺癌发病率大幅增加,主要归结于PTC的增加。我国甲状腺癌同样增长迅速,2022年我国甲状腺癌发病率位居所有恶性肿瘤的第3位,居女性肿瘤的第3位,男性肿瘤的第7位。国内流行病学特征主要包括:PTC占比最大,城市发病率显著高于农村,东部地区发病率高于中西部。
造成甲状腺癌发病率上升的主要原因之一是高分辨率超声和细针穿刺检查(Fine needle aspiration biopsy,FNAB)的广泛应用以及人们对健康体检的重视,使更多较小的、低风险的PTC被确诊。但也有研究表明,所有大小和所有年龄组的甲状腺癌绝对发病率都在增加,所以这一流行病学现象不能仅仅归结于诊断强度的增加,而是检查和筛查增多及其他尚未明确的因素综合作用的结果。
尽管甲状腺癌发病率增加,但它导致的死亡率几乎在全球所有地区都相对稳定在较低水平。2020年全球甲状腺癌年龄标准化死亡率男性为0.3/10万,女性为0.5/10万。美国甲状腺癌基于发病率的死亡率从2000年的0.42/10万(95% CI:0.34~0.51)增加到2018年的0.50/10万(95% CI:0.43~0.58),其中PTC和ATC的死亡率增加,PTC中伴有远处转移和肿瘤直径>2.1cm的死亡率增加,但FTC或MTC的死亡率无增加。据报道,欧洲男性与女性甲状腺癌的死亡率分别为0.5/10万和0.7/10万,随时间和地区的变化很小。2022年中国甲状腺癌的年龄标准化死亡率为0.45/10万(男性:0.35/10万,女性:0.55/10万)。中国甲状腺癌的长期生存率得到显著改善,来自17个癌症登记处的数据显示甲状腺癌年龄标准化的5年相对生存率从2003~2005年的67.5%上升至2012~2015年的84.3%,2019~2021年进一步提升至92.6%,但仍低于一些发达国家的水平。
部分甲状腺癌的发生与遗传相关。5%~10%的DTC有家族遗传性,可作为家族性肿瘤综合征的组成部分,也可为非综合征型(家族性非髓样甲状腺癌),罹患病例的一级亲属DTC患病风险明显增加。约25%的MTC是遗传性,由胚系转染重排(Rearranged during transfection,RET)基因变异导致,是2型多发性内分泌腺瘤病(Multiple endocrine neoplasia,type 2,MEN 2)的表现之一。
环境和饮食因素方面,童年期电离辐射暴露是目前唯一确认的DTC环境风险因素。切尔诺贝利核事故致使污染地区儿童和青少年甲状腺癌的发病率显著增加,儿童期恶性肿瘤接受放疗的幸存者甲状腺癌发病风险增高均证实这一点,然而电离辐射的暴露与成人甲状腺癌的关系并不明确。近年来多个荟萃分析显示肥胖可能是甲状腺癌的风险因素。一项纳入524万例样本的大规模人群研究显示,高体重指数(Body mass in-dex,BMI)与10种常见癌症的发病风险增加有关,其中甲状腺癌的风险约增加9%。碘缺乏和碘过量都可引起甲状腺疾病,缺碘会增加辐射诱发甲状腺癌的风险,但目前无证据表明碘摄入过量与甲状腺癌发病风险的增加有关,也无证据表明食盐加碘与甲状腺癌高发的现象有关联。海水鱼与贝壳类食物,未增加甲状腺癌的患病风险,在缺碘地区反而具有保护作用。十字花科蔬菜摄入与甲状腺癌无明显关系。
二、甲状腺癌的筛查
国际卫生组织针对肿瘤的筛查计划常基于以下证据:①证明患者确实有风险;②证明筛查可在早期阶段发现疾病;③早期诊断对后续预后有影响,包括复发和生存。尽管利用高分辨超声结合FNAB技术可早期发现甲状腺癌,但目前无证据表明对无症状人群行甲状腺癌筛查有明确获益。
目前我国相关部门并无甲状腺癌的筛查计划,但一些体检中甲状腺超声是可选择项目。在我国甲状腺癌长期生存率同发达国家尚存一定差距以及肿瘤防治提倡“早发现、早诊断、早治疗”为基本策略的背景下,有必要积极开展相关研究,制定适合我国国情的甲状腺癌筛查方案。
对甲状腺癌高风险人群(如童年期有辐射暴露史、前述某些遗传综合征病史者及其一级亲属、MEN2患者及其一级亲属、携带胚系RET基因变异的MTC患者的一级亲属等),应行甲状腺癌筛查。
甲状腺癌的诊断
一、临床表现
大多数甲状腺癌患者无明显临床症状。部分患者由于肿瘤压迫周围组织,出现声音嘶哑、压迫感、呼吸/吞咽困难等症状。合并甲状腺功能异常时可出现甲状腺功能亢进或甲状腺功能减退的临床表现。部分患者可因颈部淋巴结肿大就诊。若肿瘤压迫颈交感神经节,可产生Horner氏综合征。
MTC由于肿瘤可产生降钙素(Calcitonin,CTn)和5-羟色胺,可引起腹泻、心悸、面色潮红等症状,可合并出现多发性内分泌腺瘤病2型(MEN2型)、家族性多发性息肉病及某些甲状腺癌综合征。
ATC常表现为多种症状同时或交错出现,或以消化、呼吸系统的某一症状为突出表现,时常伴有声音嘶哑、进行性呼吸和/或吞咽困难、颈部疼痛等症状,颈前常可触及边界不清、活动度差或相对固定的质硬肿物,且发展迅速。
二、影像学诊断
1、超声检查
高分辨率超声检查是评估甲状腺癌的首选方法。超声检查操作简便、无创且廉价,是甲状腺最常用且首选的影像学检查方法,建议所有临床触诊或机会性查等方式发现甲状腺结节的患者均进行颈部高分辨率超声检查。
甲状腺癌的超声征象包括:①实性低回声或极低回声;②结节边缘不规则;③弥散分布或簇状分布的微钙化点状强回声;④垂直位生长;⑤甲状腺外浸润;⑥同时伴有颈部淋巴结超声影像异常,如淋巴结呈高回声,内部出现微钙化、囊性变、异常血流、形态呈圆形、淋巴门消失、皮髓质分界不清等。通过超声检查鉴别甲状腺结节良恶性的能力与超声医师的临床经验相关。
近年来,甲状腺弹性成像和超声造影技术在评估甲状腺结节中的应用日益增多,超声弹性成像可额外评估病变及周围组织的硬度;超声造影能实时评估病灶的血流动力学及血流灌注模式。这两种技术均弥补了传统超声的不足,作为辅助诊断的工具,并已被广泛应用于临床实践中。
2、其他影像学检查在评估甲状腺癌中的作用
在甲状腺癌原发灶定性方面,CT和MRI检查并不优于超声,但对特殊区域,如上纵隔等,还需借助CT和/或MRI检查,二者可评估肿瘤的病变范围及与周围重要结构如喉、气管、食管、颈动脉的关系,对术前制定手术方案及预测术中可能发生的损伤有重要意义。在淋巴结转移评估方面,尤其是中央区或上纵隔淋巴结转移,CT不受气管和食管内气体的干扰,不受胸骨遮挡,较超声更具优势,推荐使用平扫+增强的动脉期25~30s扫描方案对淋巴结性质进行鉴别,典型转移淋巴结的CT征象包括:①最大短轴直径≥10.0mm;②圆形或不规则形状;③边缘不规则、边界不清或侵入邻近组织;④钙化、囊性变和/或坏死性改变;⑤明显增强(强化程度与咽黏膜相似或高于咽黏膜,或强化程度高于周围带状肌);⑥不均匀增强。由于MRI检查存在自身局限性,如对微钙化不敏感、对患者配合度要求高、幽闭恐惧症和心脏起搏器安装术后患者禁忌等,价格较高也是不可忽视的问题,故MRI在评估颈部淋巴结转移方面的使用较少,价值有限,多用于有CT检查禁忌患者的颈部淋巴结术前评估对复发转移性MTC,可用增强CT或MRI了解肿瘤与周围组织的关系,了解肺、骨肝、脑等远处器官的转移情况,必要时可加做18F-FDG PET/CT(Fluorine-18-fluoro-deoxyglucose positron emission tomography)更全面了解全身肿瘤负荷等。单纯依靠18F-FDG PET显像不能准确鉴别甲状腺结节的良恶性。
三、实验室诊断
术前可行甲状腺功能、甲状腺球蛋白(Thyroglobulin,Tg)及抗甲状腺球蛋白抗体(Thyroglobulin antibody,TgAb)检测,作为动态监测的基线评估,但不推荐促甲状腺激素(Thyroid stimulating hormone,TSH)和Tg用于甲状腺肿瘤良恶性的鉴别诊断。
多项前瞻性非随机研究表明常规血清Ctn筛查可发现早期的C细胞增生和MTC,从而提高MTC的检出率及总体生存率(Overall Survival,Os)。美国甲状腺协会(American Thyroid Association,ATA)对Ctn筛查持中立态度,但仍然认可Ctn筛查在部分亚组患者中有重要价值。国内专家共识建议对怀恶性甲状腺肿瘤,术前应常规行Ctn检测,Ctn升高或考虑MTC的患者还应检测癌胚抗原(CEA)。值得注意的是,目前主动监测(Active surveillance,As)对低危甲状腺微小结节不失为合适的管理方法,但由于无法获取患者的细胞病理学信息,在仅凭超声影像提供肿物大小情况下,不能确定患者是否为MTC。研究显示,甲状腺微小MTC的预后与常规MTC相似。因此,向患者给出AS建议之前,应检测血清Ctn水平,以除外甲状腺微小MTC可能。
MTC患者的肿瘤负荷与血清Ctn水平常呈正相关。术前血清Ctn值可有效辅助判断淋巴结转移范围,当血清Ctn值分别>20pg/ml、50pg/ml、200pg/ml、500pg/ml时一般代表可疑淋巴结转移至同侧中央区和同侧颈侧区、对侧中央区、对侧颈侧区以及上纵隔区。当术后Ctn≥150pg/ml时,应高度怀疑病情有进展或复发。但值得注意,少数MTC患者会出现Ctn正常或降低现象。
四、穿刺
甲状腺癌的穿刺包括粗针穿刺和细针穿刺(FNAB),粗针穿刺活检(Core needle biopsy,CNB)大多用于甲状腺淋巴瘤或ATC的组织学诊断,临床常用的穿刺为FNAB。对临床常见的DTC,FNAB是术前定性诊断敏感度和特异度最高的方法。术前FNAB检查有助于减少不必要的手术,并帮助确定恰当的手术方案。
FNAB的细胞学诊断报告多采用Bethesda诊断系统和我国2023年首次发布的《甲状腺细针穿刺细胞病理学诊断专家共识(2023版)》。甲状腺细胞病理学Bethesda报告系统(The Bethesda System for Reporting Thyroid Cytopathology,TBSRTC)于2007年首次提出,2009年正式发布,是最广为接受的、规范化的甲状腺细胞病理学诊断分类依据。2017年12月基于第4版世界卫生组织(WHO)甲状腺肿瘤分类更新为第二版TBSRTC。2022年第5版WHO甲状腺肿瘤分类提出了甲状腺滤泡结节性病变、高级别DTC等新概念和分子分型,对甲状腺肿瘤术前细胞学诊断及临床处理均产生了较大影响。基于此,第3版TBSRTC于2023年6月修订再版。第3版TBSRTC仍然用了第一版中使用的六个类别名称,但简化了其中的3个分类名称,即:Ⅰ,标本无法诊断(Nondiagnostic,UD);Ⅱ,良性病变(Benign);Ⅲ,意义不明确的细胞非典型病变[Atypia ofundetermined signifcance(AUS)];Ⅳ,滤泡性肿瘤(如为啫酸细胞型需特殊标明)[Follicular neoplasm(FN),specify ifoncocytic type];V,可疑恶性肿瘤(Suspicious for malignancy,SM);Ⅵ,恶性肿瘤(Malignancy)。第3版TBSRTC分类首次区分儿童和成人甲状腺结节临床处理规范,新增甲状腺结节临床与影像学特征进展和分子检测章节,并提出分子风险分组(Molecularriskgroup,MRG)的概念。中国共识早于第3版TBSRTC提出了简化的AUS分类、FN分类,规范化甲状腺细胞样本制备、染色、诊断标准、免疫细胞化学、分子检测的临床应用,但并未区分儿童和成人甲状腺结节恶性风险和临床处理规范(表1、表2)。
我们将三版TBSRTC及中国共识内容对比概括于表1和表2,并按照Bethesda分类具体解析如下:
表1 三版TBSRTC和中国共识中各类别细胞学结果的恶性风险度对比
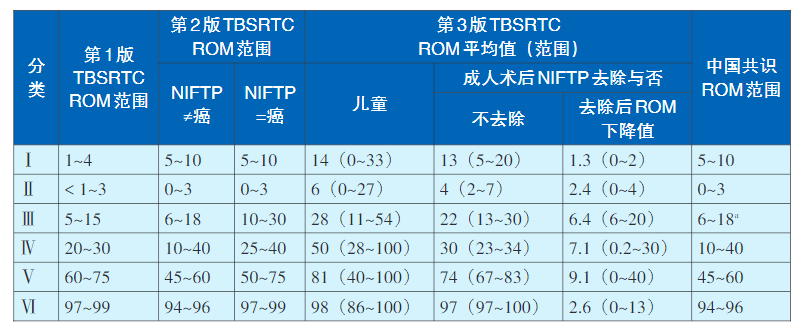
注:
ROM(Risk of malignancy):恶性风险;NIFTP(Non-invasive follicular thyroid neoplasm with papilary-like nuclear features):具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤;
a我国Ⅲ类甲状腺结节ROM为45.5%~74.1%.
表2 三版TBSRTC和中国共识中各类别细胞学结果的临床处理规范对比a
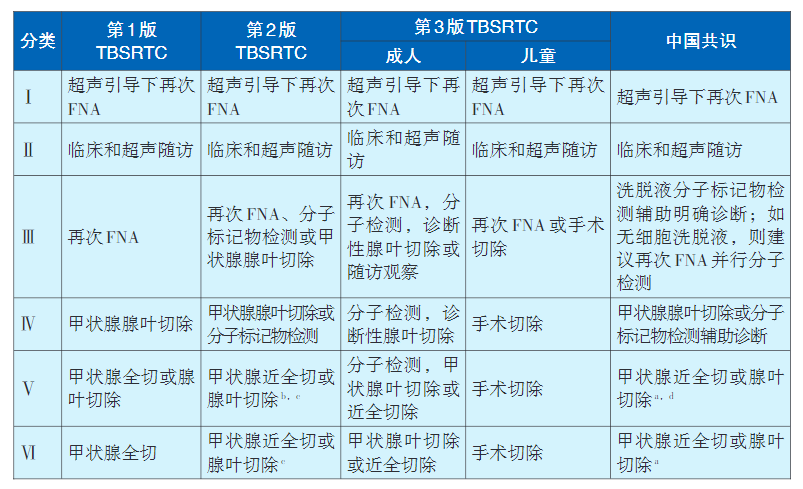
注:
a临床处理规范需结合其他检查(如临床表现、超声特点等);
b有研究推荐使用分子检测辅助评估甲状腺手术类型(甲状腺腺叶切除或甲状腺全切除);
c如果细胞学诊断为“可疑转移癌”或“恶性(转移癌)”,本规范不适用;
d可使用分子检测辅助评估甲状腺手术类型。
淋巴结FNAB洗脱液Tg检测可辅助诊断DTC有无淋巴结转移。若淋巴结为DTC转移性淋巴结,FNAB洗脱液Tg检测可检出较高水平的Tg。检测FNAB洗脱液的Ctn水平可辅助MTC的诊断。
五、分子检测
对临床上不能确诊的甲状腺癌患者,可借助分子检测提高诊断准确率。第5版WHO甲状腺肿瘤分类提出BRAF样肿瘤和RAS样肿瘤分子分型。BRAF样基因异常(如BRAFV600E、RET、BRAF融合)对甲状腺癌高度特异,与经典型和高细胞型PTC有关;间变性淋巴瘤激酶(Anaplastic lymphoma kinase,ALK)和神经营养因子受体络氨酸激酶(Neurotophin receptor kinase,NTRK)融合与以滤泡结构为主或浸润性滤泡亚型PTC相关;甲状腺分泌性癌与ETV6:NTRK3融合相关。RAS样基因异常(RAS、BRAFK601E、EIF1AX、PTEN、DICER1、PPARG或THADA融合)可见于良性、低风险肿瘤、甲状腺滤泡结构为主的癌。经FNAB仍不能确定良恶性的甲状腺结节,对穿刺标本进行甲状腺癌的分子标记物检测可提高细胞学确诊率、术前对甲状腺肿瘤进行复发风险评估。分子检测提高了甲状腺癌的诊断准确率,但目前临床上仍不能单独以分子检测的结果来诊断甲状腺结节的性质,分子检测应始终与细胞学、临床和超声检查结果相整合。
BRAF等分子标志物的检测可提高PTC患者FNAB诊断的准确性,BRAF突变与DTC的侵袭性、复发及死亡相关,将BRAF突变与原发灶大小、腺外侵犯等细化肿瘤特征整合纳入复发风险分层系统的中危判断标准,有助于判定是否进行术后放射性碘-131(131I)治疗,从而进一步降低甲状腺癌复发风险。
除BRAF突变特征之外,研究提示TERT启动子突变在晚期侵袭性甲状腺癌的发生发展中有重要作用,TERT启动子突变与BRAF突变并存者的复发与死亡风险显著高于仅伴有其中之一突变或无突变者,提示TERT启动子突变在晚期甲状腺癌预后中的意义。
第3版TBSRTC提出了低、中、高风险MRG的概念。低风险MRG分子异常表现为单RAS突变或RAS样突变;中风险MRG表现为单BRAFV600E突变或BRAF样突变或拷贝数异常;高风险MRG表现为驱动基因异常合并TERT启动子、TP53、AKT1和/或PIK3CA等基因异常,有助于发现高侵袭性、预后不良的甲状腺癌。
术前行RET基因筛查和遗传咨询,有助于判定MTC患者是否为遗传性甲状腺髓样癌(Hereditary medullary thyroid cancer,HMTC),从而进行临床评估并指导治疗方案。临床上约有1%~7%的散发性MTC患者实际具有HMTC的基因背景,散发性病例行基因筛查可进一步明确疾病分型。对HMTC患者,应常规告知患者,遗传性RET突变可能给家庭成员带来的风险。育龄期的RET突变携带者,尤其是MEN2B型,建议进行孕前或产前的遗传咨询。
对以下人群可推荐RET基因筛查和遗传咨询:①散发性MTC患者;②HMTC患者及一级亲属;③在儿童或婴儿期出现MEN2B表现患者的父母;④皮肤苔藓淀粉样变患者;⑤先天性巨结肠病患者,携带RET基因10号外显子突变。
进行RET基因筛查的具体目标位点包括:①MEN2A的基因筛查:需要检查的RET基因突变位点主要包括10号外显子的第C609、C611、C618、C620密码子,11号外显子的第C630和C634密码子。②MEN2B的基因筛查:需要检查的RET基因突变位点主要包括16号外显子的M918T突变和15号外显子的A883F突变,若结果为阴性,则需行RET基因编码区全测序。
对遗传性MTC根据不同的突变位点进行风险分层,可分为三级:①最高风险(HST):包括MEN2B患者和RET密码子M918T突变;②高风险(H):包括RET密码子C634突变和A883F突变;③中等风险(MOD):包括遗传性MTC患者中除M918T、C634、A883F突变之外的患者
六、人工智能
基于大量超声图像训练的人工智能模型可以辅助甲状腺癌的诊断。已有研究表明基于卷积神经网络的人工智能模型可对甲状腺结节良恶性进行鉴别,其诊断准确率与高年资超声医师相当。大量国内外研究均表明,使用医生联合人工智能的诊断方式能更加有效地提高甲状腺癌的诊断效果。有一定数量的研究表明基于大量超声图像训练的人工智能模型可以基于甲状腺癌原发灶超声影像对淋巴结转移进行预测但准确率相对有限。
参考文献及书籍:
1.《2025 中国肿瘤整合诊治指南(CACA)——甲状腺癌》
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)