首页 > 医疗资讯/ 正文
肝细胞癌(Hepatocellular Carcinoma, HCC)是全球最常见的恶性肿瘤之一,也是癌症相关死亡的第三大原因。尽管近年来靶向治疗和免疫治疗取得了进展,但患者对酪氨酸激酶抑制剂(TKIs)的反应并不持久,存在内在或获得性耐药问题。肿瘤微环境中的不利条件,如营养剥夺、低氧、氧化应激和遗传损伤,促使肿瘤细胞通过应激适应机制和代谢重编程来保护自身并抵抗抗肿瘤策略。近年来,相分离(Phase Separation)在蛋白质和代谢过程中的作用越来越受到关注,它在肿瘤发生、转移和药物耐受中起着关键作用。然而,相分离在HCC中的具体机制仍不清楚。本研究旨在揭示RIOK1在HCC中的作用及其通过相分离限制PTEN翻译的机制,为HCC治疗提供新的策略。
中国科学技术大学刘连新、王继洲、宋瑞鹏、王嘉倍等人团队聚焦于肝细胞癌(HCC)中RIOK1(一种非典型丝氨酸/苏氨酸激酶)的作用及其机制。研究通过多平台筛选发现RIOK1在HCC中高表达,并与不良预后相关。RIOK1通过相分离(LLPS)与IGF2BP1和G3BP1相互作用,形成应激颗粒(SGs),从而捕获PTEN mRNA并抑制其翻译,激活磷酸戊糖途径(PPP),帮助细胞应激解决并抵抗酪氨酸激酶抑制剂(TKI)的毒性。此外,研究还发现小分子抑制剂chidamide能够下调RIOK1,增强TKI的疗效,为HCC治疗提供了新的策略。相关内容以“RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma”为题发表在《Nature Cancer》上。

【关键结论】
RIOK1与HCC进展相关:RIOK1在HCC中的高表达与患者预后不良相关,并且与NRF2的转录激活有关。
RIOK1通过相分离限制PTEN翻译:RIOK1通过与IGF2BP1和G3BP1相互作用,将PTEN mRNA纳入应激颗粒(Stress Granules, SGs),从而抑制PTEN的翻译。
RIOK1激活PPP:RIOK1的表达与PPP的激活相关,这有助于细胞应激解决和对TKI的保护。
Chidamide作为RIOK1抑制剂:Chidamide能下调RIOK1的表达,并增强TKI的疗效,为HCC治疗提供了新的策略。
【主要内容】
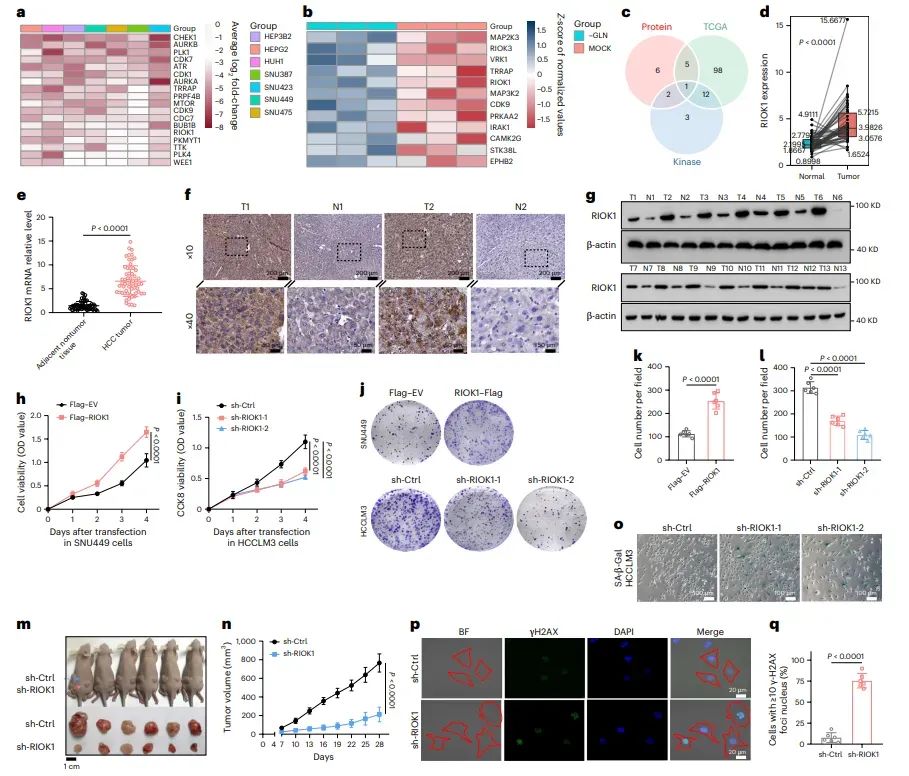
图1RIOK1在HCC中的表达与功能
图中展示了通过多平台筛选鉴定出RIOK1在HCC中的高表达,并与不良预后相关。通过分析HCC患者样本,发现RIOK1在肿瘤组织中的表达显著高于邻近正常组织。此外,RIOK1的高表达与PI3K/AKT信号通路相关,且RIOK1的敲低导致细胞增殖减少,而过表达则促进细胞增殖。这些结果表明RIOK1在HCC细胞生长中起重要作用。
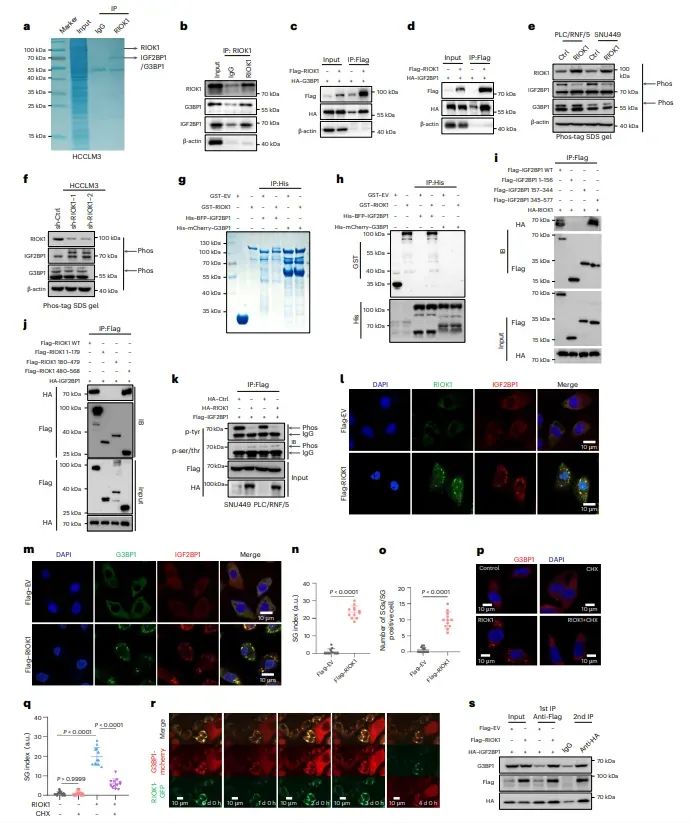
图2RIOK1通过IGF2BP1-G3BP1相互作用促进应激颗粒(SGs)的形成
进一步揭示了RIOK1与IGF2BP1和G3BP1的相互作用,以及这种相互作用在应激颗粒(SGs)形成中的关键作用。RIOK1能够通过其C末端的内在无序区域(IDR)与IGF2BP1结合,并通过IGF2BP1间接与G3BP1相互作用,从而促进SGs的形成。此外,RIOK1的过表达增强了SGs的动态组装,而敲低则减少了SGs的形成。
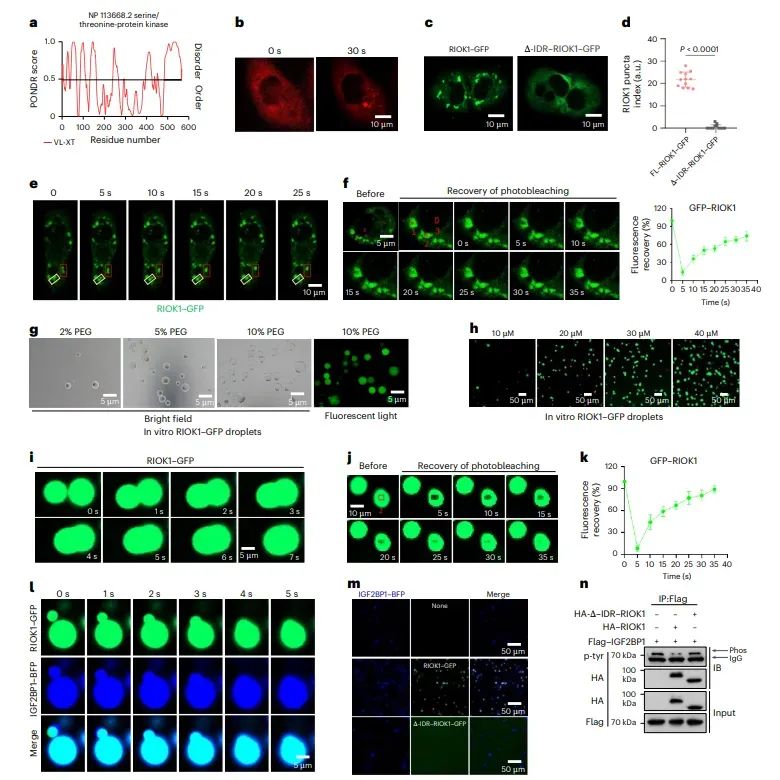
图3RIOK1的液-液相分离(LLPS)特性
通过体外和体内实验,证实了RIOK1能够通过其C末端的IDR区域进行LLPS。RIOK1-GFP融合蛋白在细胞中形成液态滴状结构,这些结构具有动态性和流动性。此外,RIOK1与IGF2BP1的共表达进一步促进了LLPS,而RIOK1的IDR区域缺失则削弱了这种能力。
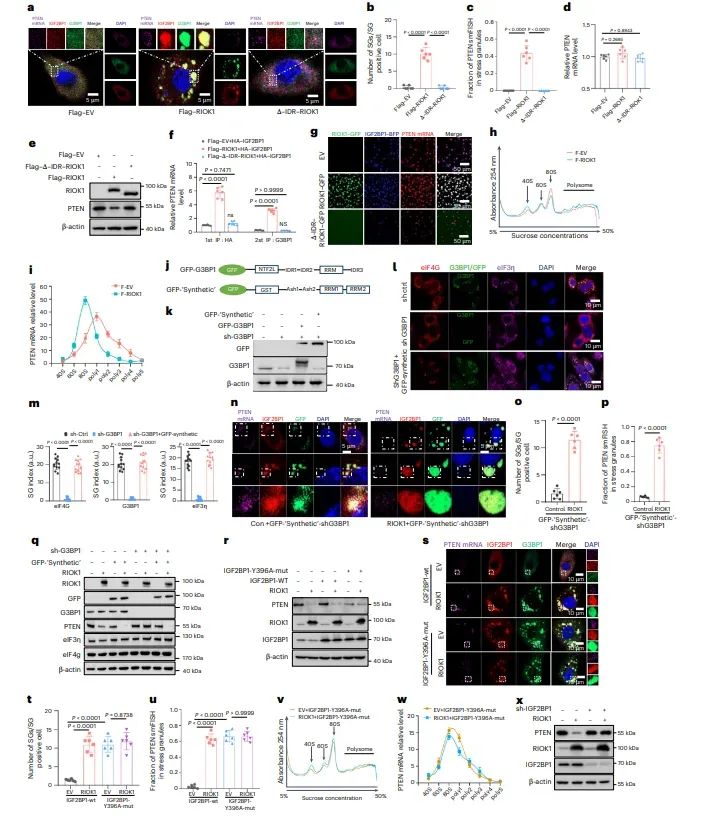
图4RIOK1通过LLPS抑制PTEN翻译
图中揭示了RIOK1通过LLPS抑制PTEN翻译的机制。RIOK1的过表达导致PTEN mRNA被纳入IGF2BP1和G3BP1形成的SGs中,从而抑制PTEN的翻译。通过免疫沉淀和RNA荧光原位杂交(smFISH)实验,证实了RIOK1、IGF2BP1、G3BP1和PTEN mRNA在SGs中共定位。此外,多聚体分析显示RIOK1的过表达减少了PTEN mRNA的翻译效率。
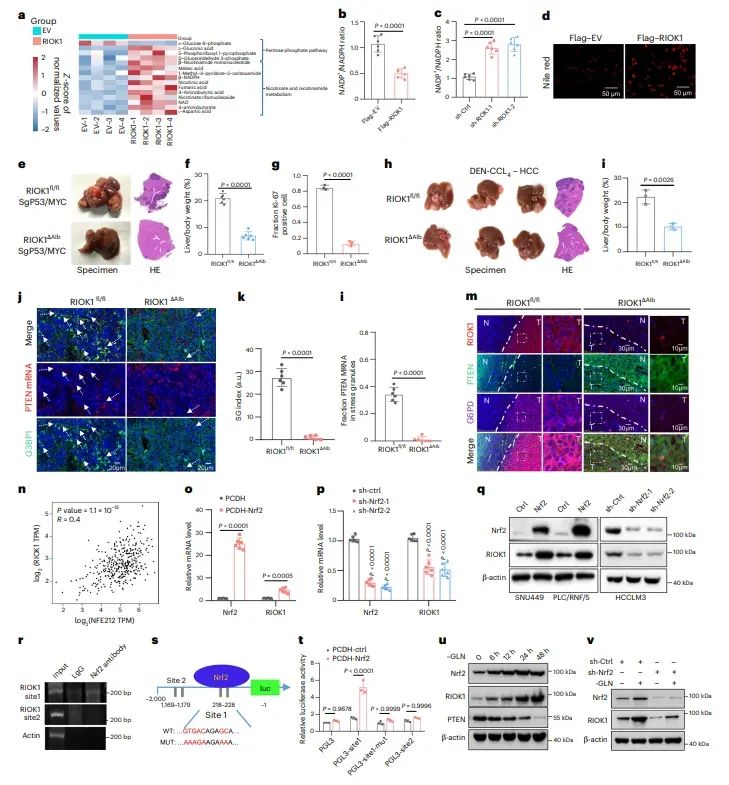
图5RIOK1驱动PPP并由NRF2转录激活
图中展示了RIOK1对磷酸戊糖途径(PPP)的调控作用及其由NRF2转录激活的机制。代谢组学分析表明,RIOK1的过表达增加了PPP相关代谢物的水平,降低了NADP+/NADPH比率。此外,RIOK1的表达在NRF2激活的条件下显著增加,表明NRF2是RIOK1的转录因子。通过ChIP和报告基因实验,进一步证实了NRF2对RIOK1启动子的结合和调控。
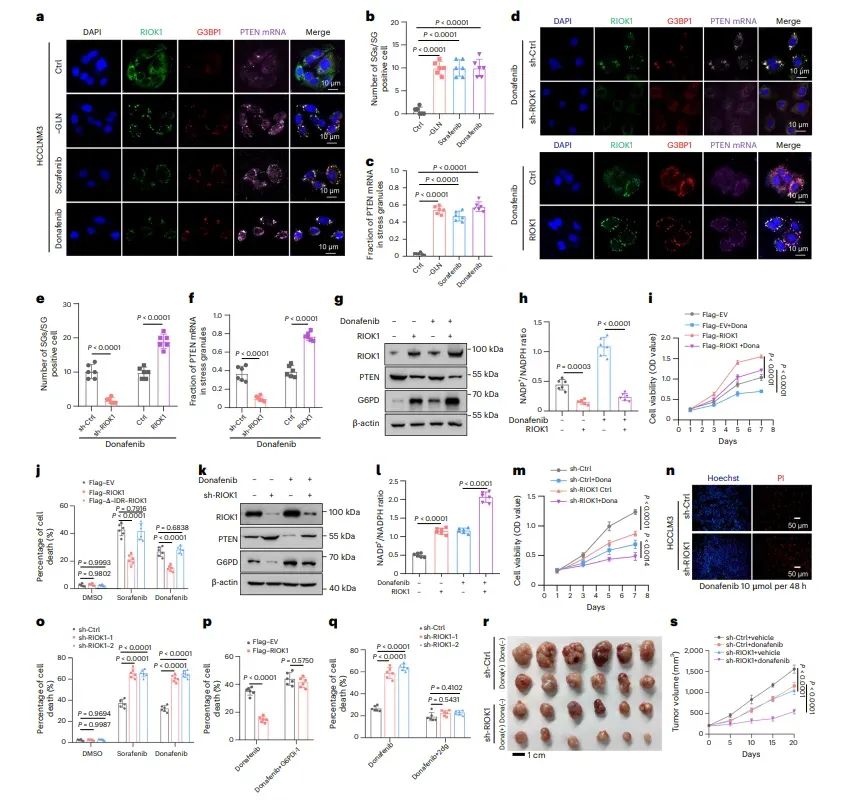
图6RIOK1介导的LLPS损害HCC对TKIs的敏感性
图中揭示了RIOK1介导的LLPS和SGs形成在HCC对TKIs耐药性中的关键作用。RIOK1的过表达降低了PTEN蛋白水平,增加了G6PD蛋白水平,从而降低了NADP+/NADPH比率,帮助细胞应激解决并抵抗TKI的毒性。此外,RIOK1的敲低增强了HCC细胞对TKIs的敏感性,而RIOK1的过表达则降低了这种敏感性。
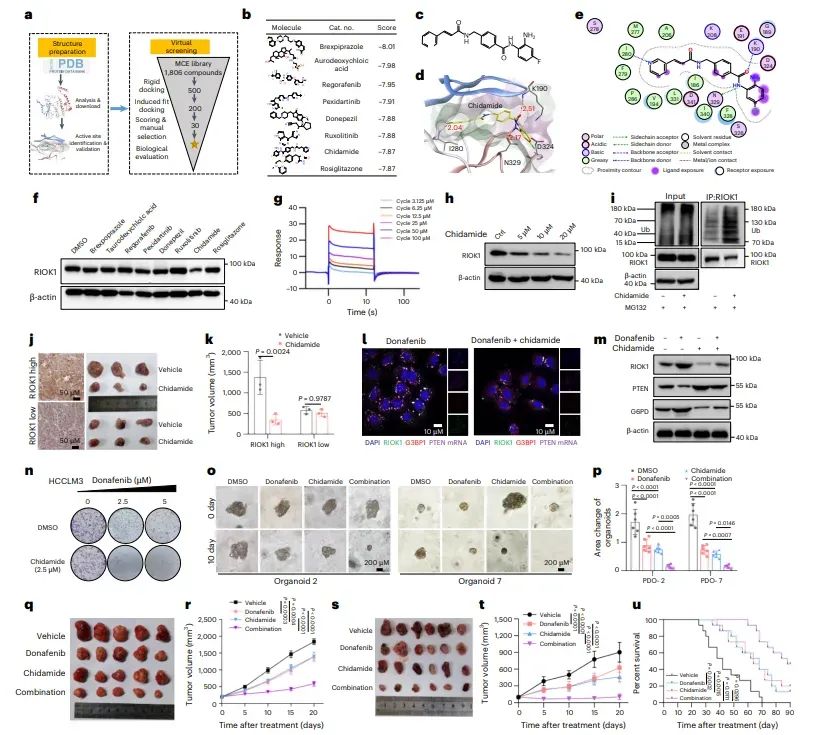
图7Chidamide靶向RIOK1增强TKI治疗效果
图中展示了小分子抑制剂chidamide对RIOK1的靶向作用及其增强TKI治疗效果的潜力。通过虚拟筛选和实验验证,发现chidamide能够显著降低RIOK1蛋白水平,并通过促进RIOK1的泛素化和蛋白酶体降解发挥作用。此外,chidamide与TKIs联合使用在体外和体内模型中显著增强了抗肿瘤效果,延长了动物模型的生存时间。
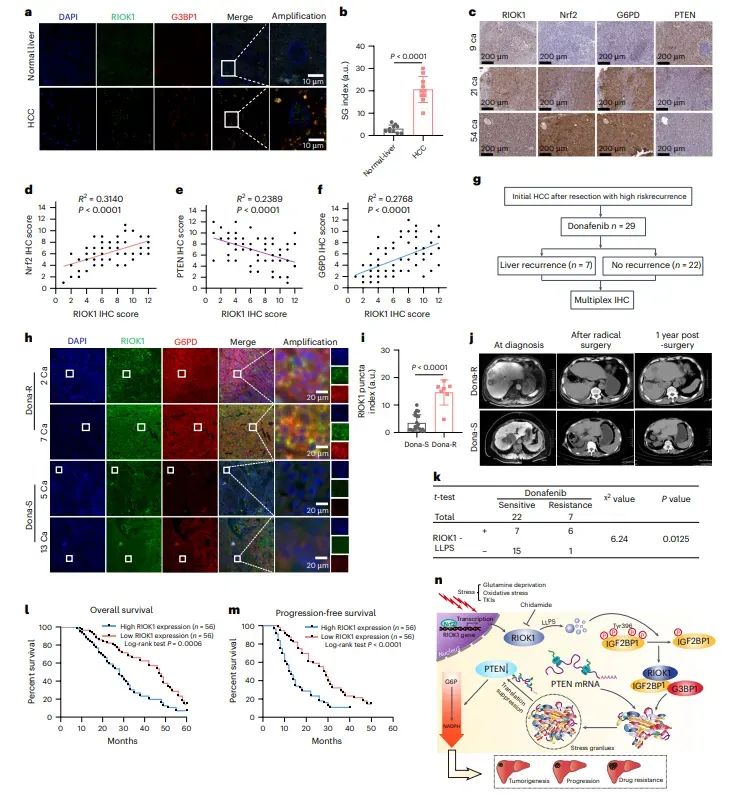
图8RIOK1与TKI耐药性及不良预后相关
图中总结了RIOK1在HCC患者中的表达与TKI耐药性及不良预后的相关性。通过分析HCC患者样本,发现RIOK1的高表达与TKI耐药性相关,并且与NRF2、G6PD的高表达和PTEN的低表达相关。此外,高RIOK1表达的HCC患者在TKI治疗后表现出更差的总生存率(OS)和无进展生存率(PFS)。这些结果进一步证实了RIOK1作为HCC治疗靶点的潜力。
【全文总结】
本研究揭示了RIOK1在肝细胞癌(HCC)中的关键作用及其通过相分离限制PTEN翻译的机制。RIOK1在HCC中高表达,与不良预后相关,并通过与IGF2BP1和G3BP1相互作用形成应激颗粒(SGs),抑制PTEN的翻译,激活磷酸戊糖途径(PPP),从而帮助细胞应激解决并抵抗酪氨酸激酶抑制剂(TKI)的毒性。此外,研究发现小分子抑制剂chidamide能够下调RIOK1,增强TKI的疗效,为HCC治疗提供了新的潜在手段。
原文链接:
https://www.nature.com/articles/s43018-025-00984-5
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)