首页 > 医疗资讯/ 正文
放射治疗(以下简称“放疗”)作为癌症治疗的“三驾马车”之一,每年帮助数百万患者延长生存期。从1895年伦琴发现X射线至今,放疗技术已进化到立体定向放射外科(SRS)和质子重离子治疗阶段,其精准性足以将辐射剂量聚焦于肿瘤组织,最大限度保护周围健康细胞。然而,2025年5月《自然》杂志刊登的一项突破性研究,却揭示了放疗鲜为人知的“暗面”——高剂量辐射可能通过激活特定分子通路,反而促进未被照射的远处转移灶生长。这项由芝加哥大学与华南理工大学合作完成的研究,不仅重新定义了放疗的“双刃剑”属性,更对临床决策提出了全新挑战。

从“远隔效应”到“坏远隔效应”:免疫系统的双重博弈
早在 1953 年,英国科学家 R.H. Mole 就提出了远隔效应(abscopal effect)的概念,即局部放射治疗不仅能使受照射的肿瘤病灶缩小,未受辐射的远端转移病灶也可能发生消退,这被认为是放疗与免疫系统相互协同的结果,为放射免疫治疗提供了理论依据。
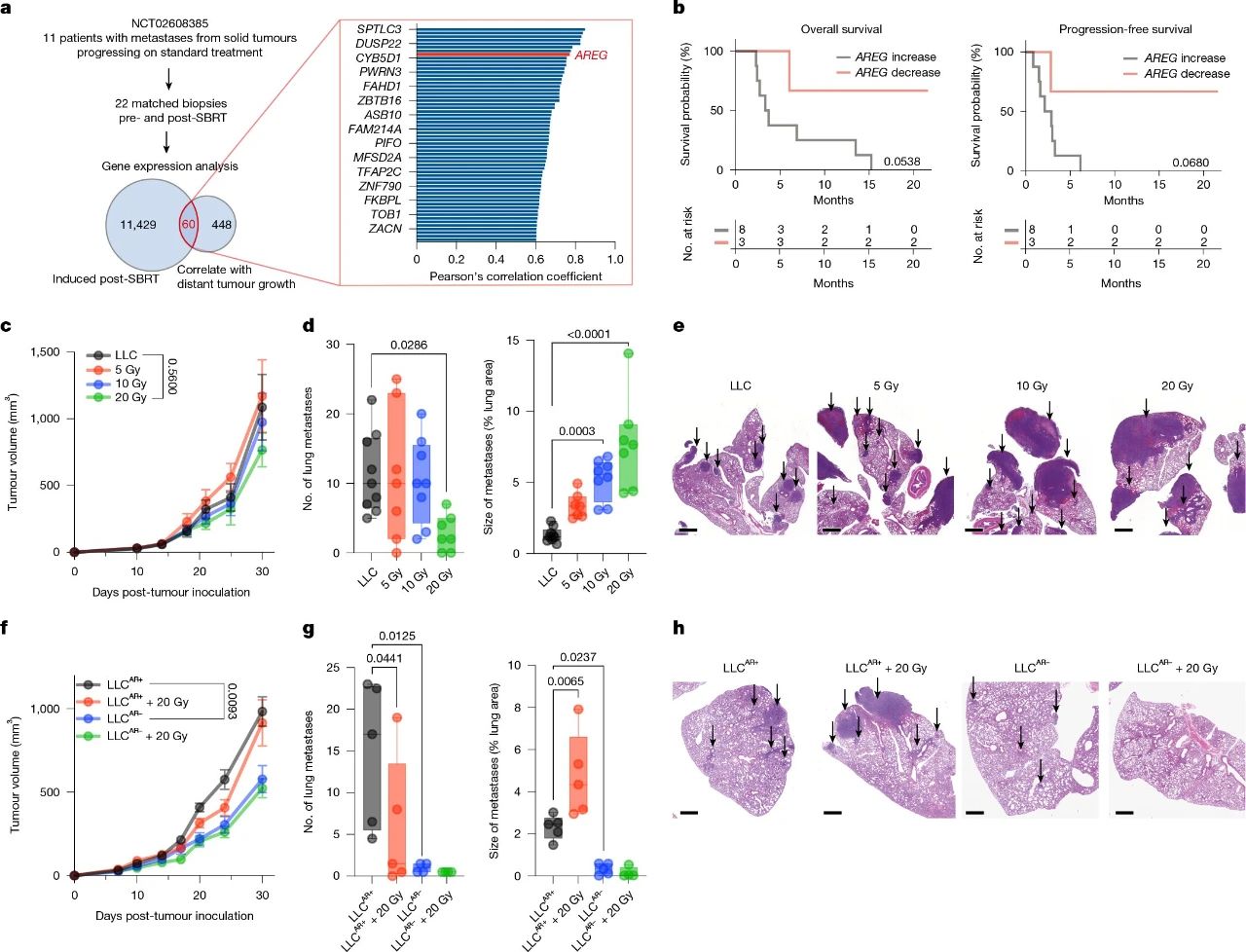
然而,芝加哥大学和华南理工大学的研究人员却发现了一种与远隔效应相反的现象——坏远隔效应(badscopal effect)。他们通过对接受高剂量立体定向体部放射治疗(SBRT)的晚期实体瘤患者的活检样本进行分析,结果发现,放疗后患者体内一种名为双调蛋白(amphiregulin,AREG)的蛋白质表达水平显著提高,而 AREG 的增加与远处未照射转移灶的进展呈正相关。
进一步的临床数据分析表明,与放疗后 AREG 表达未增加的患者相比,AREG 表达增加的患者无进展生存期(PFS)和总生存期(OS)都明显缩短,提示放疗诱导的 AREG 表达增加可能是导致远处转移灶进展、预后不良的关键因素。
放疗如何“暗中助力”远处转移?
为了深入探究放疗促进远处转移的机制,研究团队开展了系列动物实验。他们将路易斯肺癌(LLC)肿瘤细胞植入小鼠侧腹部,并对肿瘤进行局部放疗。结果显示,即使 20 Gy 放疗减少了肺部转移灶的数量,但 10 Gy 和 20 Gy 放疗都显著增加了肺部转移灶的平均大小。进一步分析发现,放疗后 LLC 侧腹肿瘤局部和全身的 AREG 浓度呈现出剂量依赖性增加,而未荷瘤小鼠接受相同放疗时 AREG 水平却没有变化,这表明放疗诱导的 AREG 主要来源于肿瘤细胞。
放疗会诱导双调蛋白表达并促进远处转移灶生长
研究人员利用 CRISPR-Cas9 技术在 LLC 细胞中敲除 Areg 基因后发现,与野生型肿瘤相比,AREG 缺陷型肿瘤在放疗后生长速度减缓,导致的肺部转移灶数量更少、体积更小,且放疗不再引起肺部转移灶大小的增加。这直接证实了肿瘤细胞来源的 AREG 是放疗引起远处转移灶增大的关键驱动因素。
放疗对免疫微环境的“重塑”
研究还发现,放疗会诱导肿瘤细胞分泌 AREG,而 AREG 能与广泛表达的跨膜酪氨酸激酶表皮生长因子受体(EGFR)结合,激活细胞内的信号通路,控制细胞存活、增殖、迁移和细胞死亡等过程。在对 NSCLC 患者接受 SBRT 治疗后的外周血单核细胞(PBMCs)进行分析时,研究人员发现,Tyr992 磷酸化的 p-EGFR 在单核细胞和树突状细胞上的表达最高,且 SBRT 后 p-EGFR+ 单核细胞的比例增加,与患者更差的整体生存率显著相关。
动物实验也观察到类似现象,放疗后荷 LLC 肿瘤小鼠肺部 p-EGFR+ 的单核吞噬细胞(MNPs),特别是 Ly6C+ MNPs 显著增加,但 AREG 缺陷小鼠中未出现这一现象。这表明 AREG 可能通过靶向并影响以单核细胞和树突状细胞为主的 EGFR+ MNPs,发挥促进转移的功能。
更深入的研究揭示,放疗后 MNPs 的组成发生显著变化,细胞分化被“阻滞”在早期状态,更倾向于沿着“免疫抑制”轨迹发展,抗肿瘤功能基因表达下调,免疫抑制基因表达上调。同时,放疗显著上调了肿瘤细胞表面的 CD47“别吃我”信号,阻碍巨噬细胞和髓细胞吞噬肿瘤细胞的能力,而这一过程也是 AREG 依赖性的。
如何应对放疗的“坏远隔效应”?
既然 AREG 是放疗“坏远隔效应”的关键介质,那么阻断 AREG 能否改善放疗效果呢?研究人员给荷 LLC 肿瘤的小鼠注射了 AREG 靶向抗体,结果显示,单独使用 AREG 抗体虽不能显著抑制肿瘤生长,但与放疗联合使用时,能显著延缓侧腹肿瘤生长,且完全消除了放疗引起的肺部转移灶大小增加的现象。此外,将放疗与 AREG 抗体和 CD47 抗体相结合的三联疗法,能显著抑制 LLC 侧腹肿瘤生长,减少转移灶大小,比单独放疗或任何双联疗法效果更好。
总结
这项研究为我们全面认识放疗的作用提供了新的视角。放疗在精准打击肿瘤的同时,也可能通过诱导肿瘤细胞分泌 AREG,激活免疫细胞上的 EGFR,重塑免疫微环境,抑制免疫细胞对肿瘤的吞噬作用,从而促进远处转移灶的增长。这不仅解释了临床上部分患者放疗后远处转移灶进展的现象,也为优化放疗策略提供了新的靶点。
未来,我们或许可以根据患者在放疗后 AREG 表达水平的变化,实施个性化的放疗方案。对于高 AREG 表达的患者,在放疗的同时联合 AREG 阻断治疗,以最大化放疗的抗癌效果,同时抑制其潜在的促进转移副作用。同时,该研究也为进一步探索放疗与其他治疗手段(如 EGFR-TKI、CD47 抗体等)的联合应用提供了实验依据,有望为癌症患者带来更精准、更有效的治疗方案。
论文链接:
https://www.nature.com/articles/s41586-025-08994-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)