首页 > 医疗资讯/ 正文
临床资料
患者,男性,66岁,一年前因偶尔的干咳和胸痛就诊,CT发现左下肺胸膜下结节,直径约0.6cm,影像评估后建议随诊,此次CT检查示结节比之前增大,呈不规则团块状密度增高影,最大横截面约1.7×1.5cm,内见斑点状气体影,边缘欠光整,周边见细短毛刺,邻近胸膜增厚,考虑左下肺结节恶性病变可能性极大,在完善相关检查后手术治疗。
大体检查
送验标本大体特征示“左下肺”:
部分肺组织,大小10×3×2cm,胸膜下见一灰白色肿块,大小2.3×1.6×1.5cm,切面灰白质硬,与周边肺组织分界不清。
镜下所示
镜下特征为低分化非小细胞肺癌形态,有局灶的坏死,未见明确的腺泡、乳头和微乳头结构,瘤细胞呈实性巢团排列(图A),部分区域可见胞浆嗜酸性癌细胞排列成巢团、或假腺样结构,似腺样分化(图B),部分区域肿瘤排列呈基底样癌样,弥漫散在胞质略嗜酸性、类似角化或非角化型鳞状细胞癌的区域(图C),部分区域见微小的角化灶(图D)。
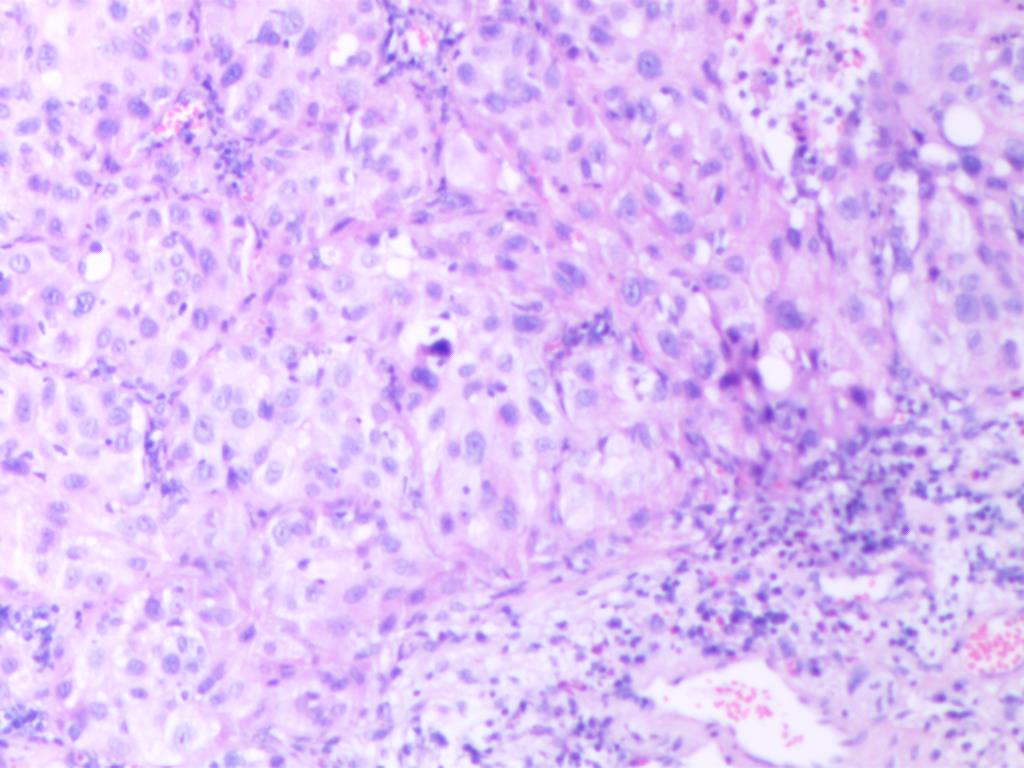
图A 肿瘤示低分化,呈实性巢团排列,缺乏鳞状分化或腺泡状结构(HEx100)
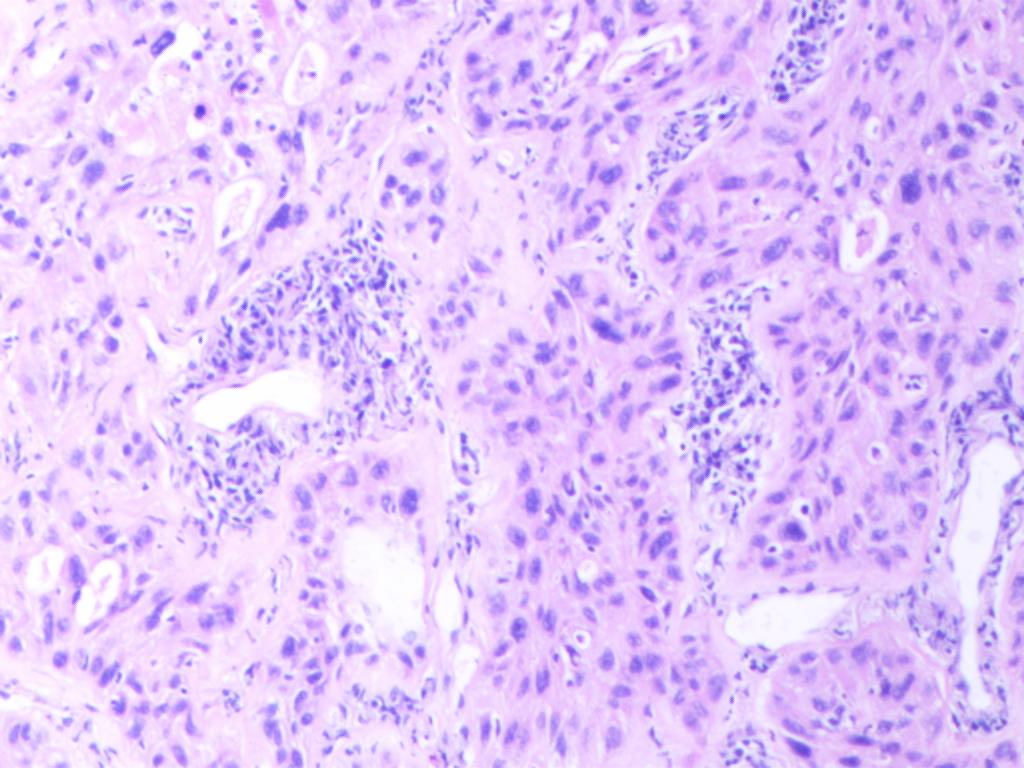
图B 低分化胞浆嗜酸性癌细胞排列巢团或假腺样结构,似腺样分化 (HEx100)
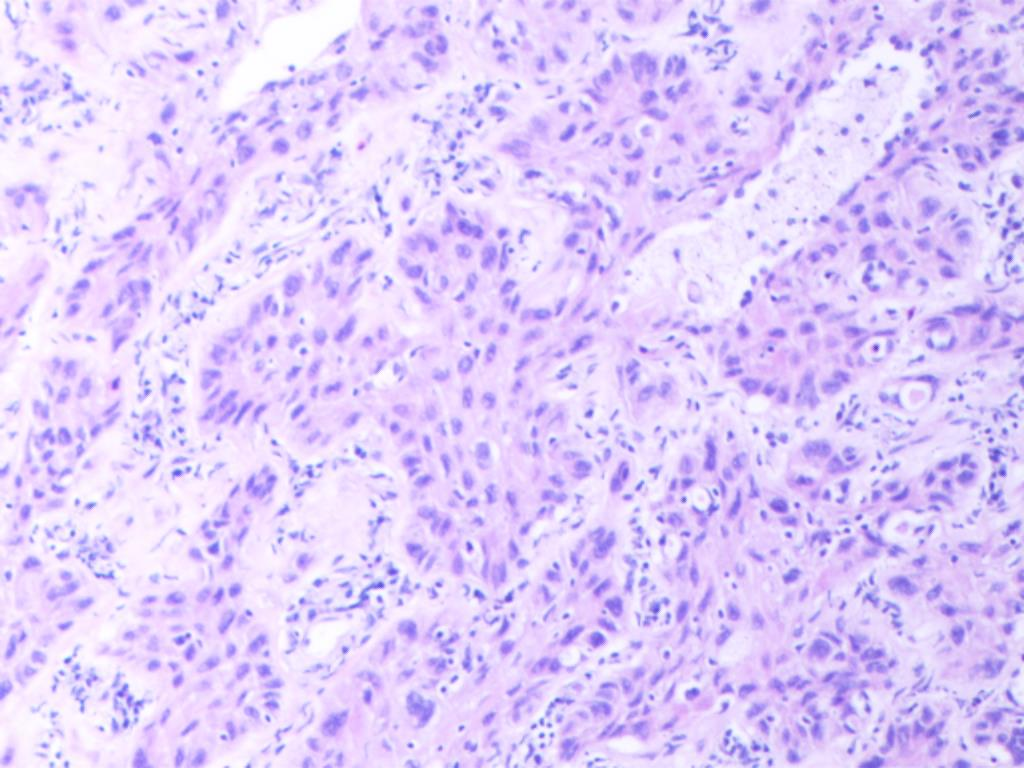
图C 肿瘤排列呈基底样癌样,似鳞样分化(HEx100)
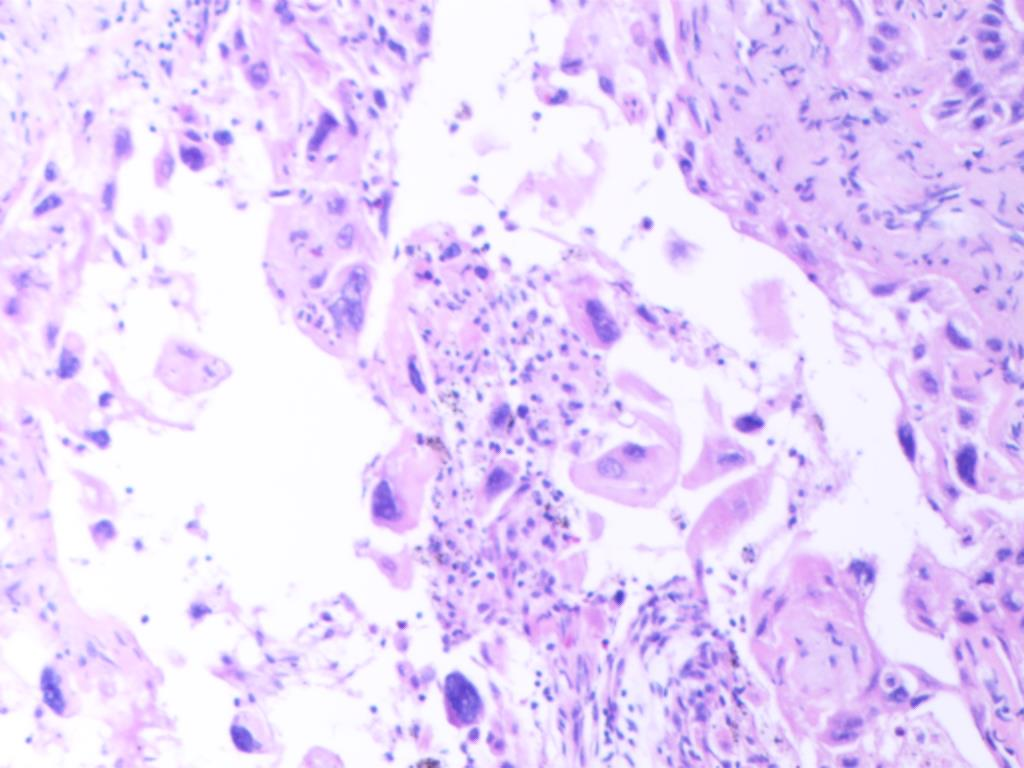
图D 肿瘤细胞见微小的角化灶(HEx100)
免疫组织化学表型和特殊染色
CK5/6(图E)、p40(图F)、TTF1(图G)、NapsinA(图H )弥漫阳性表达,不表达CK7、CgA、INSM1、syn、CD56、PAX8和CDX2,特殊染色黏液卡红灶性染色(图I)。
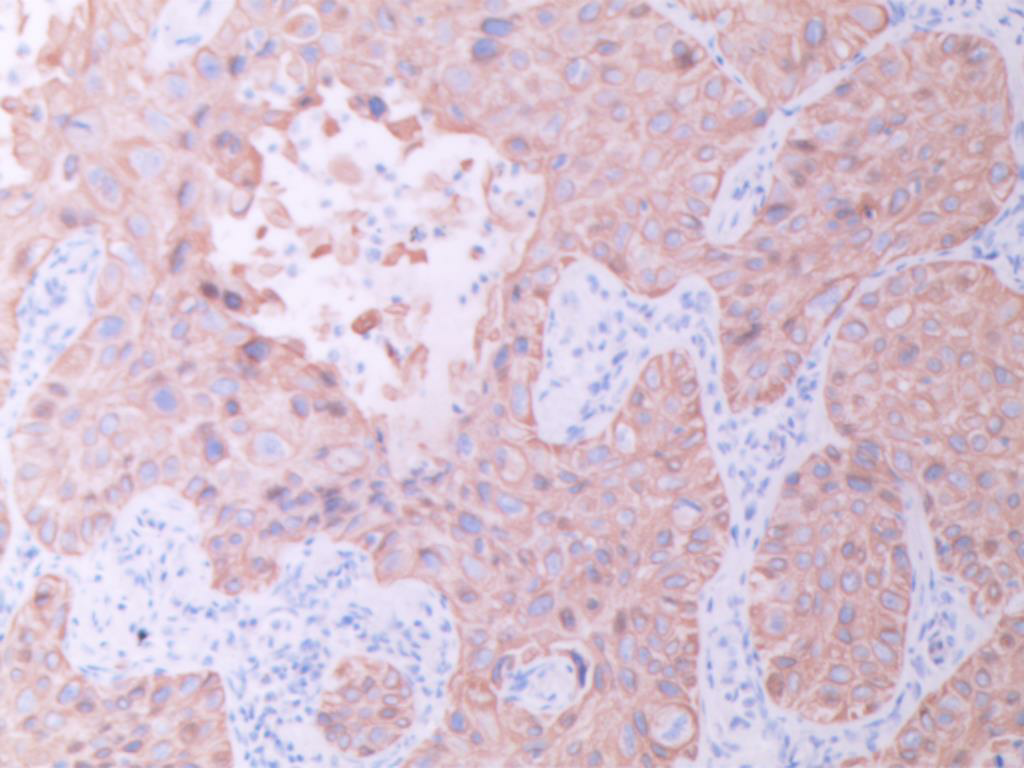
图E CK5/6弥漫阳性 (SPx100)
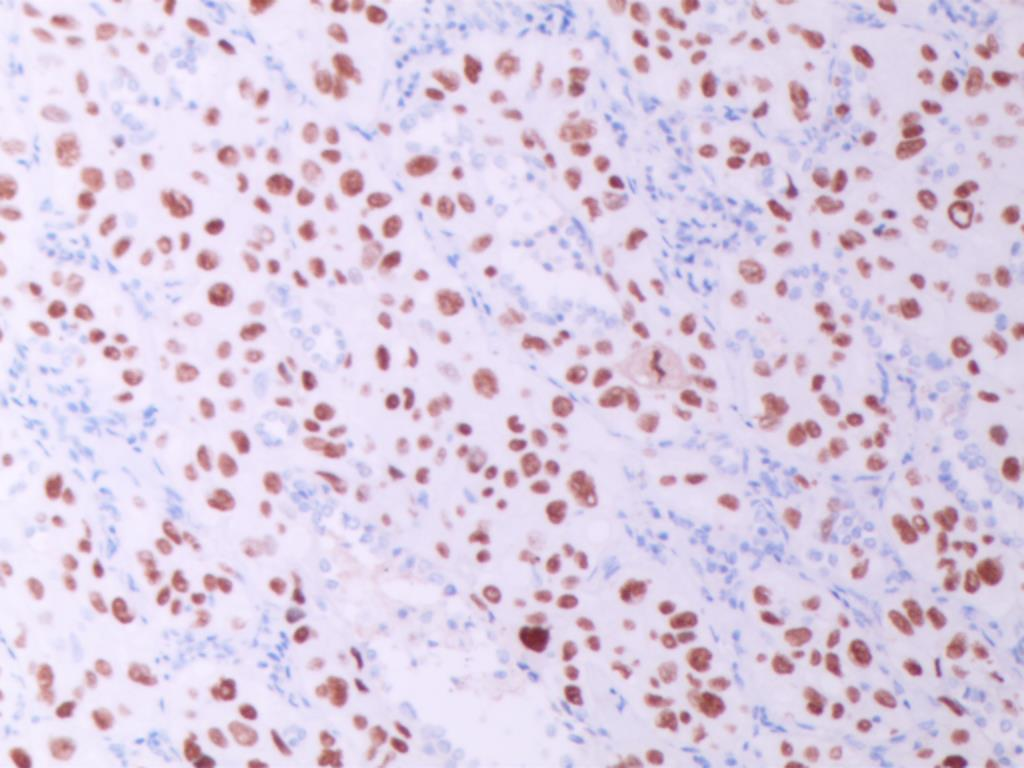
图F P40 弥漫性阳性 (SPx100)
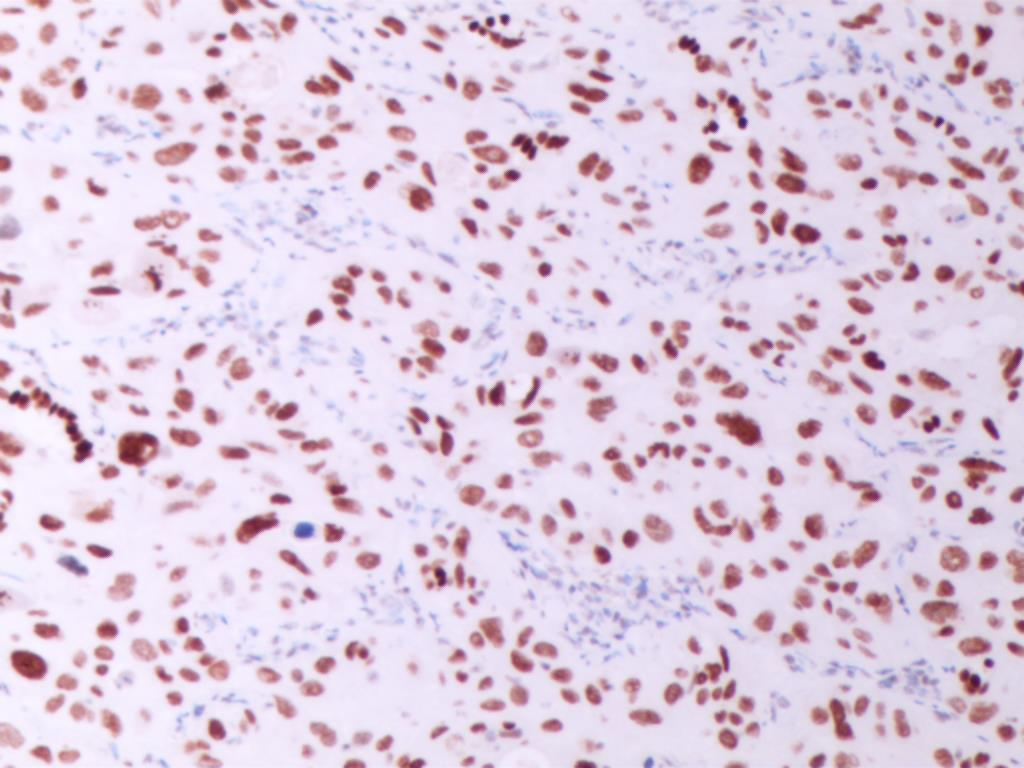
图G TTF1 弥漫性阳性 (SPx100)
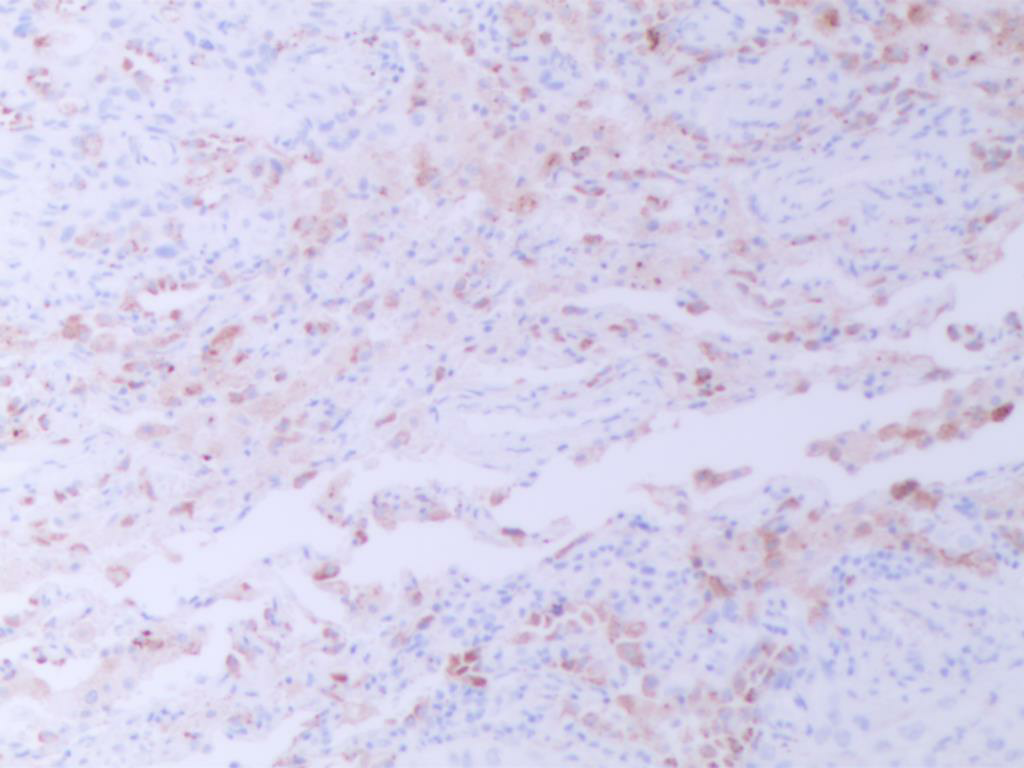
图H NapsinA弥漫阳性(SPx100)
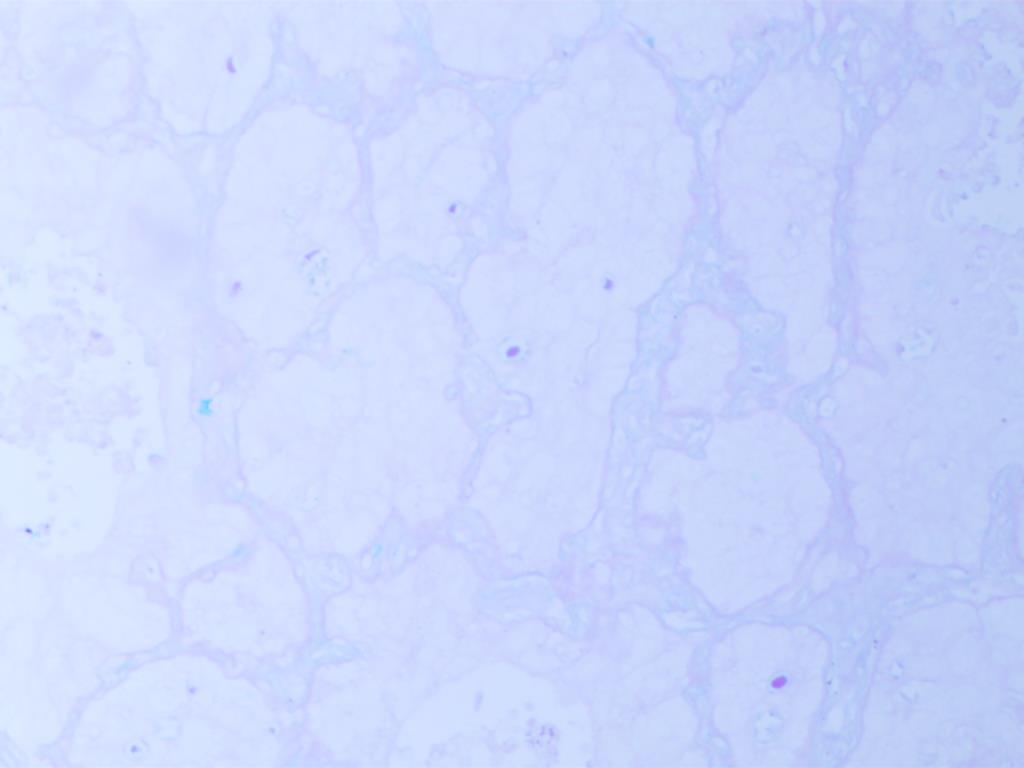
图I 肿瘤细胞内/外无黏液(黏液卡红灶性染色 x100)
最终诊断
病理最终诊断:“左下肺”:
HE结合免疫组化结果示非小细胞肺癌,可见胸膜侵犯,支气管切缘阴性;脉管切缘阴性 注:肿瘤细胞既表达TTF-1、NapsinA,又表达P40、CK5/6,是一种目前不能分类的罕见肿瘤(符合具有腺癌和鳞癌双向分化免疫表型特征的非小细胞肺癌)。
讨论
虽然分子遗传特征、靶向基因治疗等新技术已广泛进入肺癌的诊断和治疗,但组织形态学特征依然是肺癌病理诊断的基石。所谓肺腺癌、鳞癌的区分,是指肿瘤的分化特点不同,如形态学上的鳞状表现、腺样特征,以及免疫组织化学方面分别对对应的p40、TTF1表达。我院诊断的这例同时具有TTF1/p40双表达的独特免疫表型,查阅已报道文献发现这类TTF1/p40弥漫性共表达的肺肿瘤,还具有独特的基因组特征,生物学行为比传统的非小细胞肺癌更具恶性[1-4]。
临床分型
肺癌是起源于支气管黏膜或者腺体的恶性肿瘤,而病理学是诊断肿瘤的金标准,肺癌的病理类型首先分为小细胞肺癌和非小细胞肺癌两大类,后者又包含许多不同的种类,常见的有腺癌、鳞癌、腺鳞癌、大细胞神经内分泌癌、大细胞癌和NSCLC-NOS(非小细胞肺癌-非特指型)等[5-6]。多数的肺癌借助免疫组化可以明确的区分出肿瘤类型,但也有少数肿瘤形态上并不如教科书所示的那样经典,且免疫表型具有独特性,因此认识这些罕见病例,对避免误诊有重要意义。
镜下特征
本例患者肺肿瘤形态学上为低分化非小细胞肺癌,有局灶坏死,未见明确的腺泡、乳头和微乳头结构,有部分实性巢团结构、部分弥漫散在胞质略嗜酸性、类似角化或非角化型鳞状细胞癌的区域,此例冰冻诊断时难度极大,仅做出了非小细胞肺癌待常规和免疫组化进一步明确的二类诊断。
免疫组化特征
甲状腺转录因子1(TTF1)、NapsinA(新天冬氨酸蛋白酶 A)和p40、CK5/6分别是肺腺癌细胞(LUAD)和鳞状细胞癌(LUSC)差异表达的主要转录调控因子和标记物。文献统计约75%~85% 的肺腺癌表达TTF-1,且呈弥漫一致性的强阳性表达[7],70%~90% 的肺腺癌表达 Napsin A[8],肺癌病理诊断共识中将TTF-1 和 Napsin A 联合检测作为诊断肺腺癌最优的抗体组合,两者联合使用可提高肺腺癌诊断的敏感性和特异性。CK5/6表达在鳞状上皮细胞或鳞状细胞的细胞膜和细胞质,几乎在腺上皮中不表达,p40表达在正常肺组织的支气管黏膜基底细胞以及腺的肌上皮细胞,是鳞状细胞癌的特异性标记抗体,尤其在非角化性鳞癌更具有特异性,由此可见p40、CK5/6联合检测对肺鳞癌具有较高的特异性和敏感性。免疫组织化学技术作为辅助手段协助病理医生鉴别肿瘤细胞真正来源,确保病理诊断的可靠性。近年虽有TTF-1在肺鳞癌的表达及p40在肺腺癌的表达的病例被报道,但免疫组化显示TTF-1和P40的表达仅在少数分散的肺腺癌和肺鳞癌的肿瘤细胞中。基于TTF1和p40在肺癌表达谱中很大程度上的不重叠性,两者联合优先被推荐作为低分化NSCLC分类中鉴别腺癌和鳞癌的关键免疫组化标志物,而TTF1、NapsinA 和p40、CK5/6弥漫性共表达的肺癌是非常罕见的。
分子遗传学特征
温习国内外文献报道,此类具有腺癌和鳞癌双向分化免疫表型的非小细胞肺癌的二代测序结果表明,FGFR1、MYC、AKT1的扩增概率显著高于经典型腺癌或鳞癌,TP53、CDKN2A突变概率显著高于经典型腺癌,KRAS突变、NKX2-1扩增概率显著高于经典型鳞癌,在组织形态上该肿瘤细胞缺乏分化方向,整体特征为低分化的实性巢团状,缺乏NSCLC鳞状分化或腺泡状结构,部分区域可见低分化胞浆嗜酸性癌细胞排列成巢团或假腺样结构,似腺样分化,但不具有浸润性腺癌的真性腺泡结构;部分区域肿瘤排列呈基底样鳞癌形态,局灶有坏死,似鳞样分化和微小的角化灶,但不具有基底亚型鳞状细胞癌特征性的大片坏死和低分化鳞状细胞癌胞核深蓝染、弥漫一致分布的特征。
治疗和预后
关于TTF1/p40双表达的非小细胞肺癌的具体分类,最新的呼吸WHO建议将无形态分化但表达 TTF1或p40的NSCLC分别归类为LUAD和LUSC,缺乏TTF1和p40表达的非小细胞肺癌被指定为非小细胞肺癌NOS。 而这类TTF1/p40双阳性肺癌可能由于更罕见、缺乏大宗病例研究而没有明确分类,但已报道的TTF1/p40弥漫性共表达的肺肿瘤具有上述独特的免疫表型和分子特征,生物学行为比传统非小细胞肺癌更具有侵袭性,肿瘤扩散更超越传统的NSCLC,故预后和治疗共识尚需更多病例的积累,我院此例患者术后接受6个疗程的放化疗,现每隔三月定期复查,至今预后尚可。
鉴别诊断
1.肺实性腺癌:主要成分由多角形、大而多形性的肿瘤细胞组成,片状、巢状分布,也缺乏可识别的腺样结构(例如乳头、微乳头、腺泡、贴壁生长)和本例镜下表现有相似之处。肺实性腺癌肿瘤细胞呈泡状核,核仁明显,胞质较为丰富,嗜酸性,也有部分病例以透明细胞为主,称为透明细胞癌,也有部分病例由印戒细胞构成,称之为印戒细胞癌,但新的WHO不再把透明细胞癌和印戒细胞癌作为单独类型,分别归类到腺泡、乳头、微乳头及实性腺癌伴透明细胞形态和印戒细胞形态,报告中注明透明细胞印戒细胞比例即可;如肿瘤100%为实性,黏液染色最少每两个高倍视野中有1个高倍视野不少于5个细胞有细胞内黏液。肺实性腺癌免疫组化特征显示CK7、TTF1、Napsin A、SP-A、CEA、CAM5.2、Ber-EP4、MOC31常阳性;P63、P40、CK5/6、WT1、Calretinin常阴性。
2.肺泡腔充填式生长的鳞状细胞癌:主要是指肿瘤细胞局限在肺泡腔内生长,充满整个肺泡腔,可以通过肺泡孔从一个肺泡腔生长到相邻肺泡腔,但癌细胞不破坏肺泡壁框架结构,肺泡壁上的肺泡细胞形成一层相对完整的、连续的内衬细胞。低倍镜下示肿瘤界限清楚,癌细胞充满整个肺泡腔,使肺泡膨胀呈结节状,周围肺泡框架结构未破坏。 高倍镜示肿瘤巢周围肺泡壁框架结构存在,癌细胞分界不清,胞质较嗜酸性。其免疫组化显示P40、CK5/6、P63弥漫强阳性表达,而癌巢周围存在TTF-1和CK7阳性表达的肺泡上皮细胞,vimentin和网状纤维染色显示肺泡壁框架结构存在,CD34、SMA染色显示肺泡壁纤维血管结构存在,最新进展认为肺泡腔充填式生长的肺鳞状细胞癌是一种未突破基底膜的原位癌形式。综上所述,肺实性腺癌和肺泡腔充填式生长的鳞状细胞癌与本例在常规形态上有一定的重叠,不依靠免疫组化很难鉴别。
参考文献:
[1]Joshi A, Mishra R, Desai S, et al. Molecular characterization of lung squamous cell carcinoma tumors reveals therapeutically relevant alterations[J]. Oncotarget, 2021, 12(6):578-588. DOI: 10.18632/oncotarget.27905.[PubMed链接]
[2]Tan AC, Tan D. Targeted Therapies for Lung Cancer Patients With Oncogenic Driver Molecular Alterations[J]. J Clin Oncol, 2022, 40(6):611-625. DOI: 10.1200/JCO.21.01626.[PubMed链接]
[3]Moes-Sosnowska J, Chorostowska-Wynimko J. Fibroblast Growth Factor Receptor 1-4 Genetic Aberrations as Clinically Relevant Biomarkers in Squamous Cell Lung Cancer[J]. Front Oncol, 2022, 12:780650. DOI: 10.3389/fonc.2022.780650.[PubMed链接]
[4] Zhou Z, Liu Z, Ou Q, et al. Targeting FGFR in non-small cell lung cancer: implications from the landscape of clinically actionable aberrations of FGFR kinases[J]. Cancer Biol Med, 2021, 18(2):490-501. DOI: 10.20892/j.issn.2095-3941.2020.0120.[PubMed链接]
[4] Nicholson AG, Tsao MS, Beasley MB, et al. The 2021 WHO Classification of Lung Tumors: Impact of Advances Since 2015[J]. J Thorac Oncol, 2022, 17(3):362-387. DOI: 10.1016/j.jtho.2021.11.003.[PubMed链接]
[4] Yatabe Y, Dacic S, Borczuk AC, et al. Best Practices Recommendations for Diagnostic Immunohistochemistry in Lung Cancer[J]. J Thorac Oncol, 2019, 14(3):377-407. DOI: 10.1016/j.jtho.2018.12.005.[PubMed链接]
[7]Kadota K, Nitadori J, Rekhtman N, et al. Reevaluation and reclassification of resected lung carcinomas originally diagnosed as squamous cell carcinoma using immunohistochemical analysis[J]. Am J Surg Pathol, 2015, 39(9):1170-1180. DOI: 10.1097/PAS.0000000000000439.[PubMed链接]
[8]Pelosi G, Bulloni M, Vescio M, et al. Coexpression of ΔNp63/p40 and TTF1 Within Most of the Same Individual Cells Identifies Life-Threatening NSCLC Featuring Squamous and Glandular Biphenotypic Differentiation: Clinicopathologic Correlations[J]. JTO Clin Res Rep, 2021, 2(11):100222. DOI: 10.1016/j.jtocrr.2021.100222.[PubMed链接]
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)