首页 > 医疗资讯/ 正文
牙周炎是一种由细菌菌斑引发的慢性炎症性疾病,不仅导致牙齿丧失,还可能诱发全身健康问题。传统治疗方法通常面临药物传递效率低和组织再生能力有限的挑战。因此,开发高效的纳米载体系统以实现精准治疗和组织再生成为研究热点。牙周组织再生涉及复杂的细胞信号调控和免疫微环境重塑。微小RNA(miRNA)在调控炎症和促进组织修复中发挥关键作用,但其在体内应用受限于稳定性差、内吞效率低和内体逃逸困难等问题。金属有机框架(Metal-phenolic frameworks, MOFs)通过其高表面积、可调孔径和化学可修饰性,为基因递送提供了理想平台。然而,传统金属-有机框架因结构不稳定性和孔径受限,常导致药物搭载效率低,药物释放不完全或过早释放,限制了治疗效果。
近期,中山大学滕伟教授团队开发了一种新型金属-多酚纳米粒(miR126@CuxO NPs),通过结合自下而上(bottom-up)的CuPTA纳米粒子组装与自上而下(top-down)的分步煅烧策略,成功构建了具有中空介孔结构的CuxO NPs。这一设计显著提高了纳米粒子的稳定性,成功提高了miRNA的负载效率,其搞孔隙率和氧空位(OV)含量增强了类过氧化物酶(Peroxidase, POD)活性,促进高效羟自由基生成,用于抗菌治疗。研究以“Hybrid-designed metal-phenolic nanoparticles for synergistic nano-gene periodontal therapy”为题,发表在《Biomaterials》期刊上。

【文章要点】
在该研究中,作者通过煅烧Cu-TA配位聚合物制备了CuxO NPs,并在其中负载miRNA126,构建了miR126@CuxO NPs。通过氧空位和价态工程增强类酶催化活性,促进病原体清除;控制释放铜离子和单宁酸分子作为生物活性信号,协调免疫调节并发挥互补的抗氧化作用;提供足够空间用于封装和递送miRNA-126,发挥其抑制炎症并促进血管生成和骨再生的能力。在牙周炎大鼠模型中,miR126@CuxO NPs有效利用这些能力,针对牙周炎的所有阶段进行干预,提供了全面的再生解决方案。
通过自下而上合成CuPTA NPs、自上而下煅烧制备CuxO NPs以及miR126负载。透射电子显微镜,元素分析和凝胶电泳等方法验证了miR126@CuxO NPs的中空球形形态、高miRNA负载效率以及对核酸酶降解的保护能力。
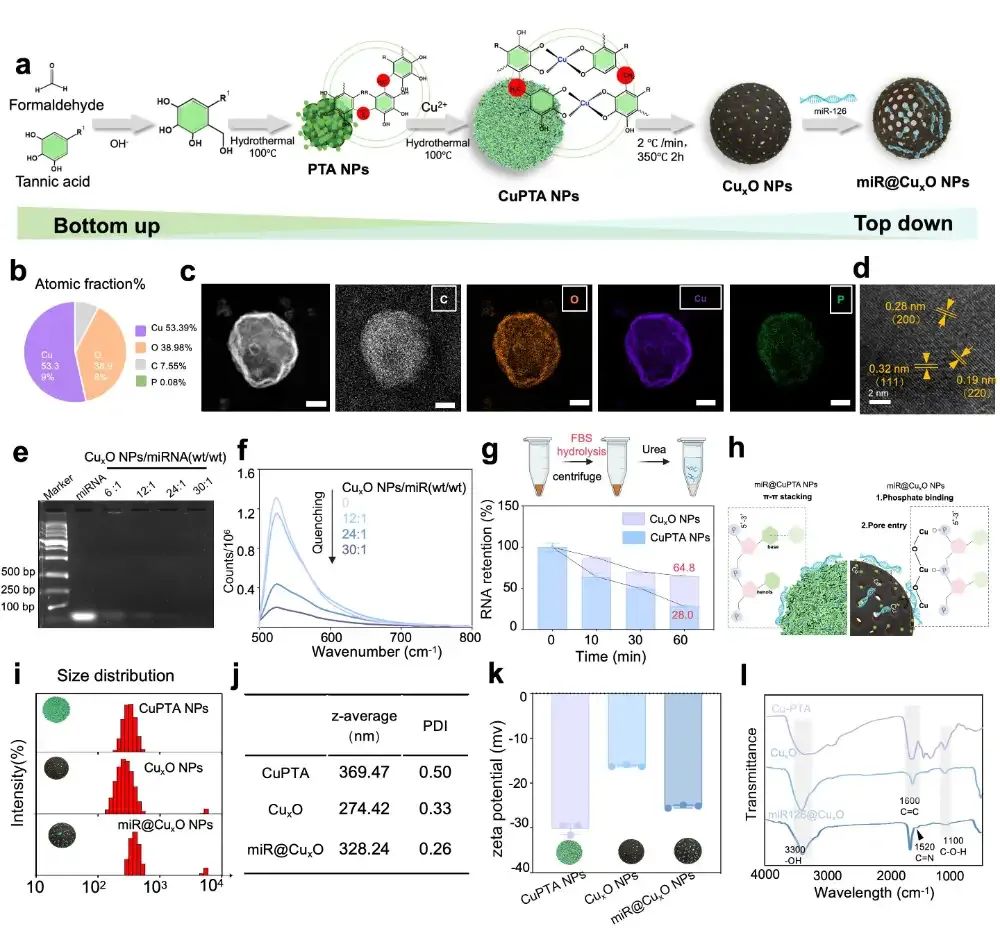
图1:miR126@CuxO NPs的理化表征(图源:Li et al.,Biomaterials. 2025)
通过X射线吸收光谱、X射线光电子能谱等技术深入研究了CuxO NPs的电子结构、晶体特性及介孔结构,揭示了其氧空位(OV)生成过程和类过氧化物酶活性。Cu-TA配位聚合物时单宁酸分解、气体释放和晶格氧逸出形成,通过EXAFS和揭示了Cu-O配位数的降低和氧空位的存在,这些特性共同增强了CuxO NPs的催化性能,为其在生物医学中的应用提供了结构基础为其在生物医学中的抗菌活性应用奠定了基础。
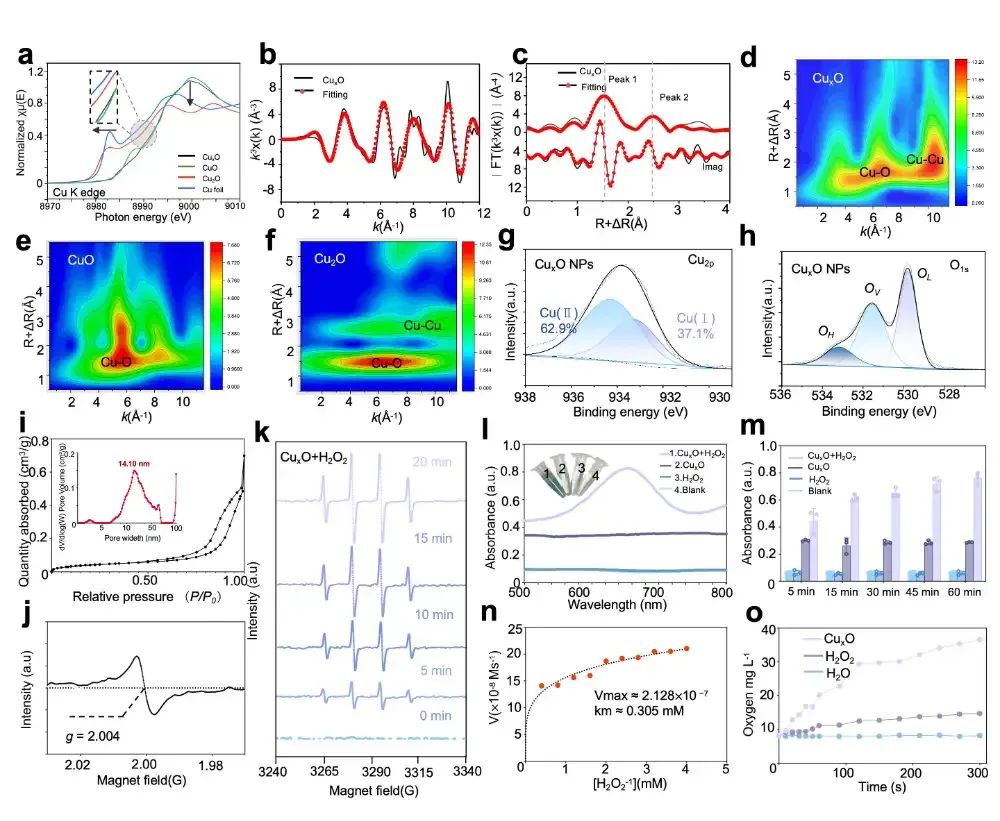
图2:CuxO NPs的酶活性分析(图源:Li et al.,Biomaterials. 2025)
利用其高酶活性,进一步探索CuxO NPs在抗菌和生物膜抑制方面的作用及其机制,特别是在牙周炎相关细菌中的应用。研究表明,CuxO NPs通过其卓越的抗菌活性显著抑制细菌生长,其效果优于CuPTA NPs,并通过透射电子显微镜和荧光染色证实了细菌细胞形态破坏和生物膜厚度的显著减少。结果也验证了CuxO NPs在复杂口腔细菌群落中的抗菌潜力。CuxO NPs的类过氧化物酶活性在炎症状态下生成高反应性羟自由破坏细菌膜、蛋白质和DNA,在低浓度时仍表现出高效抑制作用,机制上,CuxO NPs影响了氧化还原酶活性、抗氧化活性、核糖体生物合成、蛋白质折叠及嘧啶代谢等关键生物过程和分子功能,破坏了基因修复和细胞壁完整性,从而全面抑制细菌增殖和生物膜形成。
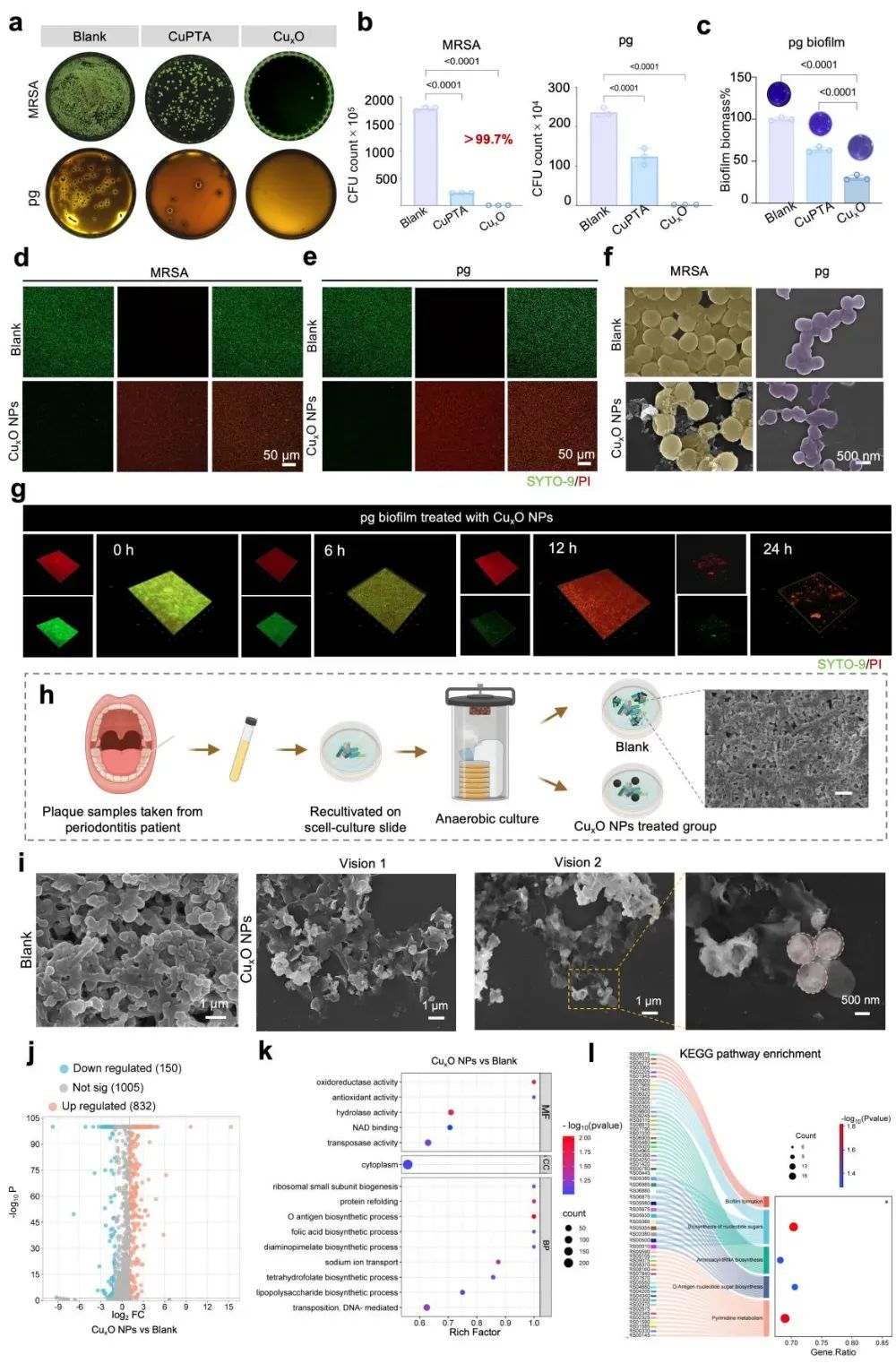
图3:CuxO NPs的抗菌性能分析(图源:Li et al.,Biomaterials. 2025)
中空介孔的独特结构赋予miR126@CuxO NPs作为基因递送载体的效能及其克服细胞膜和内体/溶酶体屏障能力。研究评估了FAM-miR126@CuxO NPs在人牙龈上皮细胞中的摄取效率,显示其递送效率超过80%,miR126@CuxO NPs通过内吞作用进入早期内体,随后在pH 5-6的酸化环境中形成晚期内体,最终与溶酶体融合,金属-多酚的pH响应性特性使单宁酸的酚羟基质子化,内体渗透性裂解,促进miRNA从内体逸出至细胞质发挥调控作用。LysoTracker共定位染色进一步证实,miR126@CuxO NPs在6小时内被内吞并进入溶酶体,12小时后逐渐逸出,钙黄绿素也显示内体膜破坏和细胞质释放,证明CuxO NPs有效保护miR126并显著提升其体内表达,为基因治疗提供了高效载体支持。
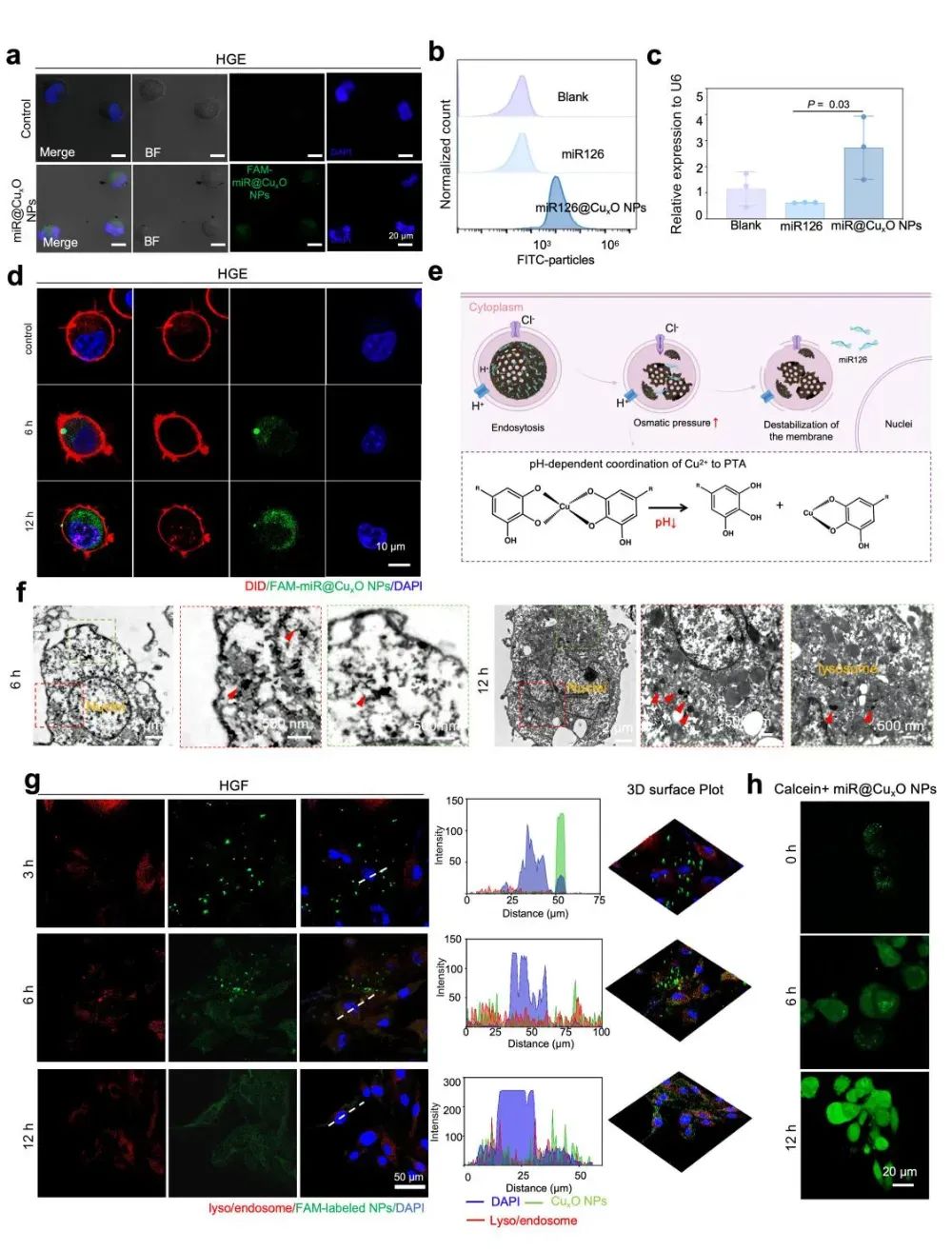
图4:miR126@CuxO NPs的基因递送性能分析(图源:Li et al.,Biomaterials. 2025)
为了进一步验证miR126的作用,作者通过基因表达分析发现,miR126显著下调了炎症相关基因的表达,同时促进了成骨细胞分化和血管生成,改善了牙周组织的微环境。与对照组相比,miR-126@CuxO NPs处理组的骨体积/组织体积比(BV/TV)显著提高,表明其在促进牙槽骨再生中的潜力。
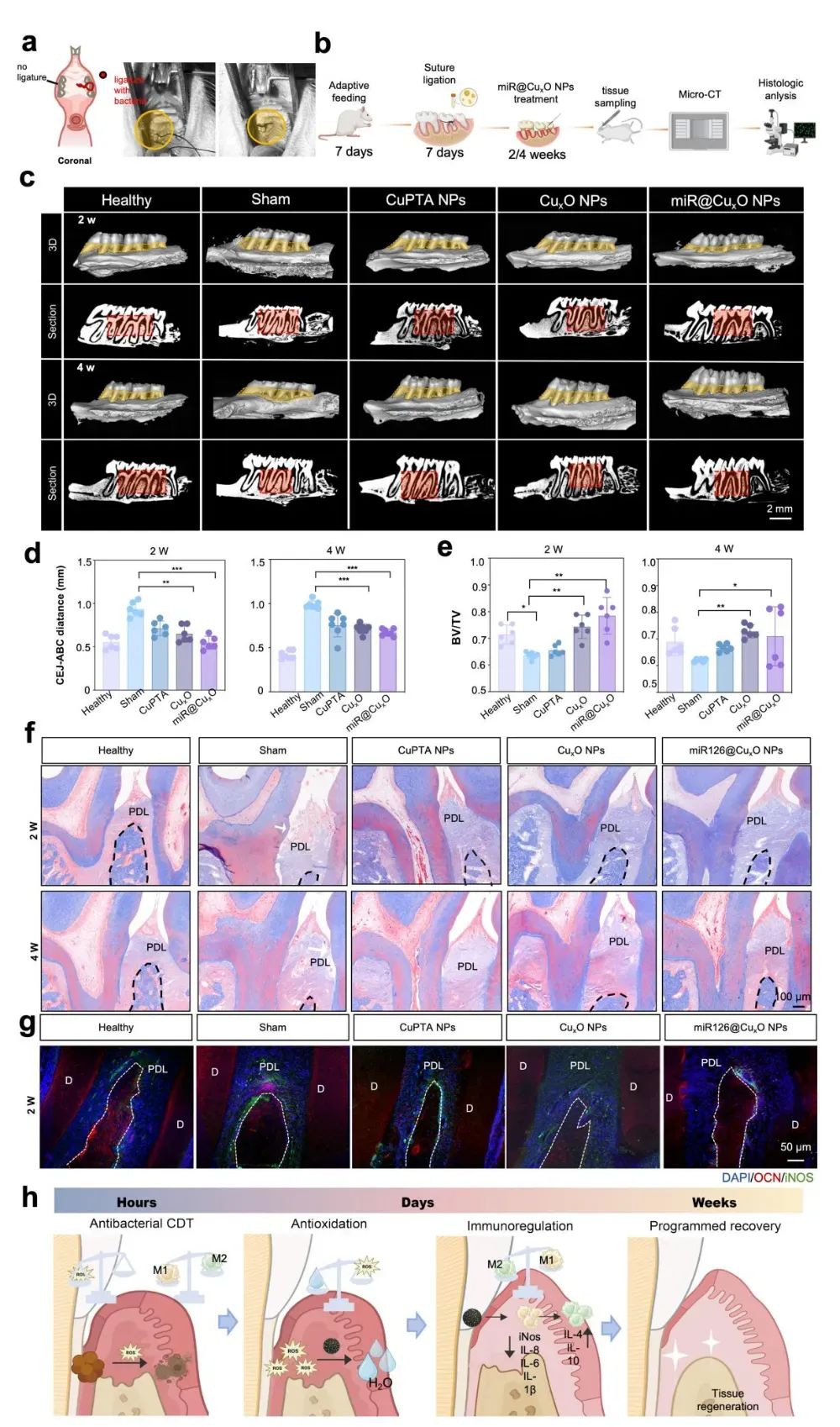
图5:miR126@CuxO NPs治疗牙周炎(图源:Li et al.,Biomaterials. 2025)
【文章讨论与结论,启发与展望】
本研究通过设计并合成miR126@CuxO NPs,展示了一种创新的金属多酚纳米粒在牙周炎治疗中的协同纳米基因疗法策略。miR126@CuxO NPs利用其独特的介孔中空结构和氧空位工程,不仅显著增强了类过氧化物酶抗菌活性,还通过miRNA126的递送实现了巨噬细胞从促炎性表型向促再生表型的转换,从而有效抑制炎症、破坏细菌生物膜并促进牙周组织再生。铜作为唯一活性金属,通过缺陷调控优化了催化性能,简化了合成过程,同时保持了固有抗菌与免疫调节特性,为牙周炎的综合治疗提供了新思路。未来研究将继续优化纳米粒子的设计与递送策略,以适应动态口腔环境,同时探索联合其他基因或生物活性因子,进一步扩展该纳米体系的治疗潜力。
中山大学附属口腔医院修复科滕伟教授和中山大学附属第一医院王琴梅教授为该论文的共同通讯作者,李栋颖博士研究生为本论文的第一作者。本研究受到国家自然科学基金、广东省自然科学基金等项目资助。
原文链接:
https://www.sciencedirect.com/unsupported_browser
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)