首页 > 医疗资讯/ 正文
肌萎缩侧索硬化(ALS)是一种以运动神经元选择性退化为特征的神经退行性疾病,其发病机制复杂且尚未完全阐明。近年来,NEK1基因作为ALS的风险基因被广泛研究,但其具体致病机制仍不清楚。本研究通过分析920名韩国散发性ALS患者的全外显子测序数据,发现16种NEK1变异存在于23名患者中,其中包括两种新型移码变异(p.E853Rfs9和p.D1112Efs50)、一个起始密码子变异(p.M1?)和一个同义剪接变异(p.Q132=)。这些变异通过功能缺失(LOF)机制导致NEK1表达减少或功能异常,进而引发纤毛功能障碍、细胞周期紊乱、微管乙酰化异常以及线粒体和DNA损伤修复缺陷,为ALS的病理机制提供了新的见解。

研究团队首先通过患者来源的成纤维细胞和诱导多能干细胞分化的运动神经元(iPSC-MNs)模型,系统评估了NEK1变异对纤毛结构和功能的影响。结果显示,携带NEK1 LOF变异(p.E853Rfs*9和p.M1?)和剪接变异(p.Q132=)的成纤维细胞在血清饥饿条件下表现出纤毛长度和频率的显著减少,同时伴有纤毛形态异常,如分支或扭曲。此外,这些变异还导致纤毛信号通路(如Shh信号)的破坏,表现为Smo蛋白在纤毛轴突中的定位减少以及下游转录因子GLI1的mRNA表达水平降低。相比之下,错义变异p.R91Q对纤毛发生的影响较小,表明其致病性较低。进一步的机制研究发现,NEK1变异通过激活钙离子依赖的Aurora A激酶(AurA)-组蛋白去乙酰化酶6(HDAC6)轴,促进纤毛解聚。细胞内钙离子水平的升高触发了AurA的磷酸化和HDAC6的激活,而钙离子螯合剂BAPTA的处理可以逆转这些异常表型。
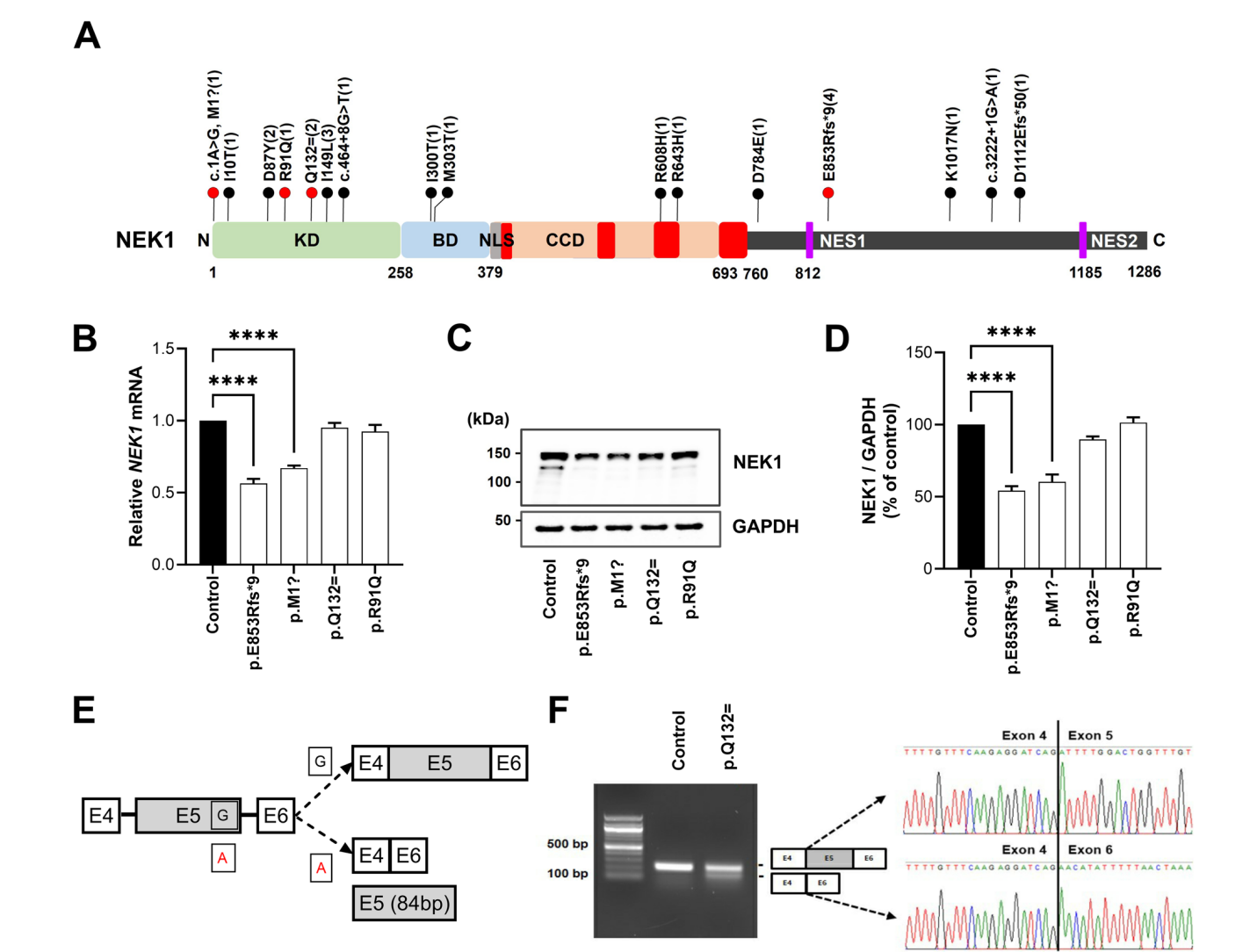
图1:通过外显子测序鉴定ALS患者的NEK1变异
除了纤毛功能障碍,NEK1变异还导致微管乙酰化水平降低和线粒体动力学异常。免疫染色和Western blot分析显示,患者成纤维细胞中乙酰化α-微管蛋白的表达显著减少,线粒体呈现碎片化分布,并伴有膜电位下降和细胞色素c的释放。透射电镜进一步证实了线粒体结构的异常,如嵴结构缺失和外膜破裂。此外,NEK1变异还损害了DNA损伤修复能力。在紫外线照射或依托泊苷处理后,携带NEK1变异的成纤维细胞中γH2AX焦点积累增加,且修复效率降低,同时伴随Chk1磷酸化减少和凋亡标志物cleaved caspase-3的表达升高。这些结果表明,NEK1通过多途径参与维持细胞稳态,其功能缺失可能导致运动神经元退行性变。
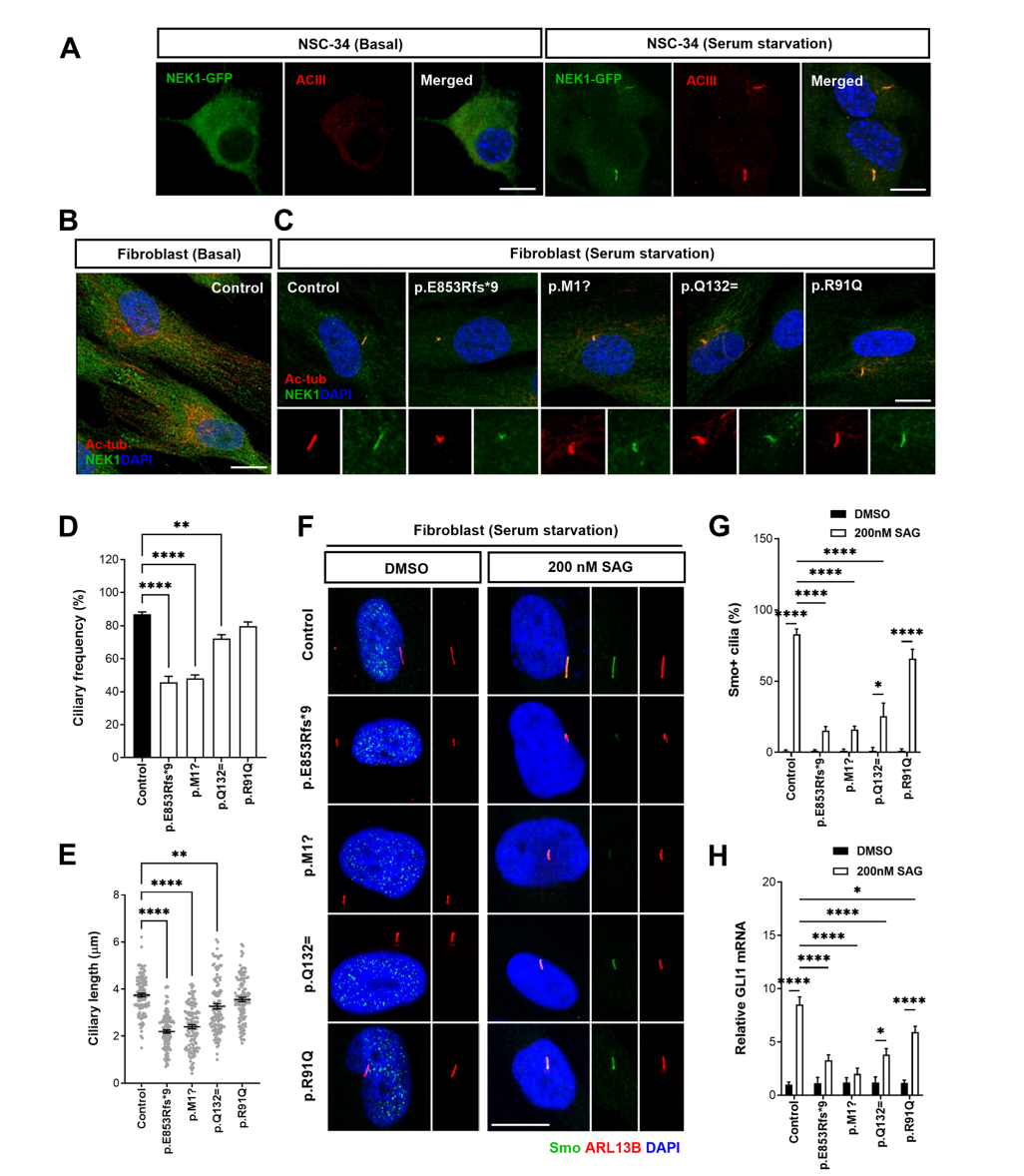
图2:ALS相关NEK1变异破坏纤毛发生和Shh信号传导
研究还探讨了HDAC6抑制剂tubastatin A(Tub-A)的治疗潜力。Tub-A处理显著恢复了NEK1 LOF成纤维细胞中微管乙酰化水平、纤毛长度和线粒体形态,并部分改善了DNA损伤修复缺陷。在iPSC-MNs模型中,NEK1敲低同样导致纤毛缩短、细胞周期调控蛋白表达异常以及神经元凋亡增加,而Tub-A处理能够逆转这些表型。这些发现为NEK1相关ALS的治疗提供了潜在靶点。
综上所述,本研究揭示了NEK1突变通过纤毛功能障碍、微管动力学异常和DNA损伤修复缺陷等多种机制参与ALS的发病过程。HDAC6抑制剂的治疗潜力为NEK1相关ALS的干预策略提供了新方向。
原始出处:
Noh, M.-Y., Oh, S.-I., Kim, Y.-E., et al. (2025). Mutations in NEK1 cause ciliary dysfunction as a novel pathogenic mechanism in amyotrophic lateral sclerosis. Molecular Neurodegeneration, 20(59). https://doi.org/10.1186/s13024-025-00848-7
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)