首页 > 医疗资讯/ 正文
阿尔茨海默症(AD)的发病机制复杂,包括β-淀粉样蛋白(Aβ)过度沉积、小胶质细胞功能障碍和神经炎症,单途径治疗不足以改善与AD相关的多方面病理变化。此外,血脑屏障(BBB)的低通透性和AD位点选择性的缺乏进一步限制了当前AD药物的干预效果。因此,理想的AD治疗策略应该能够有效克服BBB的阻碍,积极靶向AD病灶,同时对抗AD的多种病理。
基于此,湖南大学王青教授课题组通过将脑微血管内皮细胞外泌体和巨噬细胞外泌体的膜杂交,并结合聚多巴胺纳米颗粒、白藜芦醇和Aβ靶向适配体,构建了具有多重靶向能力的工程化外泌体(RPDA@Rb-A)来干预Aβ清除并调节小胶质细胞功能障碍。基于脑微血管内皮细胞外泌体的归巢效应和巨噬细胞外泌体天然的炎症靶向能力,RPDA@Rb-A可以轻松的穿过血脑屏障,并且在捕获Aβ聚集体后富集在大脑炎症部位。RPDA@Rb-A可通过多环节有效干预AD,包括通过近红外激光辐照引起的局部加热解聚有毒的Aβ聚集体,并减轻神经毒性;通过捕获Aβ促进小胶质细胞清除Aβ;通过高效递送小分子药物以调节小胶质细胞诱导的神经炎症(图1)。在AD小鼠模型中,RPDA@Rb-A的给药可显著缓解淀粉样斑块沉积、神经炎症和记忆障碍。基于膜杂交的工程化外泌体克服了传统药物载体对中枢神经系统渗透不良及靶向性不足的缺点,为多环节干预AD提供了潜在的平台。相关工作以“Multi-targeted engineered hybrid exosomes as Aβ nanoscavengers and inflammatory modulators for multi-pathway intervention in Alzheimer’s disease”为题发表在《Biomaterials》上。
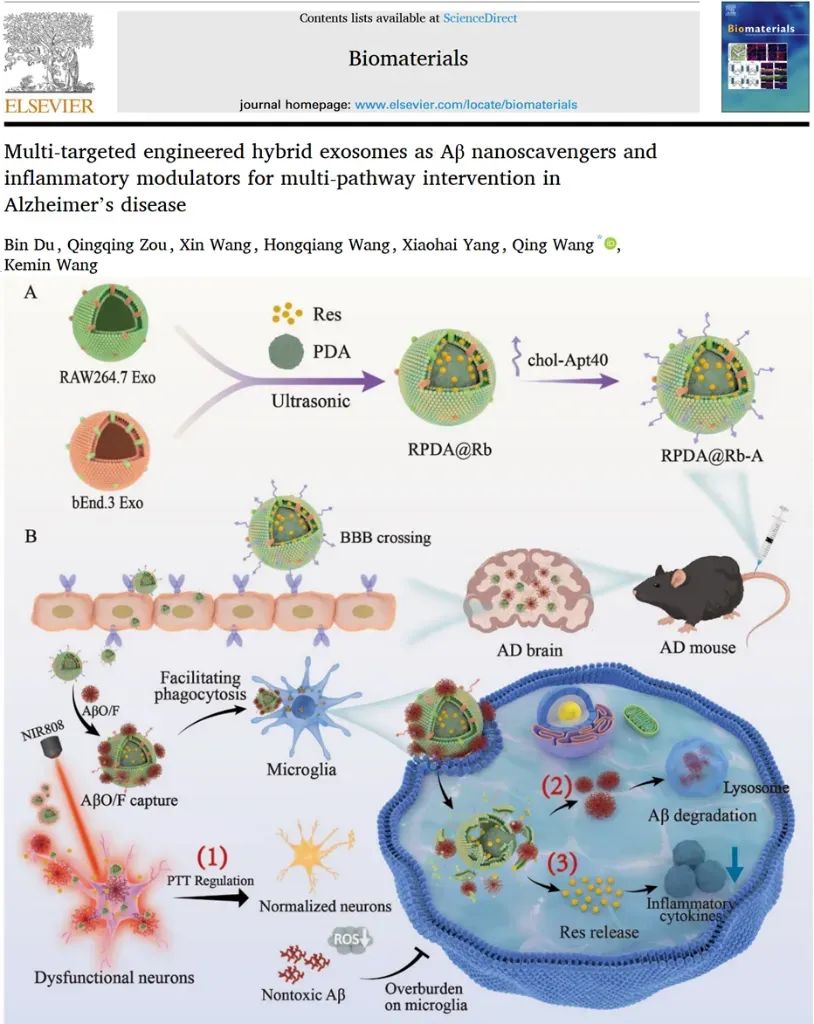
图1. RPDA@Rb-A的制备及多环节干预AD的示意图
【RPDA@Rb-A的体外免疫逃避和脑靶向能力】
为探究RPDA@Rb-A的体外免疫逃避和脑靶向能力,首先,通过激光共聚焦显微镜和流式细胞术观察到RPDA@Rb-A处理的巨噬细胞中的绿色荧光信号较弱且几乎无法检测到,表明RPDA@Rb-A具有逃避免疫系统监视的能力。接着,通过Transwell模型检测了RPDA@Rb-A的体外BBB穿透能力,结果表明RPDA@Rb-A继承了脑微血管内皮细胞外泌体的天然大脑归巢效应,具有很强的穿透BBB的能力。为了评估RPDA@Rb-A的炎症靶向性,研究了RPDA@Rb-A能否靶向活化的炎症细胞。结果表明,RPDA@Rb-A能在杂合外泌体包被的帮助下靶向炎症BV2细胞,继承了巨噬细胞外泌体的炎症嗜性,具有积极定位炎症病变部位的潜力(图2)。
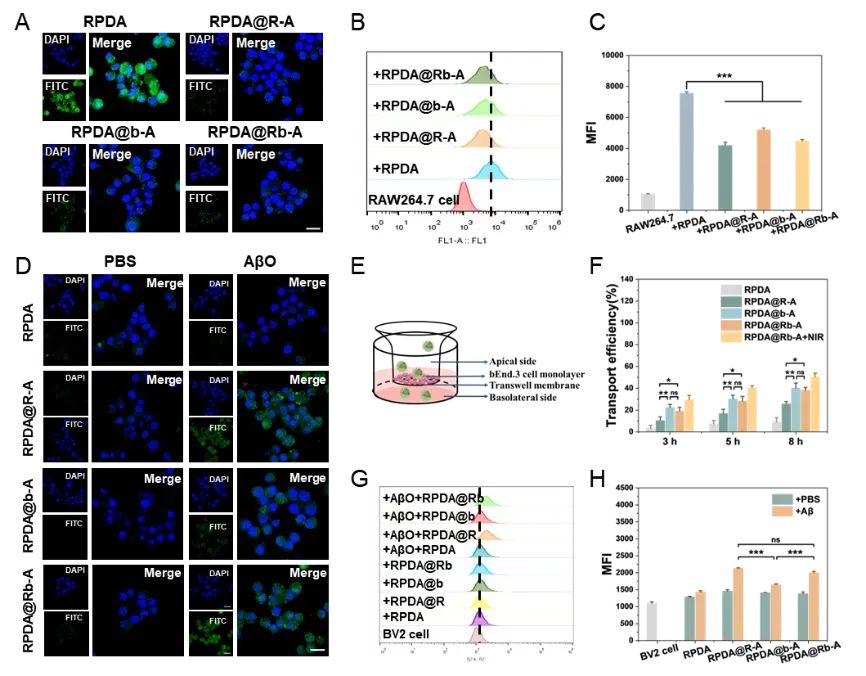
图2. RPDA@Rb-A的体外免疫逃避和脑靶向能力
【RPDA@Rb-A多环节干预AD的能力】
为探究RPDA@Rb-A的多环节干预AD的能力,首先,通过AFM和ThT荧光实验考察RPDA@Rb-A的光热性能对Aβ聚集体的解聚作用。结果表明RPDA@Rb-A可促使Aβ纤维在近红外光照作用下解聚。在Aβ聚集体诱导的AD细胞模型中,RPDA@Rb-A可在细胞水平解聚Aβ聚集体,有效清除细胞内的活性氧并减轻氧化应激引起的细胞损伤,起到了细胞保护的作用(图3)。接着,通过激光共聚焦显微镜研究RPDA@Rb-A对炎症小胶质细胞吞噬和降解Aβ功能的影响。发现用PDA@Rb-A处理的小胶质细胞中Aβ与溶酶体的共定位更强,表明RPDA@Rb-A可通过小胶质细胞的溶酶体途径促进Aβ清除(图4)。此外,通过激光共聚焦显微镜观察到RPDA@Rb-A处理的细胞中iNOS和活性氧表达显著降低,表明RPDA@Rb-A优越的炎症抑制作用(图5)。
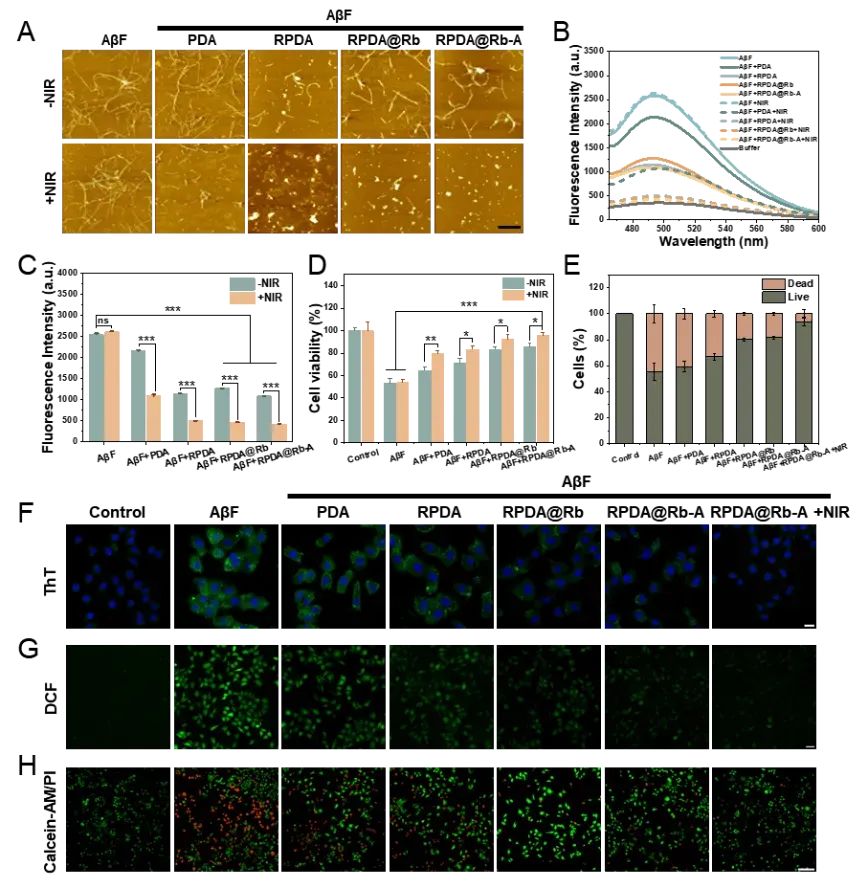
图3. RPDA@Rb-A解聚有毒的 Aβ 聚集体并减轻神经毒性
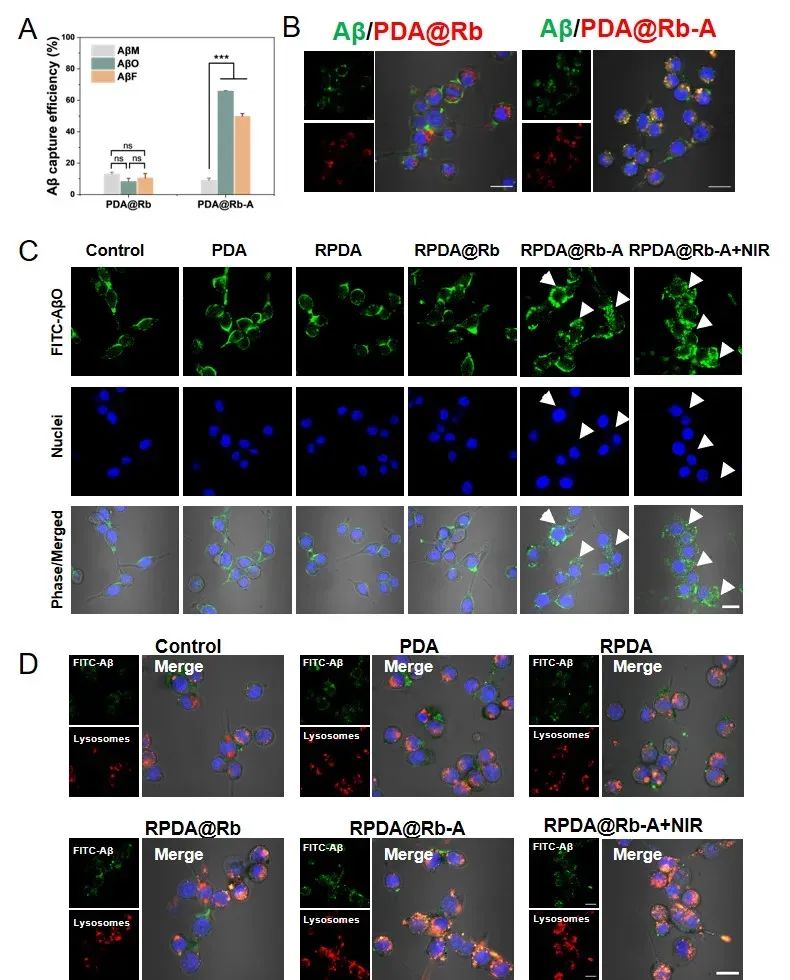
图4. RPDA@Rb-A促进小胶质细胞吞噬和降解Aβ
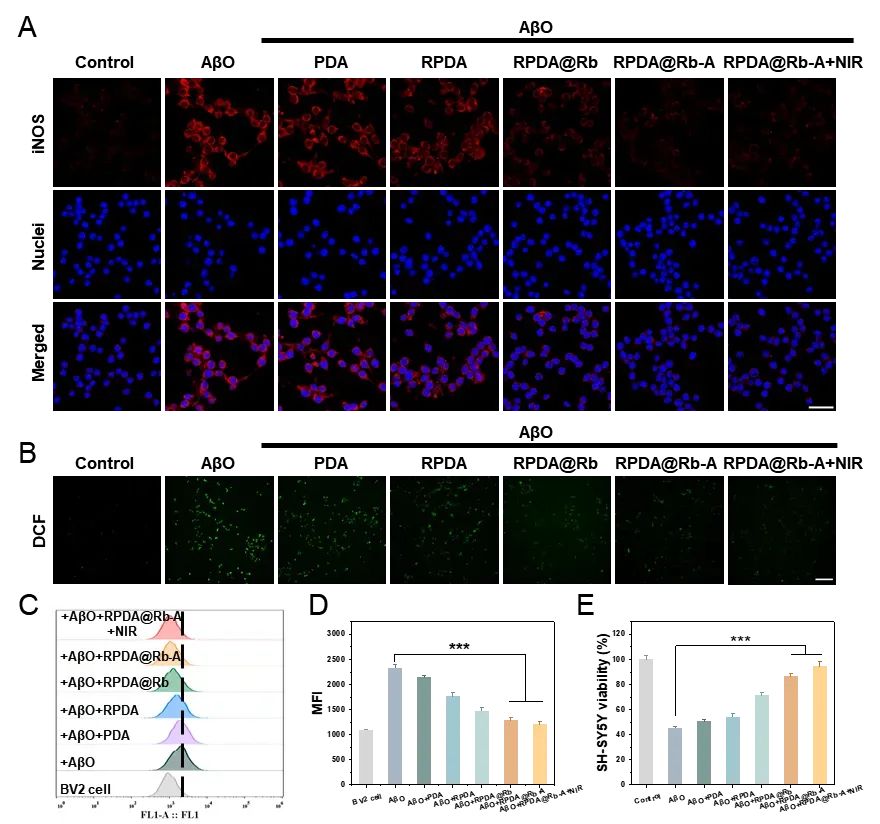
图5. RPDA@Rb-A减轻Aβ聚集体诱导的小胶质细胞炎症反应
【RPDA@Rb-A的体内脑靶向能力】
为了考察RPDA@Rb-A的体内治疗潜力,通过红外热成像仪观察到RPDA@Rb-A处理小鼠的头部温度在10 min内显著升高,表明RPDA@Rb-A在体内具有优异的光热转换能力。为探究RPDA@Rb-A在体内的生物分布,将Cy5标记的RPDA和RPDA@Rb-A经尾静脉注射给小鼠,通过小动物活体成像仪观察到RPDA@Rb-A在大脑中的积累高于RPDA,表明外泌体的涂层增强了RPDA@Rb-A的大脑靶向能力,并且NIR照射可以进一步增加RPDA@Rb-A在大脑中的富集(图6)。
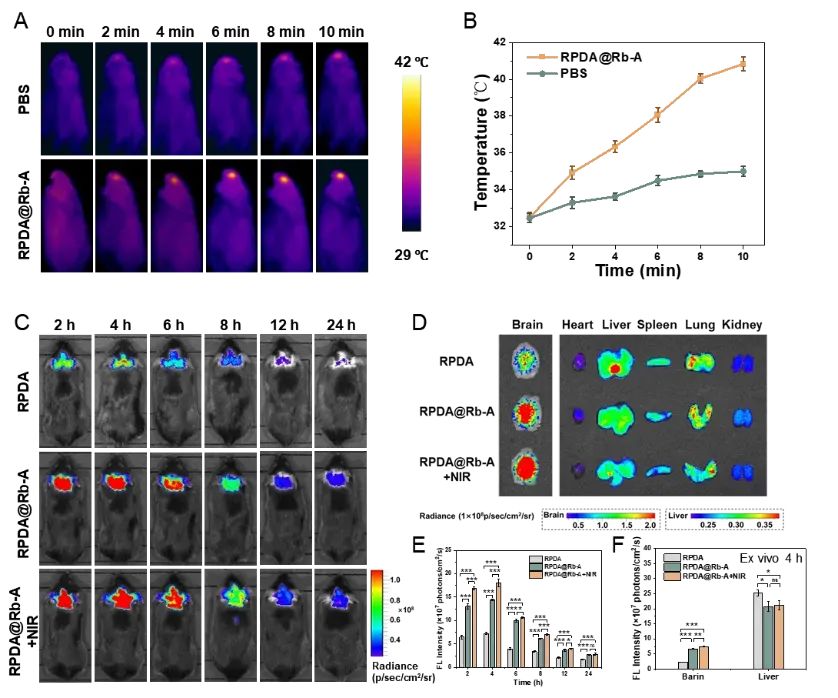
图6. RPDA@Rb-A的体内脑靶向能力
【RPDA@Rb-A的体内治疗效果】
为了探究RPDA@Rb-A对AD小鼠的体内治疗效果,首先,通过莫里斯水迷宫评估AD小鼠的记忆能力。观察到RPDA@Rb-A+NIR处理组小鼠在目标象限中游泳的时间更长,寻找隐藏平台的时间更短,平台穿越次数增加。接着,通过Aβ、lba-1和iNOS免疫荧光染色观察到,用RPDA@Rb-A+NIR治疗的AD小鼠的Aβ斑块数量减少,lba-1和iNOS的表达显著降低。这些结果表明,RPDA@Rb-A给药可有效缓解AD小鼠大脑中的Aβ负荷、神经炎症和记忆障碍(图7)。
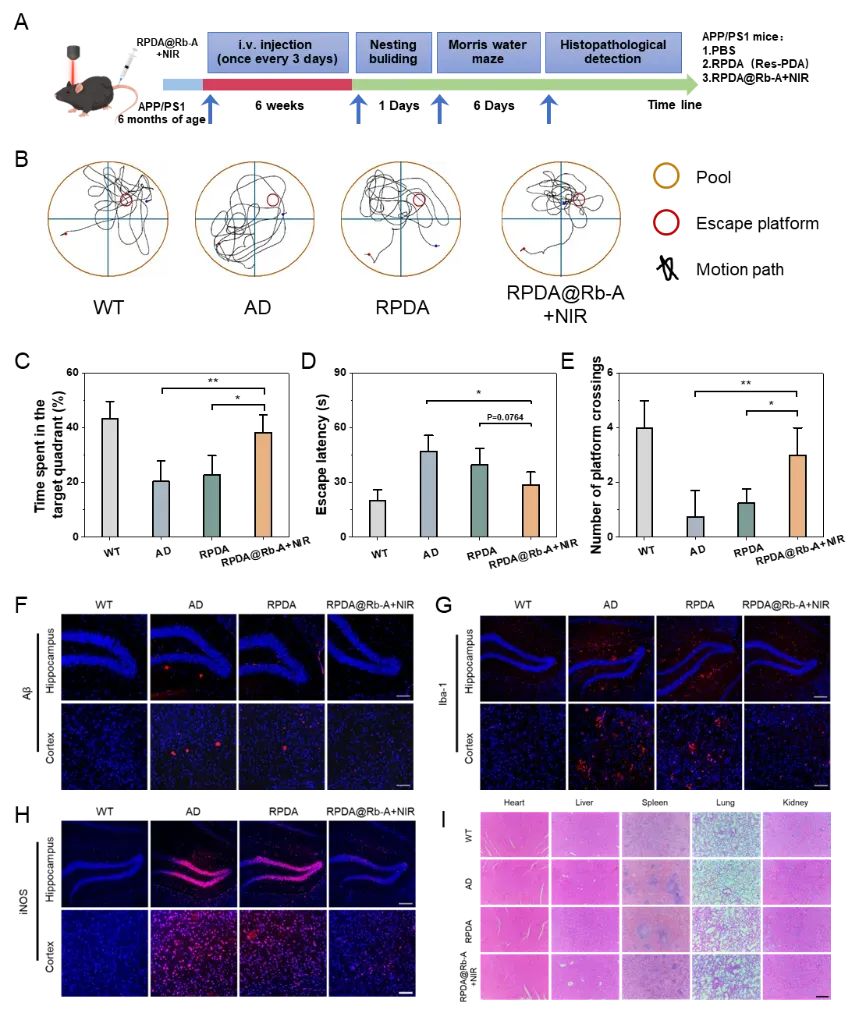
图7. RPDA@Rb-A的体内治疗效果
【文章结论与讨论,启发与展望】
综上所述,本研究提供了一种基于脑微血管内皮细胞外泌体和巨噬细胞外泌体杂交的多重靶向工程化外泌体(RPDA@Rb-A)用于AD的多环节干预。与合成的纳米颗粒载体(RPDA)相比,经杂交外泌体改造后的RPDA@Rb-A具有逃避巨噬细胞吞噬的能力,实现了BBB的有效渗透和在AD病灶中的选择性积累。体外和体内研究表明,RPDA@Rb-A通过加速小胶质细胞吞噬作用和光热解聚Aβ聚集体有效降低Aβ负荷,抑制小胶质细胞神经炎症,并挽救AD小鼠的记忆缺陷。总的来说,本研究构建的具有多重靶向和多环节干预能力的工程化外泌体在治疗AD方面具有巨大潜力,为工程化外泌体在AD和其他神经退行性疾病治疗中的应用奠定了系统和科学的基础。
原文链接:
https://www.sciencedirect.com/unsupported_browser
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)