首页 > 医疗资讯/ 正文
HBV感染是全球性的公共卫生问题,根据世界卫生组织发布的数据,全球约有2.57亿慢性HBV感染者,每年约88.7万人死于HBV感染所致的失代偿期肝硬化、肝衰竭、原发性肝癌等终末期肝病。根据我国2014年乙型肝炎血清流行病学调查结果估算,我国普通人群HBsAg流行率为5%~6%,仍有约7 000万慢性HBV感染者,2 000万~3 000万慢性乙型肝炎患者。虽然我国乙型肝炎相关肝病年病死人数从2016年的22.9万人降至2019年的16.2万人,年龄标准化病死率平均每年降低4.92%,但要实现世界卫生组织提出的“2030年消除病毒性肝炎威胁”的目标仍存在巨大挑战。
HBV后可导致不同的临床结局,包括急性乙型肝炎、慢性乙型肝炎。慢性HBV感染自然史包括:免疫耐受期、免疫清除期、免疫控制期、再活动期。《慢性乙型肝炎防治指南(2022年版)》更新后,将免疫控制期定义为HBeAg阴性慢性HBV感染,即:HBsAg阳性但低于1 000 IU/mL、HBeAg阴性、HBV DNA持续未检出、ALT和AST水平持续正常、影像学检查无肝硬化征象、肝病理学检查无或仅有轻度炎症并可有不同程度的纤维化。由于HBeAg阴性慢性HBV感染者中HBsAg持续阳性,患者病情可发生进展,肝病相关死亡风险和原发性肝细胞癌发生风险分别是健康人群的2.1倍和4.6倍。HBeAg阴性慢性HBV感染者接受聚乙二醇干扰素α-2b(PEG-IFN-α-2b)治疗的有效性和安全性均良好,PEG-IFN-α-2b单药治疗72周时,84.2%(16/19)的HBeAg阴性慢性HBV感染者发生HBsAg阴转,68.4%(13/19)患者发生HBsAg血清学转换,所有患者均未发生治疗相关严重不良事件。既往有研究发现,慢性乙型肝炎患者接受替诺福韦酯抗病毒治疗过程中,随着病毒载量下降,HBV特异性CD8+T淋巴细胞杀伤功能显著增强,且与HBeAg阴转密切相关。但有关HBeAg阴性慢性HBV感染者抗病毒治疗过程中HBV特异性CD8+T淋巴细胞功能的变化罕见报道。因此,本研究观察了PEG-IFN-α-2b治疗后HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞功能的变化,探寻抗病毒治疗对宿主细胞免疫的影响。
1资料与方法
1.1 研究对象
选取2020年4月—2022年6月于新乡医学院第一附属医院和空军军医大学唐都医院就诊的HBeAg阴性慢性HBV感染者53例。入选标准:(1)年龄18~60岁;(2)入组前1年内未接受抗病毒治疗和/或免疫调节治疗;(3)HBsAg阳性但低于1 000 IU/mL、HBeAg阴性;(4)HBV DNA<100 IU/mL;(5)ALT和AST水平正常;(6)影像学无肝硬化征象。排除标准:(1)合并其他肝炎病毒和/或HIV感染;(2)合并肝硬化、肝衰竭、原发性肝癌等终末期肝病;(3)合并酒精性肝病、药物性肝损伤等其他肝脏疾病;(4)合并自身免疫性疾病;(5)合并恶性肿瘤;(6)合并重要脏器(脑、肺、心脏、肾脏)功能不全;(7)妊娠期及哺乳期女性。
所有患者接受PEG-IFN-α-2b(厦门特宝生物工程股份有限公司)180 μg/周皮下注射治疗,并在基线、12周、24周、48周时分别进行常规采血随访,评估安全性和治疗应答情况,随访观察最长48周,在基线和研究终点(对于疗程<48周患者,HBsAg阴转定义为研究终点,对于疗程≥48周患者,PEG-IFN-α-2b治疗48周定义为研究终点)额外采集20 mL静脉血。
1.2 研究方法
1.2.1 试剂和仪器
人淋巴细胞分离液购自北京索莱宝生物技术公司;CD8+T淋巴细胞分选试剂盒购自德国美天旎公司;抗CD3/CD4/CD8荧光标记抗体、小鼠抗人CD8-FITC、小鼠抗人Fas配体(FasL)-PE、小鼠抗人肿瘤坏死因子相关凋亡诱导配体(TRAIL)-APC购自美国BD公司;抗穿孔素抗体、抗颗粒酶B抗体、抗IFN-γ抗体购自美国Abcam公司;酶联免疫吸附试验(ELISA)试剂盒购自武汉华美生物技术公司;乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自武汉碧云天公司;HBV核酸测定试剂盒(PCR-荧光探针法)购自广州达安基因股份有限公司(定量线性范围:100~5×108 IU/mL)Transwell培养平板购自美国康宁公司;Trucount绝对计数管购自美国BD公司。FACS Calibur流式细胞仪为美国BD公司产品;酶联免疫斑点试验(ELISPOT)读板仪为德国AID公司产品;酶标仪为美国伯乐公司产品。
1.2.2 外周血单个核细胞(PBMC)分离
于清晨、空腹采集外周静脉血20 mL,乙二胺四乙酸二钠抗凝,2 h内使用人淋巴细胞分离液、采用密度梯度离心法分离PBMC,冻存于-80 ℃备用。
1.2.3 CD8+T淋巴细胞的纯化
使用CD8+T淋巴细胞分选试剂盒纯化PBMC中的CD8+T淋巴细胞。取107个PBMC,4 ℃、400 r/min离心10 min,弃上清后加入40 μL缓冲液重悬细胞,再加入10 μL生物素标记的抗体鸡尾酒(包含抗人CD4、CD15、CD16、CD19、CD34、CD36、CD56、CD123、TCRγ/δ、CD235a抗体),4 ℃孵育5 min后,加入30 μL缓冲液和20 μL CD8+T淋巴细胞磁珠抗体鸡尾酒(包含抗人CD14、CD61、抗生物素抗体),4 ℃孵育10 min。将分离柱使用缓冲液充分浸润,置于磁力分离架上,将上述细胞悬液加入分离柱中,使细胞在重力作用下穿过分离柱,收集穿过分离柱的细胞即为纯化的CD8+T淋巴细胞。
1.2.4 CD8+T淋巴细胞与HepG2.2.15细胞共培养系统的建立
选择17例HLA-A*02限制性HBeAg阴性慢性HBV感染者(治疗结束时7例发生HBsAg阴转、10例未发生HBsAg阴转)的CD8+T淋巴细胞,与HepG2.2.15细胞建立共培养系统。直接接触共培养系统:2×105个CD8+T淋巴细胞与106个HepG2.2.15细胞直接混合培养,向培养液中加入HBV C基因型核心区多肽库(上海生工生物工程技术公司合成),每条多肽含有15个氨基酸,每条多肽之间有5个氨基酸重叠,共包含41条多肽,每条多肽的终浓度均为10 μg/mL。间接接触共培养系统:使用Transwell培养平板进行培养,将2×105个CD8+T淋巴细胞置于上层小室,106个HepG2.2.15细胞置于下层平板,两种细胞被直径为0.4 μm的滤膜分隔,仅可溶性细胞因子可穿过,向上层小室中加入HBV C基因型核心区多肽库。培养48 h后收集细胞和上清。
1.2.5 外周血T淋巴细胞计数检测
向Trucount绝对计数管中加入20 μL抗CD3/CD4/CD8荧光标记抗体和50 μL抗凝全血,避光孵育15 min。加入450 μL流式检测专用红细胞裂解液,孵育45 min后使用FACS Calibur流式细胞仪获取细胞,使用MultiSET软件对CD3+、CD4+、CD8+T淋巴细胞进行绝对计数。
1.2.6 ELISPOT检测穿孔素、颗粒酶B、IFN-γ的HBV特异性CD8+T淋巴细胞频数
设立阳性对照组(植物血凝素,10 μg/mL)、阴性对照组(不加入刺激物)、实验组(加入HBV C基因型核心区多肽库,10 μg/mL),每组设立2个复孔。分别用抗穿孔素抗体、抗颗粒酶B抗体、抗IFN-γ抗体(0.5 μg/mL)各100 μL包被96孔板,4 ℃孵育过夜,刺激洗板、封闭。加入2×105个PBMC,并加入相关刺激原,终体积200 μL,37 ℃、5% CO2条件下培养16 h,洗板后每孔加入100 μL生物素标记的抗穿孔素抗体、抗颗粒酶B抗体、抗IFN-γ抗体,室温孵育1 h,洗板后每孔加入100 μL碱性磷酸酶标记的链球菌亲和素,室温避光孵育45 min,洗板后加入显色液,室温避光孵育15 min后加入终止液。使用ELISPOT读板仪读取斑点数,每一个斑点代表一个分泌细胞,计数斑点形成细胞(SFC)数,结果记录为“实验组SFC-阴性对照组SFC”,以“SFC/106个PBMC”为单位,分析产生穿孔素、颗粒酶B、IFN-γ的细胞数。
1.2.7 ELISA检测培养上清中穿孔素、颗粒酶B、IFN-γ、TNF-α水平
向检测孔中加入上清液和倍比稀释的标准品各100 μL,同时设立空白对照,覆膜后37 ℃孵育1.5 h。弃液体,甩干,不洗涤,每孔中加入生物素化抗体工作液100 μL,覆膜后37 ℃孵育1 h。弃液体后洗涤5次,每孔中加入辣根过氧化物酶结合物工作液100 μL,覆膜后37 ℃孵育30 min。弃液体后洗涤5次,每孔中加入底物溶液90 μL,覆膜后37 ℃避光孵育15 min。每孔中加入终止液50 μL。立即使用酶标仪测定450 nm波长处的吸光度(A),根据标准品的A值绘制标准曲线,计算待测因子浓度。
1.2.8 靶细胞死亡检测
通过检测上清中LDH水平计算靶细胞死亡率。使用LDH细胞毒性检测试剂盒(武汉碧云天公司)检测培养上清中LDH水平,以HepG2.2.15细胞培养上清中LDH水平作为“低水平对照”(A低水平),以Triton X-100处理的HepG2.2.15细胞培养上清中LDH水平作为“高水平对照”(A高水平)。应用如下公式计算靶细胞死亡率=(A实验-A低水平)/(A高水平-A低水平)×100%。
1.2.9 流式细胞术检测CD8+T淋巴细胞中FasL和TRAIL表达
收集培养细胞,转入流式检测管中,洗涤后加入小鼠抗人CD8-FITC、小鼠抗人FasL-PE、小鼠抗人TRAIL-APC各5 μL,避光孵育30 min,洗涤2次后加入含有4%多聚甲醛的磷酸盐缓冲液固定,使用FACS Calibur流式细胞仪获取细胞,使用FlowJo软件分析结果。
1.2.10 HBV DNA定量检测
使用HBV核酸测定试剂盒(PCR-荧光探针法)对上清中HBV DNA进行检测。使用试剂盒中提供的DNA提取液Ⅰ提取上清中的DNA,将提取的20 μL DNA直接加入HBV-PCR反应管中,进行PCR反应。反应条件:93 ℃ 2 min,1个循环,93 ℃ 45 s、55 ℃ 1 min,10个循环,93 ℃ 30 s、55 ℃ 45 s,30个循环。反应结束后获得扩增曲线,分析结果。
2结果
2.1 一般资料和安全性分析
纳入53例HBeAg阴性慢性HBV感染者,男42例,女11例,平均年龄(28.81±8.64)岁,年龄范围18~60岁。所有患者HBsAg均低于1 000 IU/mL [269.72(92.90~430.08) IU/mL],ALT水平为(23.23±8.27)U/mL,AST水平为(28.51±7.91)U/mL。在研究终点时,30.19%(16/53)患者实现HBsAg阴转,其中2例患者在24周实现HBsAg阴转,14例患者在48周实现HBsAg阴转,3例患者发生HBsAg血清学转换。
PEG-IFN-α-2b治疗整体安全性良好,未发生严重不良事件,98.11%(52/53)的患者在治疗过程中出现发热症状,92.45%(49/53)的患者出现白细胞和/或血小板水平降低,90.57%(48/53)的患者出现ALT和/或AST水平升高,未发生因不良反应所导致停药发生。
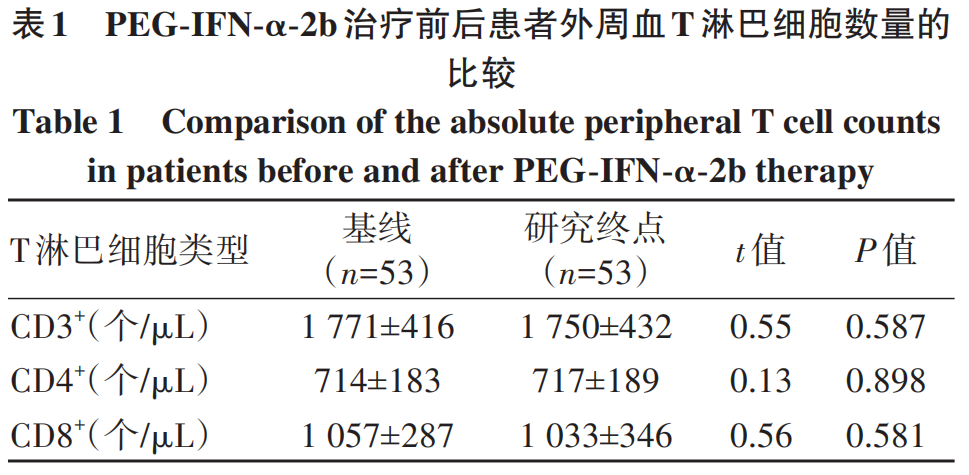
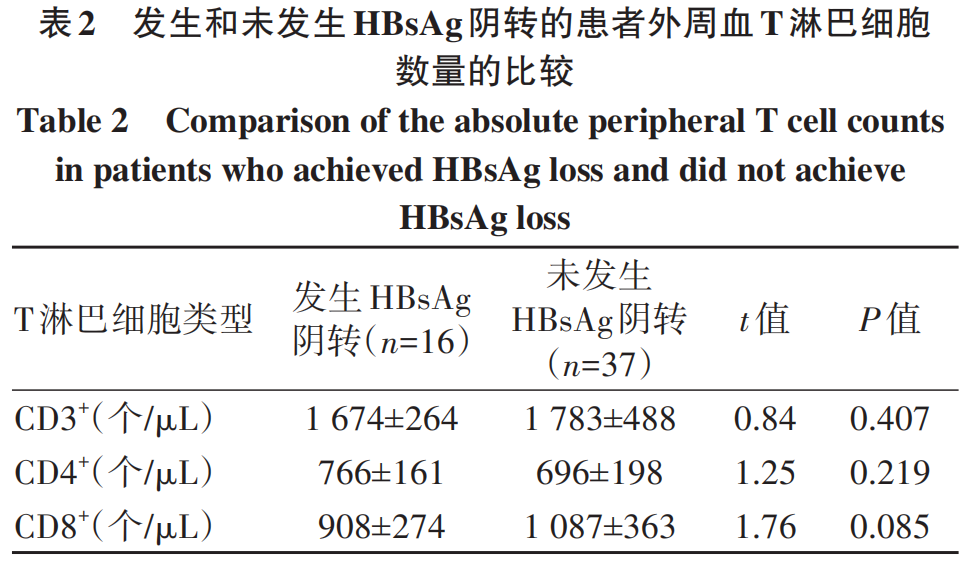
2.2 PEG-IFN-α-2b治疗对外周血T淋巴细胞数量的影响
CD3+、CD4+、CD8+T淋巴细胞数量在基线和研究终点时,差异均无统计学意义(P值均>0.05)(表1)。CD3+、CD4+、CD8+T淋巴细胞数量在研究终点时,发生HBsAg阴转和未发生HBsAg阴转的患者间差异亦均无统计学意义(P值均>0.05)(表2)。
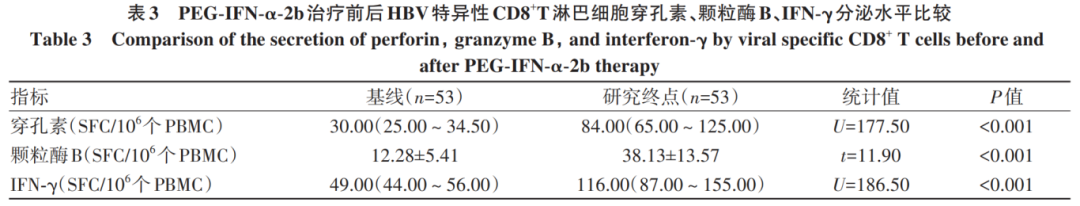
2.3 PEG-IFN-α-2b治疗对HBV特异性CD8+T淋巴细胞分泌穿孔素、颗粒酶B、IFN-γ的影响
在研究终点时,HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞分泌穿孔素、颗粒酶B、IFN-γ的水平较基线时均显著升高(P值均<0.001)(表3)。在研究终点时,发生HBsAg阴转的HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞分泌穿孔素、颗粒酶B、IFN-γ的水平均显著高于未发生HBsAg阴转患者(P值均<0.01)(表4)。

2.4 PEG-IFN-α-2b治疗对HBV特异性CD8+T淋巴细胞杀伤功能的影响
无论是基线还是研究终点,直接接触共培养系统中HBV特异性CD8+T淋巴细胞诱导靶细胞死亡的比例、上清中穿孔素和颗粒酶B的水平均显著高于间接接触共培养系统(P值均<0.05),但HBV DNA、IFN-γ和TNF-α水平在直接接触与间接接触共培养系统之间的差异均无统计学意义(P值均>0.05)(表5)。在直接接触共培养系统中,研究终点时,HBV特异性CD8+T淋巴细胞诱导靶细胞死亡的比例高于基线(P=0.030),上清中HBV DNA水平显著低于基线(P<0.001),上清中穿孔素、颗粒酶B、IFN-γ和TNF-α水平均显著高于基线(P值均<0.05)。在间接接触共培养系统中,研究终点时上清中HBV DNA水平显著低于基线(P<0.001),上清中IFN-γ和TNF-α水平显著高于基线(P值均<0.05)。直接接触和间接接触共培养系统中,基线和研究终点时CD8+T淋巴细胞中FasL和TRAIL表达的典型流式分析图见图1。无论在直接接触还是间接接触共培养系统中,CD8+T淋巴细胞中FasL和TRAIL的平均荧光强度(MFI)在基线与研究终点时的差异均无统计学意义(P值均>0.05)(表5)。
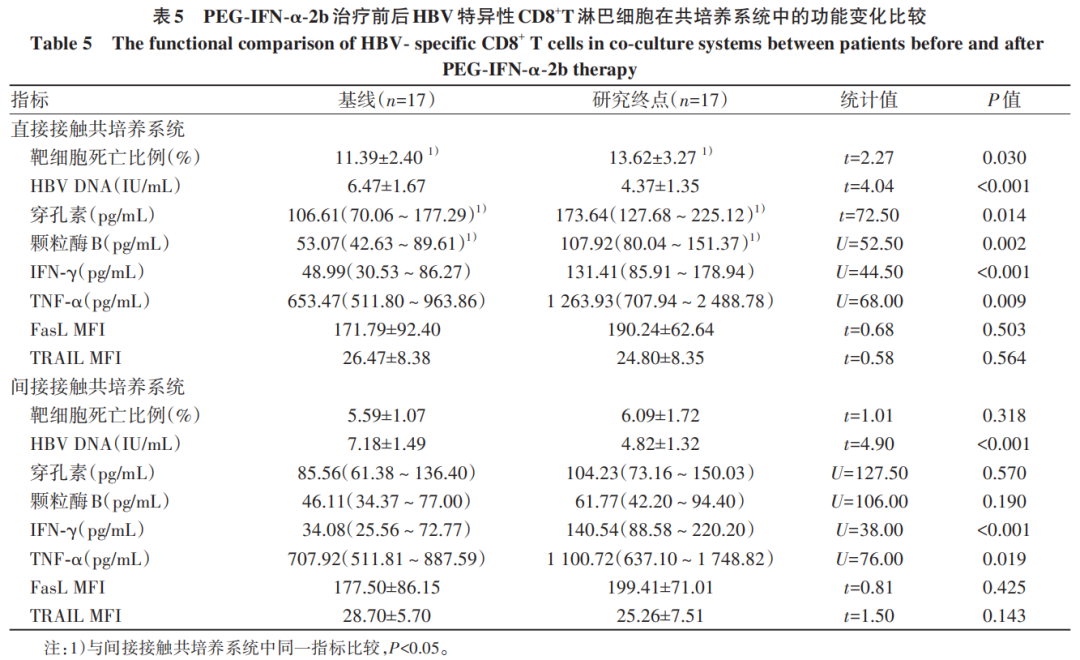
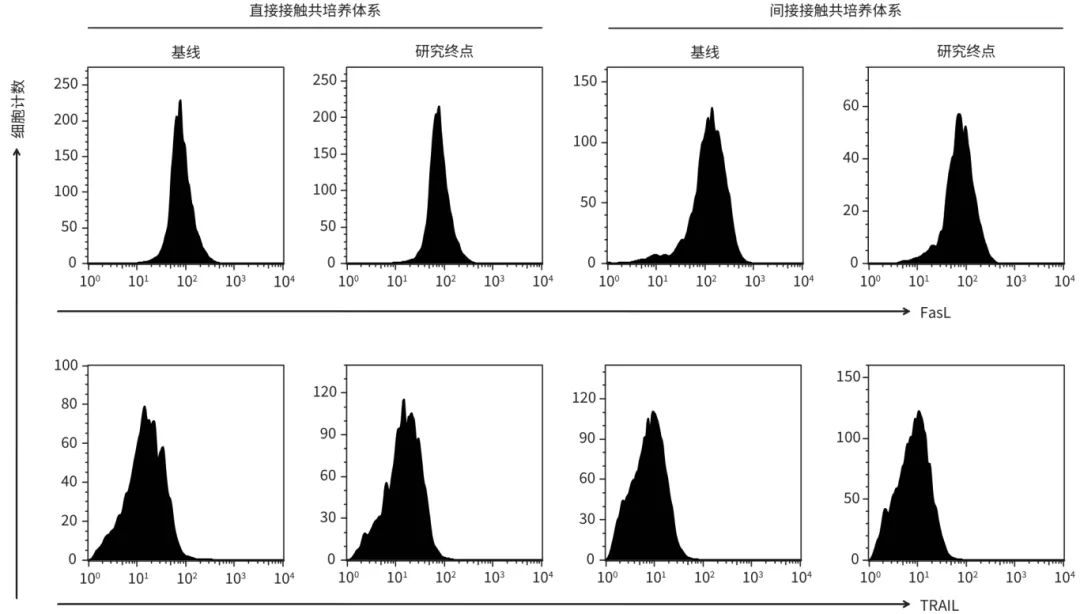
图1 CD8+T淋巴细胞中FasL和TRAIL表达的典型流式分析图
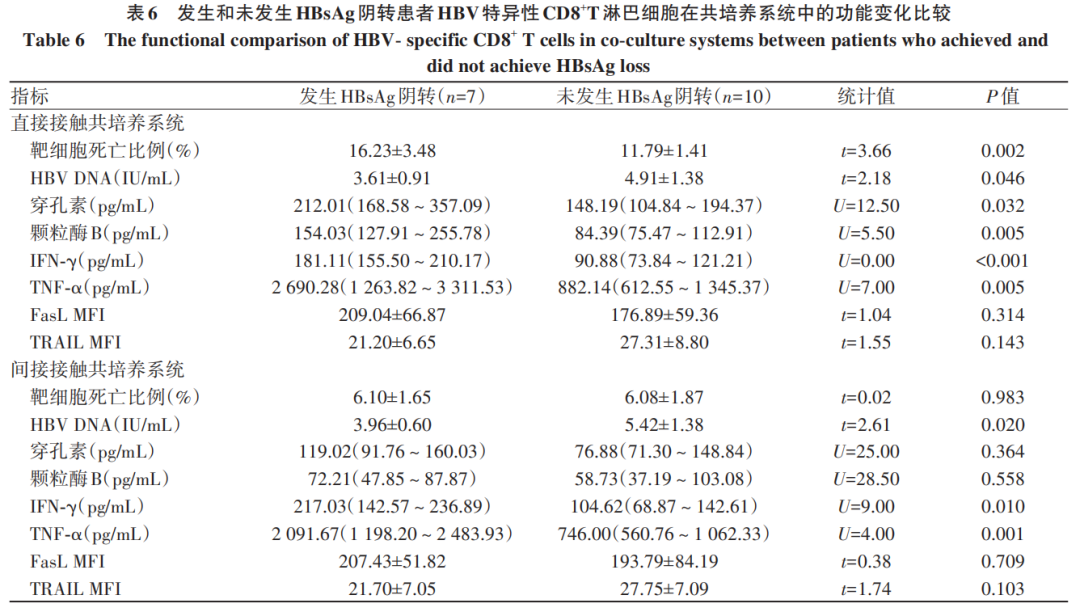
在直接接触共培养系统中,研究终点时,发生HBsAg阴转的患者HBV特异性CD8+T淋巴细胞诱导靶细胞死亡的比例高于未发生HBsAg阴转患者(P=0.002),上清中HBV DNA水平显著低于未发生HBsAg阴转患者(P=0.046),上清中穿孔素、颗粒酶B、IFN-γ和TNF-α水平均显著高于未发生HBsAg阴转患者(P值均<0.05)。在间接接触共培养系统中,研究终点时,发生HBsAg阴转的患者上清中HBV DNA水平显著低于未发生HBsAg阴转患者(P=0.020),上清中IFN-γ和TNF-α水平显著高于未发生HBsAg阴转患者(P值均<0.05)。无论在直接接触还是间接接触共培养系统中,CD8+T淋巴细胞中FasL和TRAIL的MFI在发生HBsAg阴转与未发生HBsAg阴转患者的差异均无统计学意义(P值均>0.05)(表6)。
3讨论
HBV特异性CD8+T淋巴细胞是机体清除病原体感染的重要免疫细胞之一,但慢性病毒感染中存在CD8+T淋巴细胞功能衰竭,诱发机体免疫耐受,无法有效清除病原体,导致感染慢性化。IFN-α具有抗病毒和免疫调节的双重作用,在优势人群中可实现持续免疫控制,实现HBsAg阴转和HBsAg血清学转换,进而实现慢性乙型肝炎功能性治愈。印度的一项研究发现,HBeAg阴性的慢性乙型肝炎患者在实现病毒学应答后停用核苷(酸)类似物(NUC)治疗,40%(22/55)的患者在6个月内出现肝炎复发(HBV DNA≥2 000 IU/mL且ALT≥2倍正常值上限),对复发患者使用PEG-IFN-α-2b治疗48周后约27%(6/22)患者实现HBsAg阴转,伴有CD8+T淋巴细胞、B淋巴细胞和趋化因子分泌增多,HBV特异性T淋巴细胞分泌IFN-γ、TNF-α和IL-21水平升高,表明PEG-IFN-α-2b治疗可增强慢性乙型肝炎患者HBV特异性T淋巴细胞活性。表达免疫检查点分子淋巴细胞活化基因-3(LAG3)的红系祖细胞可通过LAG3和转化生长因子β介导的信号通路抑制抗原提呈细胞功能,进而抑制HBV特异性CD8+T淋巴细胞活性,导致慢性乙型肝炎患者对PEG-IFN-α-2b治疗应答不佳。亦有研究发现,对于NUC经治患者换用PEG-IFN-α治疗后,19.88%(33/166)发生病毒学突破,发生病毒学突破的患者主要表现为单核细胞中Toll样受体2表达降低、HBV特异性CD8+T淋巴细胞中程序性死亡受体-1表达升高,机体免疫功能不全可能是造成NUC经治患者换用PEG-IFN-α后疗效不佳的重要原因之一。为此,有学者提出,对于PEG-IFN-α-2b治疗应答不佳的患者,序贯小剂量IL-2治疗24周可增加HBV特异性CD8+T淋巴细胞的频数和功能,促进HBeAg血清学转换,改善临床结局。因此,HBV特异性CD8+T淋巴细胞的功能与慢性乙型肝炎患者PEG-IFN-α-2b治疗的应答情况密切相关。HBeAg阴性慢性HBV感染者亦存在HBV特异性CD8+T淋巴细胞功能衰竭,但有关HBeAg阴性慢性HBV感染者接受PEG-IFN-α-2b治疗后HBV特异性CD8+T淋巴细胞功能变化的研究较少。
本研究纳入53例HBeAg阴性慢性HBV感染者,接受PEG-IFN-α-2b治疗,最长随访观察周期为48周,结果发现,研究终点时HBsAg阴转率为30.19%(16/53),这与既往HBeAg阴性慢性HBV感染者接受PEG-IFN-α-2b治疗48周时HBsAg阴转率相似,治疗过程中未发生治疗相关的严重不良事件,表明PEG-IFN-α-2b治疗HBeAg阴性慢性HBV感染者的有效性和安全性均良好。本研究结果显示,HBeAg阴性慢性HBV感染者外周血CD3+、CD4+、CD8+T淋巴细胞计数在基线和治疗结束时并无统计学差异,这与既往Zhu等研究发现慢性乙型肝炎患者接受PEG-IFN-α-2a治疗52周时CD3+、CD4+、CD8+T淋巴细胞比例降低的结果不一致。笔者认为此差异可能与以下因素相关:(1)本研究纳入的是HBeAg阴性慢性HBV感染者,Zhu等研究纳入的是慢性乙型肝炎患者,虽然两类患者均为慢性HBV感染者,但可能存在不同的免疫状态;(2)本研究的治疗策略为PEG-IFN-α-2b,Zhu等研究的治疗策略为PEG-IFN-α-2a,两者在药物剂型、耦合PEG分子大小等方面存在差异;(3)本研究的观察指标是T淋巴细胞绝对计数,Zhu等研究的观察指标是T淋巴细胞比例,两者观察指标上的差异可能造成结果不一致。因此,本研究结果提示PEG-IFN-α-2b治疗可能并未影响HBeAg阴性慢性HBV感染者外周血T淋巴细胞数量。
HBV特异性CD8+T淋巴细胞可通过双重途径发挥杀伤功能。一方面,HBV特异性CD8+T淋巴细胞可通过穿孔素、颗粒酶等细胞毒性分子以及FasL、TRAIL介导的凋亡信号通路诱导靶细胞死亡,清除病毒感染,这一过程依赖细胞之间的直接接触。另一方面,HBV特异性CD8+T淋巴细胞还可通过分泌促炎因子(主要为IFN-γ和TNF-α)抑制病毒复制,但这一过程并不依赖细胞间直接接触,也不会造成严重细胞死亡。Phillips等建立了HBV特异性CD8+T淋巴细胞与HepG2.2.15细胞的直接接触(直接混合培养)和间接接触(使用Transwell平板培养)共培养系统,在直接接触共培养系统中,HBV特异性CD8+T淋巴细胞可通过直接细胞杀伤和分泌细胞因子发挥抑制HBV复制的作用,在间接接触共培养系统中,HBV特异性CD8+T淋巴细胞仅通过分泌细胞因子发挥抑制HBV复制。本研究利用此培养系统对HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞的功能进行了分析,直接接触培养体系中CD8+T淋巴细胞诱导靶细胞死亡的比例显著高于间接接触培养体系,但无论是基线还是研究终点,HBV DNA水平在直接接触和间接接触共培养中的差异无统计学意义,直接接触共培养中细胞毒性分子水平升高,但IFN-γ和TNF-α水平与间接接触共培养中水平相似,这与既往的研究结果一致。这一方面提示HBV特异性CD8+T淋巴细胞可能主要通过分泌细胞毒性分子诱导靶细胞死亡,这一过程依赖CD8+T淋巴细胞与靶细胞直接接触;另一方面,HBV特异性CD8+T淋巴细胞主要通过分泌细胞因子抑制HBV DNA复制,而这一过程并不依赖CD8+T淋巴细胞与靶细胞的直接接触,亦不诱导明显的靶细胞死亡。
本研究结果显示,PEG-IFN-α-2b治疗后,HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞分泌穿孔素、颗粒酶B、IFN-γ的水平升高,这一升高过程在发生HBsAg阴转的患者中更为明显,这与既往使用替诺福韦酯抗病毒治疗患者中的发现一致。利用共培养系统评估发现,一方面,PEG-IFN-α-2b治疗后可增强直接接触培养体系中CD8+T淋巴细胞的杀伤功能,表明PEG-IFN-α-2b治疗可增强HBV特异性CD8+T淋巴细胞介导的直接细胞杀伤活性;另一方面,虽然PEG-IFN-α-2b治疗对间接接触共培养体系中CD8+T淋巴细胞介导的细胞杀伤功能并无影响,但可显著增加IFN-γ和TNF-α分泌,对病毒复制的抑制作用增强,表明PEG-IFN-α-2b治疗可增强HBV特异性CD8+T淋巴细胞通过分泌细胞因子介导的HBV复制的抑制。此外,PEG-IFN-α-2b治疗对总CD8+T淋巴细胞中FasL和TRAIL的表达并无明显影响,提示PEG-IFN-α-2b可能主要通过增强细胞毒性分子分泌促进HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞的杀伤功能,通过增加细胞因子分泌促进HBV特异性CD8+T淋巴细胞对病毒复制的抑制。进一步分析则发现,直接接触共培养系统中,发生HBsAg阴转患者HBV特异性CD8+T淋巴细胞介导的靶细胞死亡比例高于未发生HBsAg阴转患者,在直接接触和间接接触共培养系统中,发生HBsAg阴转患者HBV特异性CD8+T淋巴细胞诱导的病毒抑制均高于未发生HBsAg阴转患者,提示发生HBsAg阴转的患者HBV特异性CD8+T淋巴细胞活性显著增强,可能成为促进HBsAg阴转的重要因素之一。
本研究具有一定的局限性。一方面,纳入的受试者数量有限,基于伦理学方面考虑,并未在每个观察时间点对患者进行血液样本的额外采集,未观察到PEG-IFN-α-2b治疗期间HBeAg阴性慢性HBV感染者HBV特异性CD8+T淋巴细胞功能的动态变化。同时,《慢性乙型肝炎防治指南(2022版)》推荐使用高灵敏度检测技术检测HBV DNA(定量下限为10~20 IU/mL),而本研究的时间为2020—2022年,纳入HBeAg阴性慢性HBV感染者的HBV DNA<100 IU/mL。后期还需要扩大样本量进一步证实本研究结果。另一方面,本研究仅开展体外实验,后期需要利用HBV感染动物模型,观察PEG-IFN-α- 2b在体内对HBV特异性CD8+T淋巴细胞功能的调控作用。
综上所述,PEG-IFN-α-2b治疗HBeAg阴性慢性HBV感染者可获得较高的HBsAg阴转率,PEG-IFN-α-2b治疗还可显著增强HBV特异性CD8+T淋巴细胞杀伤功能和抑制病毒复制的活性,这一过程与HBsAg阴转密切相关。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50406

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)