首页 > 医疗资讯/ 正文
骨髓增殖性肿瘤(MPN)和骨髓增生异常综合征/骨髓增殖性肿瘤(MDS/MPN)是一组具有异质性和复杂性的血液系统恶性肿瘤。世界卫生组织(WHO)肿瘤分类和国际共识分类(ICC)的最新修订增强了我们对这些疾病的了解和分类,它们通常表现出广泛的临床表现,并且在准确诊断、预后评估和治疗方面存在显著挑战。
对于“经典型”MPN中,慢性髓细胞白血病(CML)、原发性血小板增多症(ET)、真性红细胞增多症(PV)和骨髓纤维化(MF)是最常见的类型,慢性粒单核细胞白血病(CMML)是MDS/MPN中最常见的形式。而“不典型”MPN和MDS/MPN是一组具有广泛临床表现的异质性恶性肿瘤,与经典型MPN不同,“不典型”MPN和MDS/MPN目前尚无标准化的管理方案,尤其是在异体造血干细胞移植(HCT)的指征和管理方面。
“不典型”MPN和MDS/MPN包括:慢性中性粒细胞白血病(CNL)[WHO/ICC]、慢性嗜酸性粒细胞白血病(CEL)[WHO]/CEL非特指型(CEL-NOS)[ICC]、髓系/淋系肿瘤伴嗜酸性粒细胞增多和酪氨酸激酶(TK)基因融合(MLN-TK)非特指型[WHO]和MPN-NOS[WHO]/MPN无法分类型(U)[ICC]。此外,MDS/MPN还包括:MDS/MPN伴中性粒细胞增多[WHO]/不典型CML(aCML)[ICC]、MDS/MPN伴SF3B1突变和血小板增多[WHO]/MDS/MPN伴血小板增多和SF3B1突变[ICC]、MDS/MPN伴环形铁粒幼细胞和血小板增多-非特指型[仅限ICC]以及MDS/MPN-NOS[WHO/ICC]。
为填补allo-HCT治疗不典型MPN和MDS/MPN的知识空白,欧洲骨髓移植学会(EBMT)实践协调与指南委员会(PH&G)和慢性恶性肿瘤工作组(CMWP)合作制定了共同指南,旨在优化这些罕见肿瘤患者的筛选和管理,提供一个统一的框架,以改善患者预后,并在国际上协调各治疗中心的临床实践,近日发表于《Blood》。鉴于目前缺乏有力的证据,该建议将作为宝贵资源,为未来的科研活动提供指导,为解决关键未解问题提供框架,并推动该领域的发展。

为了全面评估问题的范围,EBMT首先进行了分析,收集了自2016年WHO分类第4版发布以来每种适应证的移植数据(表1)。尽管病例数量有限,但移植近年来呈现出持续上升的趋势,表明人们对这些疾病的认识正在不断提高。
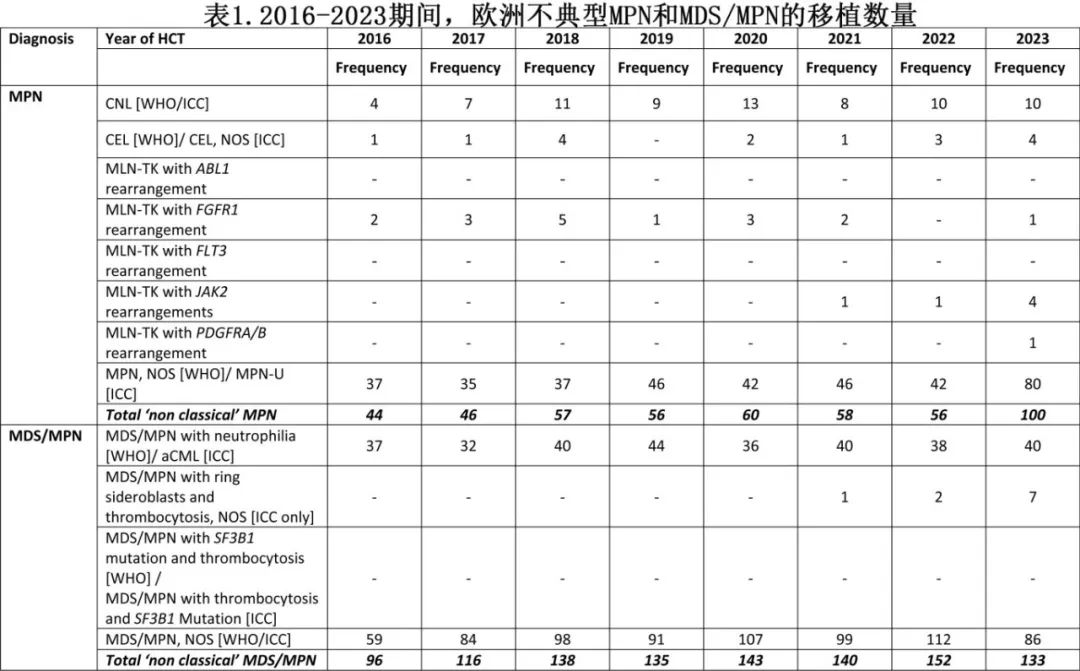
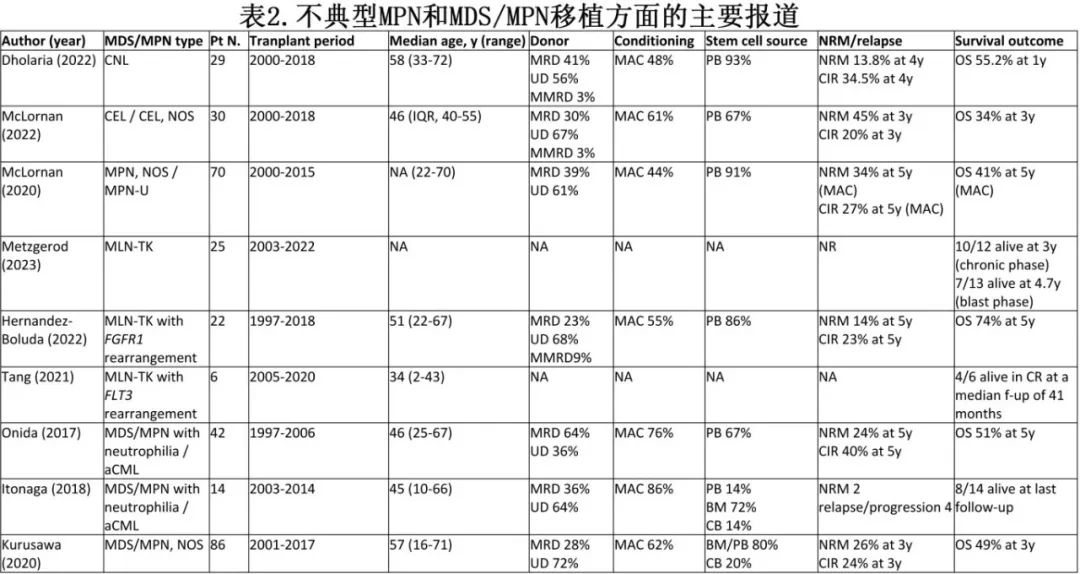
表2列出了这些疾病移植领域的主要报道。
第1部分:当前状态
1.1不典型MPN和MDS/MPN的分子特征
二代测序(NGS)技术在不典型MPN和MDS/MPN的大型队列中的应用揭示了其分子特征,这些特征虽然不能定义,但能够表征最新的诊断分类中所识别的各个疾病类型(见1.2)。特别是,专注于这些疾病分子结构的研究识别了特定的共突变模式,这些模式支撑了与不典型MPN和MDS/MPN的临床异质性相关的多步骤发病机制。
不典型MPN通常基于显著的临床特征(例如嗜酸性粒细胞增多、脾肿大、白细胞增多等)进行诊断,并且不符合经典型MPN的诊断标准。其中部分(但并非全部)具有特定的分子模式:
l CNL与致病性CSF3R突变密切相关,但并非专一相关;
l CEL是一种排除性诊断,没有指示性分子特征;
l MLN-TK具有疾病定义性基因改变,包括PDGFRA、PDGFRB、FGFR1、JAK2、FLT3和ETV6::ABL1以及其他酪氨酸激酶改变;
l MPN-NOS/U病例通常具有JAK2、CALR或MPL突变,但不符合经典型MPN的血液学和组织病理学标准。
在MDS/MPN疾病中,常规细胞遗传学可以在15%至35%的病例中识别克隆性和异常性,最常见于MDS/MPN伴中性粒细胞增多/ aCML,而NGS检测显示大约90%的病例中存在复发性髓系基因突变。表观遗传调节因子(ASXL1、TET2、DNMT3A)、剪接因子(SF3B1、SRSF2、U2AF1)、JAK-STAT通路(JAK2、CALR、MPL)和RAS通路(NRAS、KRAS、CBL)基因的突变是最常见的改变。一般来说,这些病变的组合和获得顺序决定了临床病理表现。目前的分类并未严格根据分子病变进行划分,因此这些突变可能在这些疾病中广泛存在。然而多项研究强调,MDS/MPN患者的基因组构成可以大致表征为以下几类:
l MDS/MPN伴中性粒细胞增多/aCML常携带SETBP1和/或ASXL1突变。
l “MDS/MPN伴环形铁粒幼细胞和血小板增多症”主要表现为SF3B1突变,常伴有JAK2突变,或低频率的CALR或MPL突变。
l 尤其在MDS/MPN-NOS中,分子突变可用于进一步疾病分层。基因型上类似于CMML的MDS/MPN-NOS患者,表现出TET2、SRSF2、ASXL1、RUNX1和RAS通路改变的富集。
l 表型为“MDS/MPN伴嗜中性粒细胞样”,MDS/MPN-NOS患者ASXL1、SETBP1、ETNK1、RUNX1、TET2和RAS通路基因突变富集。
目前的WHO/ICC分类仅将SF3B1作为MDS/MPN和血小板增多症类别的疾病定义性病变。
除了这些复发性基因组特征外,一些不太常见的突变也可能识别具有特定临床轨迹和结局的病例(例如TP53、CBL)。基因组信息可能有助于建立准确的诊断,增强预后评估,甚至支持将模糊病例重新分类为当前定义的疾病,并补充病理形态学和临床标准。
1.2 WHO/ICC分类的比较
WHO第5版分类和ICC关于髓系和淋巴系肿瘤的分类是在2016年WHO第4版修订版的基础上建立的。对于本文涉及的疾病,WHO第5版和ICC的定义和诊断标准相似,但也存在一些关键差异(表3)。
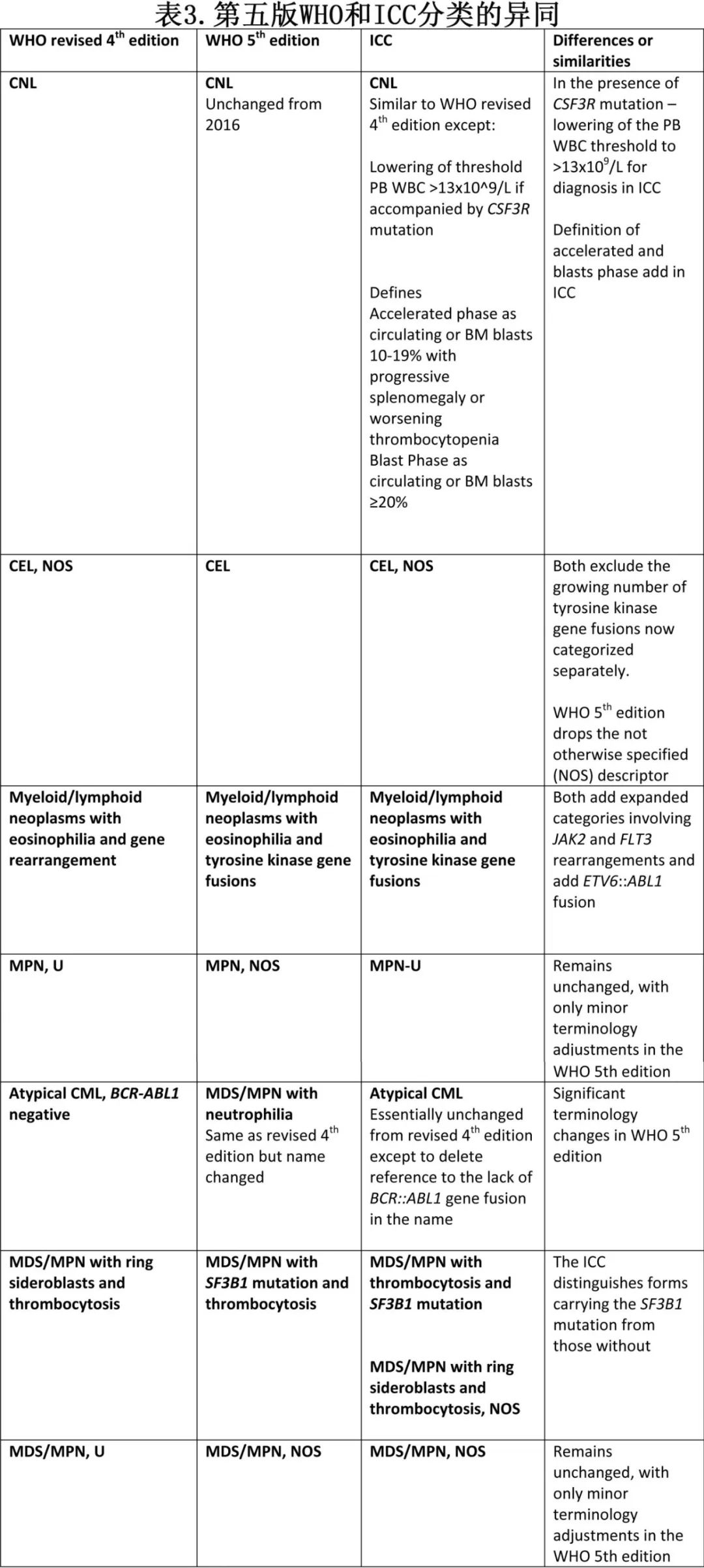
在MPN的分类方面,CNL的定义在WHO第5版中保持不变,而ICC降低了在存在CSF3R突变时所需的中性粒细胞增多的阈值(>13×10⁹/L)。ICC还定义了加速期和急变期,这些定义可能有助于未来试验中的治疗干预和结果解读。CEL在WHO第5版和ICC中仍为一种以持续性嗜酸性粒细胞增多、克隆性和异常/发育不良的骨髓形态为特征的MPN,且不符合伴有嗜酸性粒细胞增多和TK融合的髓系/淋巴系肿瘤(MLN-TK)或其他可能伴有嗜酸性粒细胞增多的髓系肿瘤的诊断标准。尽管两种分类都将CEL视为持续性嗜酸性粒细胞增多患者的排除性诊断,但在一些细节方面有所不同。
在MDS/MPN方面,WHO第5版将aCML更名为MDS/MPN伴中性粒细胞增多,但诊断参数保持不变。而ICC保留了不典型CML的名称,并将SETBP1和/或ASXL1突变状态作为诊断的支持性依据。两者都将MDS/MPN伴环形铁粒幼细胞和血小板增多分为SF3B1突变型和未突变型。ICC明确定义了MDS/MPN伴SF3B1突变和血小板增多,以排除治疗相关和其他细胞遗传学及基因异常。WHO第5版还额外指出,任何MDS/MPN实体都可能在细胞毒性治疗后出现。WHO第5版和ICC都将MDS/MPN-U更名为MDS/MPN-NOS。
第二部分:具体疾病的HCT指征
慢性中性粒细胞白血病(CNL) [WHO/ICC]
CNL较为罕见,表现为白细胞增多,常伴有脾肿大。其病程虽有差异,但最终预后不佳,中位生存期少于2年,疾病进展是主要死亡原因。传统治疗方法差异较大,包括使用羟基脲和干扰素进行减细胞治疗,以及使用靶向激酶抑制剂(如芦可替尼或达沙替尼),但这些治疗的缓解时间通常较短。对于加速期或急变期患者,可以考虑采用类似AML的诱导治疗方案,作为HCT的潜在桥接手段,但目前尚无最佳方案。
疾病进展的表现包括严重的脾肿大、治疗抵抗、中性粒细胞增多、输血依赖以及基因组复杂性增加。携带/获得ASXL1、CBL、CEBPA、EZH2、NRAS、TET2和/或U2AF1等致病性突变与预后不良有关。
鉴于传统治疗的预后不佳,所有CNL患者都应在确诊后尽早评估是否适合移植,然而关于该疾病群体HCT结局的数据有限。迄今为止发表的最大队列研究是一项回顾性评估,纳入2000年至2018年间接受移植的29例患者,由国际血液和骨髓移植研究中心(CIBMTR)和欧洲血液和骨髓移植学会(EBMT)联合开展。该研究排除了急变期患者。干细胞来源主要是外周血(PB),其中约50%的患者接受清髓性预处理(MAC),其余50%的患者接受非清髓性/减低强度预处理(NMA/RIC)。移植后4年总生存率超过50%,非复发死亡率有限,但4年复发率为35%(见表2),从而强调了移植后严格监测以早期发现疾病复发迹象的重要性。目前尚无关于使用移植前治疗作为HCT桥接手段的专门研究,但鉴于疾病控制能力有限,建议在移植前考虑减细胞治疗或靶向激酶抑制剂治疗,以增强疾病控制(降低白细胞计数;改善脾肿大)并优化患者的生理状况,为HCT做好准备,同时权衡风险和收益,并考虑这些治疗的潜在用途(例如,感染风险、疾病进展等)。如果检测到分子标志物(例如CSF3R),开发动态监测移植后MRD的分析方法需要进一步研究,但专家组鼓励尽可能收集此类数据。移植后使用芦可替尼或达沙替尼等药物进行维持治疗仍处于研究阶段。CNL的专家组建议总结在表4中。

慢性嗜酸性粒细胞白血病(CEL)[WHO] / CEL-NOS [ICC]
CEL[WHO] / CEL-NOS [ICC]是一种罕见、致残且具有侵袭性的MPN,由于嗜酸性粒细胞浸润,患者存在较高的器官衰竭风险(尤其是心力衰竭),并且较高比例会转化为急性白血病。该病的中位生存期较差,通常从确诊起不到2年。
治疗选择范围从支持治疗(包括使用类固醇或羟基脲/干扰素)到类似AML的诱导治疗以及HCT,但大多数患者对治疗反应有限。
关于CEL患者HCT结局的数据仅限于EBMT在2000年至2018年间对30例患者移植情况的单一报告。中位年龄为46岁(,男性居多。干细胞来源67%为外周血,61%使用清髓性预处理(MAC),67%使用非亲缘供者(URD),52%采用体内去除T细胞。1年和3年OS分别为46%和34%,但对于有同胞供者(MSD)的患者,3年总生存率为65%。移植失败主要归因于较高的非复发死亡率(NRM,1年为38%),尤其是在使用非亲缘供者后。需要注意的是,该分析是在广泛使用移植后环磷酰胺(PTCy)之前进行的,而近年来非亲缘供者移植的结局可能有所改善。
CEL[WHO] / CEL-NOS [ICC]的专家组建议总结在表5中。

髓系/淋系肿瘤伴嗜酸性粒细胞增多和酪氨酸激酶基因融合(MLN-TK)[WHO/ICC]
根据ICC和2022年WHO分类,几种与PDGFRA、PDGFRB、FGFR1、JAK2、ABL1或FLT3酪氨酸激酶基因重排相关的髓系/淋系肿瘤(MLN-TK)归入此类别。这些罕见的恶性肿瘤通常具有侵袭性病程,可能表现为一种且有较高原始细胞期转化倾向的MPN,也可能直接表现为AML、T或B细胞ALL或混合表型急性白血病(MPAL),伴或不伴MPN成分。在MLN-TK-PDGFRA患者中,心脏嗜酸性粒细胞浸润尤为突出。针对MLN-TK异质性的临床表现,近期提出了全面的疗效标准。
TKI治疗(尤其是伊马替尼)在大多数携带PDGFRA或PDGFRB融合基因的MLN患者中非常有效,即使在急变期也能诱导持久的完全分子缓解,类似于CML中取得的缓解。在德国登记组研究中,104例携带PDGFRA/B融合基因的患者中只有16例(15%)在中位随访9.2年后死亡。有报道称,少数主要处于急变期的患者因突变而对伊马替尼产生耐药,但其中部分患者可能对其他TKI有反应(例如,T674I突变患者使用ponatinib,D842V突变患者使用avapritinib)。
相比之下,携带FGFR1、JAK2、ABL1或FLT3融合基因的患者对TKI的反应较差,通常最终会进展至急变期,在德国登记组研究中的中位生存期约为5年。然而,慢性期MLN-FGFR1或MLN-ETV6::ABL1患者可能对pemigatinib或尼洛替尼/达沙替尼分别产生分子反应。
尽管如此,这些缓解的持久性仍不确定,而HCT是唯一能在这些疾病中实现长期疾病控制的治疗方法。EBMT最近的一项回顾性研究纳入22例接受HCT的MLN-FGFR1患者,5年总生存率、无进展生存率、非复发死亡率和复发率分别为74%、63%、14%和23%,凸显了HCT在这种侵袭性疾病中的治愈潜力。在来自几家美国机构的12例MLN-FLT3患者中,6例接受了HCT,其中4例在末次随访时仍然存活。
基于这些数据,建议大多数处于慢性期且携带FGFR1、JAK2、ABL1或FLT3融合基因的患者尽早转诊至HCT,因为TKI治疗通常无法实现持久缓解,且疾病可能迅速进展至急变期。对于通过TKI(FGFR1的pemigatinib或ABL1的尼洛替尼/达沙替尼)获得深度缓解的MLN-FGFR1或MLN-ETV6::ABL1患者,如果预计非复发死亡率风险较高,则可以推迟移植,但需密切监测TKI反应,如有预警信号出现则重新考虑。一般来说,应考虑使用特定TKI(伴或不伴化疗)作为桥接治疗。对于不适合HCT的患者应考虑参加临床试验。最后,TKI在HCT后的维持治疗作用值得以标准化的方式进行研究。表6总结了MLN-TK的专家建议。

MPN-NOS [WHO]/ MPN-U [ICC]
MPN-NOS/ MPN-U涵盖一组未能满足WHO或ICC分类系统中其他MPN实体严格诊断标准的异质性MPN。其真实发病率尚不清楚,但如果严格应用诊断标准,估计其可能占所有MPN的5%。随着时间推移,这类疾病的特征可能会符合其他MPN实体的诊断标准,因此需要动态重新评估。MPN-NOS/MPN-U的临床表现极为多样,从病程缓慢的疾病到伴有显著脾肿大、症状负担以及白血病转化风险的侵袭性疾病均有发生。值得注意的是,一项来自英国三级中心的大型研究显示,中位随访时间超过7年,约20%的患者出现血栓并发症,约9%的患者发生转化,中位无事件生存期(EFS)为11年。最近,Crane等人的回顾性研究纳入94例患者,报告中位OS为54个月。有趣的是,动态国际预后评分系统(DIPSS)-plus模型和高危分子特征在该研究中仍具有预后相关性,提示用于MF的预后评分也可能适用于此。
McLornan等基于EBMT登记组数据评估了70例确诊为MPN-NOS/MPN-U患者的HCT结局,这是迄今为止报告的最大移植队列。在预处理强度方面,31例患者接受MAC,39例接受RIC。与MAC相比,RIC方案有延迟植入的趋势。1年和5年OS分别为77%和42%(MAC)以及59%和41%(RIC);MAC组1年和3年NRM分别为19%和29%,RIC组分别为28%和28%;MAC组1年和3年复发累积发生率分别为10%和23%,RIC组分别为28%和36%。HCT时存在异常核型的MPN-NOS患者复发风险更高。在供者类型方面,单因素分析提示,与MSD相比,使用URD的患者OS和NRM更差。
鉴于该疾病群体的罕见性,关于HCT的建议都仅来自其他MPN(主要是骨髓纤维化)的经验。实际上,在适合移植且有合适供者的MPN-NOS/MPN-U患者中,考虑HCT的人群可能包括高危患者,即外周血/骨髓原始细胞增多、获得性细胞遗传学或突变特征预示预后不良(基于骨髓纤维化数据,因为MPN-NOS/MPN-U缺乏充分证据)、尽管经过优化的药物治疗仍有进行性致残性脾肿大或需要输血的患者。从实用角度出发在缺乏指导最佳实践的现代数据的情况下,应用于骨髓纤维化HCT的优化结局的方法也可以应用于MPN-NOS/MPN-U患者。MPN-NOS/MPN-U的建议包含在表7中。

MDS/MPN伴中性粒细胞增多[WHO] /不典型CML [ICC]
MDS/MPN伴中性粒细胞增多/aCML患者的预期寿命通常较短,相当一部分患者(高达40%)在确诊后12-18个月内转化为AML,中位OS一般在12-24个月。尽管目前有多种新型靶向治疗和药物组合正在积极研究中,但HCT仍然是唯一可能治愈该病的手段。回顾性分析显示,影响患者生存的因素包括年龄超过65岁、存在血细胞减少(贫血和血小板减少)、白细胞增多、乳酸脱氢酶(LDH)水平升高以及骨髓原始细胞比例较高。此外,存在致病性TET2突变也与预后不良相关。尽管有多种预后模型可用于评估疾病相关死亡风险,但即使是低危组患者的中位OS也通常不足2年。
关于HCT的研究数据显示,EBMT基于登记组数据的回顾性研究发现,42例患者中有半数在移植后6年仍然存活。MD安德森癌症中心的研究则显示,65例患者中7例接受了移植,未接受移植的患者中位生存期为24.6个月,而接受移植的患者尚未达到中位生存期。目前尚无确凿数据表明移植前治疗是否会影响移植后的结局。对于白细胞增多的管理,通常使用减细胞药物(如羟基脲)或免疫调节剂(如干扰素)。在疾病晚期出现高原始细胞比例时,尤其是AML转化的情况下,通常优先考虑使用去甲基化药物(HMA)和/或基于化疗的诱导方案。
表8列出了针对该疾病的专家组建议。

MDS/MPN伴SF3B1突变和血小板增多/MDS/MPN伴血小板增多和SF3B1突变[ICC]
该疾病通常影响老年人,总体预后良好,白血病转化风险低,中位生存期超过5年。然而,诊断或随访时存在异常核型、ASXL1/SETBP1突变和/或中度至重度贫血(血红蛋白<10 g/dl)与预后不良相关,预期中位OS可能不足1年。目前尚未有大规模、分子注释详细的接受移植治疗的MDS/MPN伴SF3B1突变患者的队列报道,仅有少数病例系列或个案报告。
MDS/MPN伴环形铁粒幼细胞和血小板增多-非特指型(仅限ICC)
在MDS/MPN伴环形铁粒幼细胞和血小板增多(MDS/MPN-RS-T)患者中,约10%-30%的病例缺乏经典的SF3B1突变。然而近期研究显示,SF3B1突变状态对预后的影响存在差异,部分研究发现SF3B1突变与否对OS和PFS并无显著影响。与SF3B1突变患者类似,目前尚无关于这类患者移植治疗的专门数据。根据EBMT登记组数据,仅有10例伴或不伴SF3B1突变的MDS/MPN伴血小板增多患者接受移植。因此,对于这类患者,应参考MDS的标准HCT建议。
表9总结了针对MDS/MPN伴SF3B1突变和血小板增多[WHO]/MDS/MPN伴血小板增多和SF3B1突变[ICC]以及MDS/MPN伴环形铁粒幼细胞和血小板增多-非特指型[仅限ICC]的建议。

MDS/MPN-NOS [WHO/ICC]
MDS/MPN-NOS是一种极为罕见的疾病,目前尚无关于最佳治疗方案的共识,且预后较差。一项来自两个中心的研究报告了135例患者的中位无白血病生存期为24个月。MD安德森癌症中心对1987年至2013年随访的85例患者的研究显示,患者预期寿命更短,接近1年。此外存在TP53突变会增加疾病进展的风险。
治疗方面,上述研究中135例患者中有59例接受HMA治疗,但总体反应较差(仅1例患者达到完全缓解)。8例(6%)患者接受HCT,其中5例(63%)在末次随访时仍然存活且无疾病。目前最大规模的移植研究来自日本造血干细胞移植学会,该研究纳入2001年至2017年间接受移植的86例MDS/MPN-NOS患者,使用多种移植平台,结果显示疾病状态(稳定/有反应 vs. 进展)和高龄是移植结局的重要预后因素,总体长期生存率接近50%。最近,北美合作研究组报告了一项包含120例MDS/MPN患者(包括48例NOS/U病例)的研究,这些患者接受单倍体相合移植,主要采用RIC和非清髓性预处理方案。有趣的是,移植结局与CMML和其他MDS/MPN重叠综合征相当,年轻(<65岁)和无脾肿大为移植后生存的独立有利因素。所有这些数据支持,即使在MDS/MPN-NOS的背景下,也可以应用类似CMML的移植策略。对于白细胞增多的管理,通常使用减细胞药物(如羟基脲)或免疫调节治疗(干扰素)。对于以血细胞减少和/或原始细胞增多为主的患者,可以考虑使用HMA。此外,JAK抑制剂单独使用或与HMA联合使用也已进行了研究。对于进展为AML的年轻患者,诱导治疗可用作移植的桥接。表10提供了针对这一疾病的专家组建议。

嵌合和可测量残留病评估
专家组一致认为,HCT后应根据相关情况开展嵌合检测和MRD监测,将有助于在缺乏有力证据的领域收集数据。目前有多种技术可用于评估系别嵌合,最常用的方法是通过聚合酶链式反应(PCR)分析短串联重复序列(STR),以明确宿主和供者细胞群体。CD34⁺特异性嵌合的作用尚需评估。对于这些疾病的MRD评估仍处于试验阶段,但如果进行评估,则建议使用灵敏度高的实验室技术,理想灵敏度为0.01%-1%,并考虑使用数字PCR或定量PCR。由于这些指南所涵盖的特定疾病尚无专门的MRD评估指南,因此专家组建议参照EBMT小组最近对MF MRD评估的建议。专家组还一致认为,目前的扩展NGS panel用于MRD评估仍为研究工具。检测时间安排应遵循各机构的政策。
未解决问题和未来研究领域
在不典型MPN和MDS/MPN领域,仍有许多关键问题尚未解决。首先,疾病预后的评估仍需进一步完善,目前正在进行的探索(如IWG登记组研究)预计将提供有价值的见解。此外,针对这些疾病的移植前治疗策略需要优化,以改善患者预后,因为目前不同机构的治疗方案差异较大。一个重要问题在于移植资格的确定,该领域目前仍缺乏明确的标准。鉴于许多患者年龄较大,评估身体功能和capacity的frailty筛查显得尤为重要;该筛查还可以结合工具来更具体地评估认知功能、合并症、社会状况、焦虑和营养状况,从而全面评估患者的健康状况和移植资格。在这方面,不应设定严格的年龄限制,而合理的做法是将移植评估扩展到70岁,甚至在某些身体状况良好的患者中可以扩展到75岁。
此外,供者配型是评估移植风险与获益的关键因素,但在该特定领域尚未得到充分研究。在讨论移植指征时,所有这些考虑因素都是基础,必须与疾病的内在风险进行谨慎权衡,而这种风险在许多情况下仍未明确。基于现有证据,无法为所有病例和移植中心推荐统一的移植时机。然而,合理的做法是,对于预期生存期少于5年的患者,应尽早开始寻找供者(优先考虑亲缘供者,必要时选择非亲缘或替代供者),同时考虑合并症、移植风险和患者偏好。
另一个重要方面是确定最佳的移植平台,包括供者选择、预处理方案的强度以及GVHD预防方法,以实现不同患者群体的长期更好预后。疾病监测(特别是在有分子标志物的情况下)也需要标准化,以确保不同中心之间的一致性和可靠性。此外,供者淋巴细胞输注(DLI)和维持治疗(特别是在有TKI可用的情况下)的作用仍在积极研究。最后,迫切需要国际前瞻性试验和统一的方案,以制定普遍接受的治疗指南,并改善不同医疗环境中的患者预后。在这方面,本文将有助于指导未来的研究活动,为解决这些关键未解问题提供框架,并推动该领域的进步。
参考文献
Blood . 2025 Mar 19:blood.2024028000. doi: 10.1182/blood.2024028000.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)