首页 > 医疗资讯/ 正文
摘 要
目的 探讨慢性失眠障碍共病抑郁症(chronic insomnia disorder comorbid with depression,ICD)患者血清促炎症细胞因子的变化及其与记忆功能的关系。
方法 收集在睡眠障碍门诊就诊的ICD患者40例(ICD组),慢性失眠障碍(chronic insomnia disorder, CID)患者41例(CID组),并同期收集健康对照41名(对照组)。采用匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)和17项汉密尔顿抑郁量表(17-item Hamilton depression rating scale,HAMD-17)分别评估受试者的失眠和抑郁严重程度,并使用九盒迷宫评估受试者的记忆功能。采用酶联免疫吸附法检测受试者血清肿瘤坏死因子(tumor necrosis factor,TNF)-α、TNF-β、白介素(interleukin,IL)-1β、IL-6和血清淀粉样蛋白A(serum amyloid A,SAA)的水平,分析促炎症细胞因子水平与记忆功能相关性。
结果 ICD组和CID组的HAMD和PSQI评分高于对照组[HAMD:19.0 (14.0, 22.0) vs. 10.0 (7.5, 12.5) vs. 2.0 (1.0, 4.0);PSQI:17 (15, 19) vs.15 (13, 16) vs. 2 (0, 3);P<0.01],ICD组也高于CID组(P<0.01)。ICD组和CID组的空间参考记忆(spatial reference memory,SRM)和空间工作记忆(spatial working memory,SWM)错误数多于对照组[SRM:2.5 (1.0, 4.0), vs. 1.0 (0, 3.0) vs. 0 (0, 1.0);SWM:5.00 (4.00, 7.75) vs. 4.00 (2.00, 5.00) vs. 1.00 (1.00, 2.50);P<0.01],且ICD组的SRM和SWM错误数也高于CID组(P<0.01)。ICD组和CID组血清TNF-α、TNF-β、IL-1β、IL-6和SAA水平高于对照组(P<0.01),且ICD组血清TNF-β和IL-6水平高于CID组(P<0.05)。在ICD组中偏相关分析结果表明,TNF-α(r=0.394,P=0.021)和IL-1β(r=0.398,P=0.020)与SRW错误数呈正相关,TNF-β(r=0.381,P=0.026)和SAA(r=0.446,P=0.008)与SWM错误数正相关,且TNF-β与再认记忆错误数正相关(r=0.347,P=0.044)。
结论 ICD患者记忆损害较严重,可能与其较高的促炎症细胞因子水平有关。
关键词
慢性失眠障碍;抑郁症;炎症因子;记忆功能;共病状态;九盒迷宫;匹兹堡睡眠量表;汉密尔顿抑郁量表
慢性失眠障碍(chronic insomnia disorder,CID)和抑郁症具有高患病率、高致残率及高复发率的特点,常与躯体和精神疾病共存[1-2]。慢性失眠常伴随抑郁症状,是抑郁症重要危险因素及常见临床症状和残余症状之一[3-4]。大量临床证据提示失眠和抑郁是双向关系[5],慢性失眠障碍与抑郁症可以同时存在。CID和抑郁症均会出现不同程度认知功能损害,且认知功能损害会进一步恶化失眠和抑郁症状[6-7]。炎症在CID和抑郁症发病中发挥重要作用[1,8],也是导致认知功能障碍的主要因素之一[9-10]。临床研究发现,CID和抑郁症患者出现不同程度炎症细胞因子水平的改变,主要表现为促炎症细胞因子水平增高,如肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(interleukin,IL)-1、IL-6、IL-8等,以及抗炎症细胞因子(如IL-4、IL-10、IL-13等)水平降低,且部分炎症细胞因子水平改变可能与记忆障碍有关[11-20]。然而,关于慢性失眠障碍共病抑郁症(chronic insomnia comorbid with depression,ICD)患者记忆功能和炎症细胞因子水平改变的特征,本课题组前期研究发现ICD记忆障碍可能与部分抗炎症细胞因子水平改变有关[16]。是否促炎症细胞因子也参与其中,目前未见相关报告。因此,本研究探究ICD患者客观记忆功能和促炎症细胞因子改变及其相关性。
1 对象与方法
1.1 研究对象 收集2022年1月至2024年1月期间,在安徽医科大学第一附属医院睡眠障碍门诊就诊的患者。ICD组入组标准:①同时符合《国际睡眠障碍分类第3版》(International Classification of Sleep Disorders, 3rd Edition, ICSD-3)和《精神障碍诊断与统计手册第5版》(Diagnostic and Statistical Manual of Mental Disorders, 5th Edition, DSM-5)慢性失眠障碍和抑郁症的诊断标准;②年龄18~60周岁;③初中及以上文化;④17项汉密尔顿抑郁量表(17-item Hamilton depression rating scale,HAMD-17)总分≥7分,匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)总分>7分。CID组入组标准:①符合ICSD-3和DSM-5慢性失眠障碍的诊断标准;②年龄18~60周岁;③初中及以上文化;④失眠病程>6个月,HAMD-17总分<7分。对照组为本院健康体检者,入组标准:①年龄18~60周岁;②初中及以上文化;③无失眠、抑郁相关症状主诉,PSQI总分<5分,HAMD-17总分<7分;④无神经精神类疾病史。各组排除标准:①入组前3个月服用过会潜在影响睡眠、情绪、认知及内分泌功能的药物;②视力、听力明显障碍或不能配合完成研究;③妊娠或哺乳期妇女;④存在明确的神经系统疾病、其他内科疾病或其他睡眠障碍,近2周有感染性疾病[16],存在酒精依赖。共纳入ICD组患者40例、CID组患者41例和对照组41名。本研究获得医院伦理审查批准。患者及其家属均签署知情同意书。
1.2 研究方法
1.2.1 一般资料收集 收集受试者的一般资料,包括性别、年龄、受教育年限、体质指数(body mass index,BMI)等。分别用PSQI和HAMD-17量表评估受试者的睡眠质量和抑郁严重程度。
1.2.2 记忆功能评估 利用“九盒迷宫”评估受试者的记忆功能[16]。1张圆形桌子边缘等距离倒置9个相同纸杯。向受试者展示10个常见物品,让其完全记住这些物体。测试阶段中,取2个物品放入2个纸杯子,要求受试者记住这2个物体和位置,这2个物体和位置保持不变,用于评估物体参考记忆(object reference memory,ORM)和空间参考记忆(spatial reference memory,SRM)能力。随机取出其他2个物体放入另外2个纸杯中(每轮测试物体和位置均改变),用于评估物体工作记忆(object working memory,OWM)和空间工作记忆(spatial working memory,SWM)能力,让受试者顺、逆时针绕桌子各转2圈,然后指出放入杯中的物品和位置,记录错误数。4轮测试结束后,让受试者识别出所出现的物体,以获得物体再认记忆(object recognition memory,ORcM)。分析指标分别为ORM、SRM、OWM、SWM和ORcM的错误数,错误数越多,提示记忆能力越差。
1.2.3 血清促炎症细胞因子检测 完成上述评估以后次日晨7:30-8:00,在受试者处于空腹、静息状态下,抽取2 mL空腹静脉血样,以3000 r/min的速度离心5 min,加入抗凝剂于-80 ℃保存。采用酶联免疫吸附法测定血清中TNF-β、TNF-α、IL-1β、IL-6和血清淀粉样蛋白A(serum amyloid A,SAA)的含量。
1.3 统计学方法 采用SPSS 20.0进行统计学分析。经正态性检验,BMI和TNF-α符合正态分布,以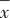 ±s描述,使用单因素方差分析,多重比较采用最小显著性差异(LSD)检验。其他一般资料以及量表评分、记忆功能、促炎症细胞因子结果数据为非正态分布,以M(QL,QU)描述,组间比较采用Kruskal-Wallis H检验,两两比较使用Mann-Whitney U检验,并通过Bonferroni法校正检验水准α为0.017(即0.05/3)。分别对ICD和CID组,采用偏相关分析评估血清促炎症细胞因子与记忆功能的相关性。检验水准α=0.05,双侧检验。
±s描述,使用单因素方差分析,多重比较采用最小显著性差异(LSD)检验。其他一般资料以及量表评分、记忆功能、促炎症细胞因子结果数据为非正态分布,以M(QL,QU)描述,组间比较采用Kruskal-Wallis H检验,两两比较使用Mann-Whitney U检验,并通过Bonferroni法校正检验水准α为0.017(即0.05/3)。分别对ICD和CID组,采用偏相关分析评估血清促炎症细胞因子与记忆功能的相关性。检验水准α=0.05,双侧检验。
2 结果
2.1 一般资料 3组间年龄、性别、受教育年限和BMI差异无统计学意义(P>0.05),而HAMD-17(Z=93.664,P<0.001)和PSQI(Z=86.061,P<0.001)总分差异具有统计学意义,表现为ICD组和CID组HAMD-17和PSQI总分高于对照组(P<0.001),且ICD组HAMD-17(P<0.001)和PSQI(P=0.001)总分高于CID组。见表1。
Tab.1 Comparison of general data among the three groups表1 3组一般资料比较
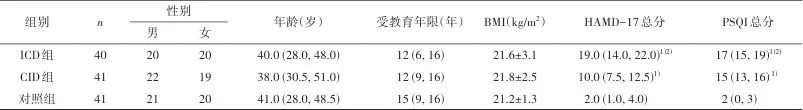
注:ICD,慢性失眠障碍共病抑郁症;CID,慢性失眠障碍;BMI,体质指数;HAMD-17,17项汉密尔顿抑郁量表;PSQI,匹兹堡睡眠质量指数量表。年龄、受教育年限、BMI、量表评分为非正态分布,用M(QL,QU)描述。1)与对照组比较,经Mann-Whitney U检验和Bonferroni校正,P<0.01;2)与CID组比较,经Mann-Whitney U检验和Bonferroni校正,P<0.01。
2.2 记忆功能 3组间SRM(Z=26.309,P<0.001)和SWM(Z=37.335,P<0.001)错误数的差异有统计学意义。与对照组相比,ICD组和CID组的SRM(P<0.001)和SWM(P<0.001)错误数多于对照组。ICD组的SRM(P=0.001)和SWM(P<0.001)错误数多于CID组。见表2。
Tab.2 Comparison of memory function among the three groups表2 3组记忆功能比较

注:ICD,慢性失眠障碍共病抑郁症;CID,慢性失眠障碍;ORM,物体参考记忆;SRM,空间参考记忆能力;OWM,物体工作记忆;SWM,空间工作记忆能力;ORcM,物体再认记忆。记忆功能各指标为非正态分布,用M(QL,QU)描述。1)与对照组相比,经Mann-Whitney U检验和Bonferroni校正,P<0.01;2)与CID组比较,经Mann-Whitney U检验和Bonferroni校正,P<0.01。
2.3 血清促炎症细胞因子水平 3组间血清TNF-β(Z=23.532,P<0.001)、TNF-α(F=9.524,P<0.001)、IL-1β(Z=8.468,P=0.014)、IL-6(Z=24.322,P<0.001)和SAA(Z=26.347,P<0.001)水平差异存在统计学意义。进一步分析发现:与对照组相比,ICD组和CID组的血清TNF-β、TNF-α、IL-1β、IL-6和SAA水平较高(P<0.001);与CID组相比,ICD组血清TNF-β(P=0.016)和IL-6(P=0.005)水平较高。见表3。
Tab.3 Comparison of cytokines among the three groups表3 3组促炎症细胞因子水平比较

注:ICD,慢性失眠障碍共病抑郁症;CID,慢性失眠障碍;TNF-β,肿瘤坏死因子-β;TNF-α,肿瘤坏死因子-α;IL-1β,白细胞介素-1β;IL-6,白细胞介素-6;SAA,血清淀粉样蛋白A。TNF-α为正态分布,用x±s描述,其他细胞因子各指标为非正态分布,用M(QL,QU)描述。1)与对照组比较,Mann-Whitney U检验和Bonferroni校正,P<0.05;2)ICD与CID相比和Mann-Whitney U检验,Bonferroni校正,P<0.05;3)与对照组比较,LSD-t检验,P<0.01。
2.4 血清促炎症细胞因子与情绪、睡眠和记忆功能相关性 针对CID组控制混杂因素(性别、年龄、受教育年限、BMI、HAMD-17和PSQI)进行偏相关分析,结果表明TNF-β与ORM(r=0.356,P=0.036)和SWM(r=0.368,P=0.030)呈正相关,TNF-α与SRM(r=0.365,P=0.031)呈正相关,IL-1β(r=0.419,P=0.028)和SAA(r=0.365,P=0.046)与SWM错误数呈正相关。
对ICD组控制混杂因素(性别、年龄、受教育年限、BMI、HAMD-17和PSQI))进行偏相关分析,结果显示血清TNF-β与SWM(r=0.381,P=0.026)和ORcM(r=0.347,P=0.044)呈正相关,TNF-α(r=0.394,P=0.021)和IL-1β(r=0.398,P=0.020)与SRM呈正相关,SAA与SWM错误数呈正相关(r=0.446,P=0.008)。
3 讨论
本研究结果发现,与CID患者相比,ICD患者SRM和SWM损害及血清TNF-α和IL-1β升高更为突出,其记忆损害和血清促炎症细胞因子(TNF-β、TNF-α、IL-1β和SAA)水平增高可能有关。失眠与抑郁关系密切,互为因果,彼此之间形成恶性循环[5,18,21],且某些症状相互重叠,临床上很难辨别。失眠和抑郁常相伴存在,临床特征与单纯失眠有较大差别,预后更差、危害更重[22]。ICD是区别于CID的一种独立状态,评估这些炎症细胞因子和记忆功能,可能有助于区分ICD,对于诊断、治疗和判断预后具有一定的临床意义。
认知功能障碍是失眠和抑郁患者常见的临床症状。关于失眠和抑郁相关认知功能改变的临床研究,结论并非完全一致,可能的原因是评估认知功能方法、疾病严重程度、病程、检测人群、样本量等因素不同。利用改良九盒迷宫实验评估客观记忆功能,本课题组前期研究发现,慢性失眠患者表现出空间参考记忆、空间工作记忆和(或)物体再认记忆下降,失眠伴抑郁患者存在空间参考记忆和空间工作记忆减退,且空间参考记忆较慢性失眠患者下降更为显著[16]。本研究结果和课题组前期结论基本相一致,均提示抑郁可以加重失眠对记忆功能损害(尤其是空间参考和空间工作记忆)。本研究未发现慢性失眠患者存在物体再认记忆改变。由于检测物体再认记忆方法相对简单,仅少数患者存在错误,错误数最多1个,并且由于样本量较少、患者病程和疾病严重程度不一,可能会导致此结果与既往研究存在不一致[23]。
失眠和抑郁之间潜在的生物学机制未完全明确,炎症反应可能是潜在机制之一。TNF-β、TNF-α、IL-1β和IL-6是常见的促炎症细胞因子。临床研究发现CID和抑郁症患者血清TNF-β、TNF-α、IL-1β和IL-6水平增高[23-25]。同时,一项研究也发现抑郁伴失眠患者血清TNF-α、IL-1β和IL-6水平升高,且与抑郁程度有关[26]。SAA是急性时相反应蛋白之一,在机体具有显著的促炎症活性,包括诱导前IL-1β合成[27],SAA基因转录主要是由脂多糖和炎症细胞因子(IL-6、IL-1和TNF-α)诱导。一项研究发现抑郁症患者血中SAA水平较健康对照组升高[28]。本研究和课题组前期研究结果相一致[29],发现CID患者血清SAA水平也较对照组增高。同时,CID和ICD患者血清TNF-β、TNF-α、IL-1β、IL-6和SAA水平较对照组明显升高,且ICD组血清TNF-β和IL-6水平显著高于CID组,提示抑郁可能加重失眠对TNF-β和IL-6影响。
炎症过程中释放的细胞因子(尤其是促炎症细胞因子)与认知功能下降密切相关。例如,临床研究发现一些外周血炎症生物学标志物(如C反应蛋白、IL-6、IL-1β)与认知功能领域有关,且可能与痴呆发病风险增高有关[30-32]。本课题组前期研究发现,CID患者血清多种促炎症细胞因子水平升高与其认知功能减退相关[17, 23]。本研究也发现在CID和ICD患者中血清TNF-β、TNF-α、IL-1β和SAA水平主要与空间工作记忆和空间参考记忆相关,提示这些促炎症细胞因子改变可能参与了失眠和抑郁引起的记忆损害(尤其是空间记忆)。
本研究存在一些局限性:由于本研究是一项横断面研究,不能得出因果推论;未设立单纯抑郁症组;样本量较小;未使用多导睡眠监测客观评估睡眠情况等。在未来的研究中尽量克服这些弊端,进一步探讨ICD患者促炎症细胞因子对记忆功能损害的相关机制。
综上所述,ICD患者空间记忆损害和血清促炎症细胞因子水平增高更为严重,其记忆功能损害可能与血清某些促炎症细胞因子水平增加有关。不论是ICD或CID,针对性降低促炎症细胞因子的水平可能是未来治疗其认知功能障碍的潜在策略。
参考文献:
1. MCCARRON R M, SHAPIRO B, RAWLES J, et al. Depression[J]. Ann Intern Med, 2021, 174(5): ITC65-ITC80.
2. RIEMANN D, BENZ F, DRESSLE R J, et al. Insomnia disorder: State of the science and challenges for the future[J]. J Sleep Res, 2022, 31(4): e13604.
3. HERTENSTEIN E, FEIGE B, GMEINER T, et al. Insomnia as a predictor of mental disorders: A systematic review and meta-analysis[J]. Sleep Med Rev, 2019, 43: 96-105.
4. CHEN P J, HUANG C L, WENG S F, et al. Relapse insomnia increases greater risk of anxiety and depression: Evidence from a population-based 4-year cohort study[J]. Sleep Med, 2017, 38: 122-129.
5. FANG H, TU S, SHENG J, SHAO A. Depression in sleep disturbance: A review on a bidirectional relationship, mechanisms and treatment[J]. J Cell Mol Med, 2019, 23(4): 2324-2332.
6. CULPEPPER L, LAM R W, MCINTYRE R S. Cognitive impairment in patients with depression: Awareness, assessment, and management[J]. J Clin Psychiatry, 2017, 78(9): 1383-1394.
7. PANG R, GUO R, WU X, et al. Altered regional homogeneity in chronic insomnia disorder with or without cognitive impairment[J]. AJNR Am J Neuroradiol, 2018, 39(4): 742-747.
8. DOLSEN E A, CROSSWELL A D, PRATHER A A. Links between stress, sleep, and inflammation: Are there sex differences?[J]. Curr Psychiatry Rep, 2019, 21(2): 8.
9. XU Y, YANG Y, CHEN X, et al. NLRP3 inflammasome in cognitive impairment and pharmacological properties of its inhibitors[J]. Transl Neurodegener, 2023, 12(1): 49.
10. 宋晓雨, 张杰, 王旭, 等. 认知障碍疾病神经炎症相关生物标记物研究进展[J]. 中国药理学通报, 2024, 40(12): 2218-2223.
11. CAI Y, ZHU Z H, LI R H, et al. Association between increased serum interleukin-8 levels and improved cognition in major depressive patients with SSRIs[J]. BMC Psychiatry, 2023, 23(1): 122.
12. WANG M, WEI Z, HUANG Q, et al. Prognostic prediction of subjective cognitive decline in major depressive disorder based on immune biomarkers: A prospective observational study[J]. BMC Psychiatry, 2023, 23(1): 54.
13. HUANG M H, CHAN Y E, CHEN M H, et al. Pro-inflammatory cytokines and cognitive dysfunction among patients with bipolar disorder and major depression[J]. Psychiatry Clin Neurosci, 2022, 76(9): 450-458.
14. HAYLEY S, HAKIM A M, ALBERT P R. Depression, dementia and immune dysregulation[J]. Brain, 2021, 144(3): 746-760.
15. JIN K, LU J, YU Z, et al. Linking peripheral IL-6, IL-1β and hypocretin-1 with cognitive impairment from major depression[J]. J Affect Disord, 2020, 277: 204-211.
16. HE S, CHEN X X, GE W, et al. Are anti-inflammatory cytokines associated with cognitive impairment in patients with insomnia comorbid with depression? A pilot study [J]. Nat Sci Sleep, 2021, 13: 989-1000.
17. REN C Y, RAO J X, ZHANG X X, et al. Changed signals of blood adenosine and cytokines are associated with parameters of sleep and/or cognition in the patients with chronic insomnia disorder[J]. Sleep Med, 2021, 81: 42-51.
18. RIEMANN D, KRONE LB, WULFF K, et al. Sleep, insomnia, and depression [J]. Neuropsychopharmacology, 2020, 45(1): 74-89.
19. LI Y, ZHANG B, ZHOU Y, et al. Gut microbiota changes and their relationship with inflammation in patients with acute and chronic insomnia[J]. Nat Sci Sleep, 2020, 12: 895-905.
20. 陈欢, 王冉, 黄凡凡, 等. 炎性因子在童年期创伤与抑郁严重程度之间的中介作用[J]. 中国神经精神疾病杂志, 2023, 49(3): 146-150.
21. AKKAOUI M A, PALAGINI L, GEOFFROY P A. Sleep immune cross talk and insomnia[J]. Adv Exp Med Biol, 2023, 1411: 263-273.
22. LE P H, KHANH-DAO LE L, RAJARATNAM S M W, et al. Quality of life impacts associated with comorbid insomnia and depression in adult population[J]. Qual Life Res, 2024, 33(12): 3283-3298.
23. 王芳, 瞿萍, 夏兰, 等. 慢性失眠障碍患者血清肿瘤坏死因子与记忆的相关性研究[J]. 中国神经精神疾病杂志, 2017, 43(9): 530-534.
24. 邓亚洁, 刘雨佳, 何漪, 等. 抑郁症患者Tp7免疫调节相关炎性细胞因子与抑郁严重程度的相关性[J]. 中华行为医学与脑科学杂志, 2021, 30(5): 420-425.
25. POLETI S, MAZZA M G, BENEDETTI F. Inflammatory mediators in major depression and bipolar disorder[J]. Transl Psychiatry, 2024, 14(1): 247.
26. 陈晓勇, 赵丽花, 林紫薇, 等. 抑郁伴失眠患者血清炎症因子表达及临床意义[J]. 国际精神病学杂志, 2024, 51(3): 769-772.
27. MIGITA K, KOGA T, SATOMURA K, et al. Serum amyloid A triggers the mosodium urate -mediated mature interleukin-1β production from human synovial fibroblasts[J]. Arthritis Res Ther, 2012, 14(3): R119.
28. WANG Q, SU X, JIANG X, et al. iTRAQ technology-based identification of human peripheral serum proteins associated with depression[J]. Neuroscience, 2016, 330: 291-325.
29. XIA L, ZHANG P, NIU J W, et al. Relationships between a range of inflammatory biomarkers and subjective sleep quality in chronic insomnia patients: A clinical study[J]. Nat Sci Sleep, 2021, 13: 1419-1428.
30. CHEN J, DOYLE M F, FANG Y, et al. Peripheral inflammatory biomarkers are associated with cognitive function and dementia: Framingham heart study offspring cohort[J]. Aging Cell, 2023, 22(10): e13955.
31. SCHMIDT-MORGENROTH I, MICHAUD P, GASPARINI F, et al. Central and peripheral inflammation in mild cognitive impairment in the context of Alzheimer’s disease[J]. Int J Mol Sci, 2023, 24(13): 10523.
32. TEIPEL S J, DYRBA M, KLEINEIDAM L, et al. Association of latent factors of neuroinflammation with Alzheimer’s disease pathology and longitudinal cognitive decline[J]. Alzheimers Dement (Amst), 2024, 16(1): e12510.
【引用格式】王芳,高建国,张折折 ,等. 慢性失眠障碍共病抑郁症患者促炎症细胞因子水平与记忆功能改变的相关性研究[J]. 中国神经精神疾病杂志,2025,51(3):156-161.
【Cite this article】WANG F,GAO J G,ZHANG Z Z,et al.A study on correlation between pro-inflammatory cytokine factor and memory in the patients with chronic insomnia disorder comorbid with depression[J]. Chin J Nervous Mental Dis,2025,51(2):156-161.
DOI:10.3969/j.issn.1002-0152.2025.03.005
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)