首页 > 医疗资讯/ 正文
在线使用:
终末肝脏病评分3.0 (MELD 3.0国际版)
酒精性肝炎重症和预后评分(ABIC评分,MELD评分)
背景与目的
终末期肝病模型(MELD)3.0和性别公平肝分配模型(GEMA)预后评分自提出以来,其应用范围已扩展至多种临床情境,但上述评分在肝硬化人群中的预后价值尚不明确。本研究旨在阐明MELD 3.0/GEMA-Na在长期死亡风险分层中的应用,并进一步优化其适用范围。
研究方法
采用多中心回顾性队列研究设计,以310例失代偿期肝硬化住院患者构建主要研究队列。比较MELD 3.0/GEMA-Na与传统评分系统的判别效能和风险分层能力,并在独立验证队列(n = 120)中进行外部验证,全面评价其临床应用价值。
研究结果
本研究中,MELD-Na、MELD 3.0和GEMA-Na评分的中位值分别为9(7-12)、12(10-17)和12(9-17)分。与既往评分相比,MELD 3.0和GEMA-Na在长期死亡率预测方面展现出显著优势。其中GEMA-Na表现最为优异,其曲线下面积(AUC)在两年随访期内稳定维持在0.8以上(最高达0.807)。多因素Cox回归分析显示,MELD 3.0 ≥18分和GEMA-Na ≥20分是最佳死亡风险分层截断值,均与两年无移植生存率显著独立相关(MELD 3.0:HR = 1.13,95%CI 1.10-1.17;GEMA-Na:HR = 1.12,95%CI 1.10-1.17;均P <0.001)。独立验证队列的结果进一步佐证了上述发现。
结论
本研究确立了MELD 3.0在肝硬化住院患者长期预后评估中的优越性,同时证实GEMA-Na具有出色的预测准确性和临床实用性。这些发现为肝硬化患者的个体化预后评估提供了循证医学依据。
关键词:MELD 3.0;GEMA-Na;肝硬化;预后评估;全因死亡率;预测模型
一、研究背景
全球疾病负担最新研究数据显示,1990至2017年间全球肝硬化患病率呈现显著上升趋势,增幅高达74.5%,其中东亚地区的疾病负担尤为突出,病例数量在全球范围内位居前列。值得注意的是,在此期间,肝硬化及其相关并发症共导致132万例死亡,占全球总死亡人数的2.4%。面对这一严峻形势,亟需开发并验证具有普适性的预测模型,以精准服务于器官移植分配、医疗资源调配、预后评估及患者风险分层管理等不同临床情境。在此背景下,针对晚期慢性肝病(尤其是肝硬化)患者开展死亡风险预测研究具有重大临床价值,同时为开展和改进治疗措施奠定坚实基础。在目前的临床实践中,Child-Turcotte-Pugh(CTP)评分和MELD评分已得到广泛应用与验证。
然而,现行MELD评分系统存在一定的局限性:首先,该系统对慢加急性肝衰竭、肝细胞癌以及肝硬化等特定临床表型的预后评估准确性下降。其次,随着人口构成转变、疾病谱系变迁、老年患者比例增加、共病负担加重以及肝病治疗策略的演进,传统MELD评分的预测效能面临新的挑战。为应对这些问题,研究者进行了优化:一方面对现有MELD模型进行迭代升级,另一方面开发新型预后评分系统(如针对性别差异的优化模型)。近期,Kim研究团队基于20,587例肝移植候选者的大样本数据,提出了MELD 3.0评分系统[1],该模型在90天死亡率预测中表现卓越。而Rodríguez-Perálvarez团队在9,320例患者的队列研究中,通过引入更可靠的肾功能评估指标,成功构建GEMA模型[2],同样显著提升了90天复合临床终点(死亡或移植名单退出)的判别效能。
基于上述研究背景,本研究提出假设——新型预后评分系统(MELD 3.0/GEMA-Na)可显著优化肝硬化患者群体的风险分层精度。
主要目的包括:
1)评估新型评分与传统MELD/MELD-Na评分在判别效能和风险分层方面的差异;
2)验证新型评分系统对住院肝硬化患者多时间节点全因死亡率的预测价值;
3)在具有临床异质性的独立验证队列中,对主要研究发现进行外部验证,以评估其临床推广价值。
二、统计分析
本研究主要研究终点为5种预后评分系统在多个时间节点的判别效能[评分系统包括4种MELD系列评分:原始MELD评分、MELD-Na评分、MELD 3.0评分和MELD 3.0(不含白蛋白)评分以及GEMA-Na评分]。次要研究终点为确定两年随访期内患者死亡率的最佳风险分层截断值。
连续性变量以中位数(四分位距)表示,分类变量以例数(百分比)表示。组间比较采用Mann-Whitney非参数检验。分类资料的组间比较采用Pearson卡方检验或Fisher精确检验。通过时间依赖性受试者工作特征(time-ROC)曲线和AUC值来比较各预后评分的预测效能。
为确定本研究中两年无移植生存期全因死亡率的风险阈值,我们采用两种统计学方法:最大选择秩统计量分析和X-tile分析。采用单因素和多因素Cox比例风险模型确定独立预测因素,结果以风险比(HR)及95%置信区间(CI)表示。采用Kaplan-Meier法绘制生存曲线,组间比较采用log-rank检验。P <0.05认为差异具有统计学意义。
三、结果
• 研究人群基线特征
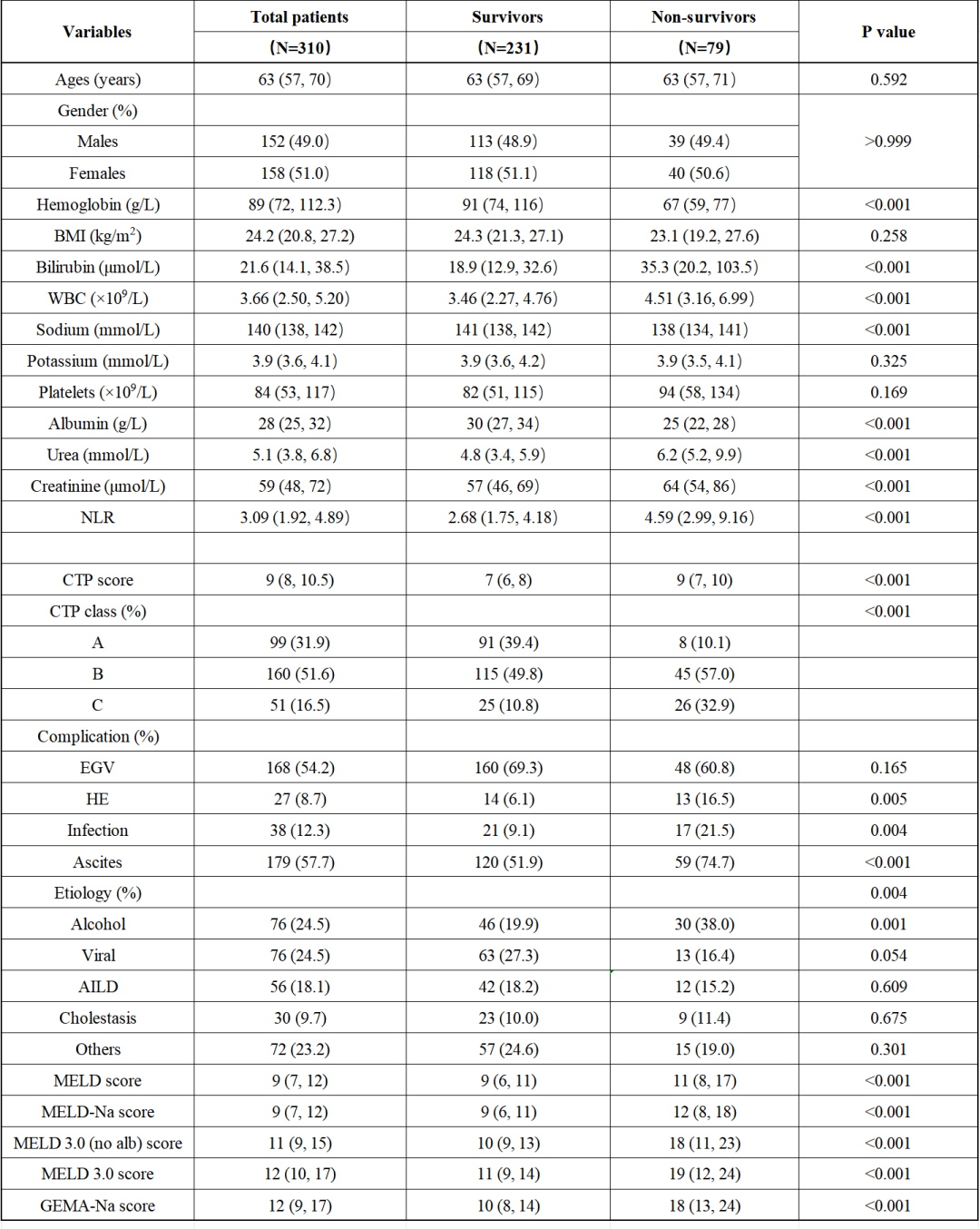
表1展现了研究队列的基线特征数据。本研究共纳入310例患者,中位年龄为63岁(57,70),女性占比51.0%(158/310)。最常见的住院并发症为腹水(179/310,57.7%)和胃食管静脉曲张(168/310,54.2%),其次为感染(12.3%)和肝性脑病(8.7%)。
酒精性肝病(24.5%)和病毒性肝炎(24.5%)是肝硬化的主要病因。CTP评分A级99例、B级160例、C级51例。各预后评分系统的中位数值分别为:MELD 9分(7-12)、MELD-Na 9分(7-12)、MELD 3.0 12分(10-17)、MELD 3.0(不含白蛋白)评分11分(9-15)以及GEMA-Na评分12分(9-17)。
实验室检测结果显示:中位总胆红素21.6μmol/L(14.1-38.5)、肌酐59μmol/L(48-72)、血清白蛋白28g/L(25-32)、血钠140mmol/L(138-142)。在两年随访期间,共有79例患者死亡,总死亡率为25.5%,死亡原因包括器官衰竭(39/79,49.4%)、严重感染/脓毒症(20/79,25.3%)、消化道出血(9/79,11.4%)、肝性脑病(6/79,7.6%)及其他原因。其中,死亡患者组总胆红素、肌酐、白细胞计数及NLR水平显著升高,血红蛋白、血钠和白蛋白水平显著降低。同时CTP B/C级占比,肝性脑病、感染及腹水发生率显著增高,且酒精性肝病作为肝硬化病因的比例也显著高于存活组。
表 1 研究人群的基线特征
• MELD 3.0/GEMA-Na与MELD系列评分的分层性能比较
本研究通过分析MELD 3.0与其他MELD评分系统对患者两年预后的分层性能,揭示了显著的评分差异特征。在MELD-Na四个分层区间(≤10、10-15、15-20及>20)中,MELD 3.0与MELD-Na的评分转换呈现明显的异质性分布:评分升高患者比例分别为45.1%(87例)、33.3%(23例)、62.5%(15例)和0%(0例);评分降低者占比分别为0%(0例)、2.9%(2例)、0%(0例)和4.2%(1例);而评分未改变者分别达到54.9%(106例)、63.8%(44例)、37.5%(9例)和95.8%(23例)。在79例死亡病例中,49.4%(39例)表现为评分升高,50.6%(40例)维持原风险分层,未观察到评分降低病例。其中MELD-Na ≤10的患者展现出最为显著的评分动态变化特征,我们构建了总体人群(图1A)和肝硬化死亡亚组(图1B)的桑基图直观展示这一复杂转换关系。
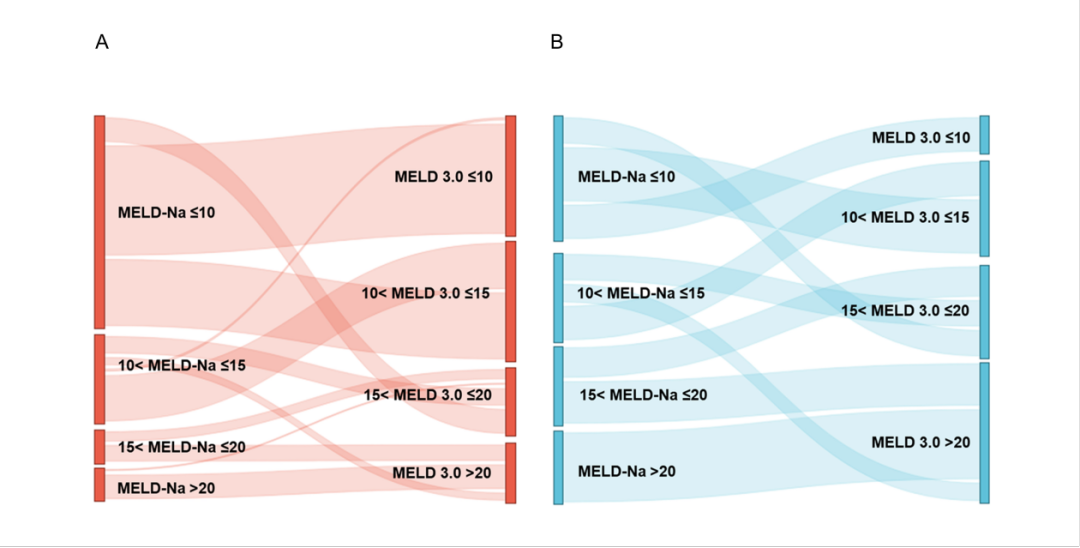
图1 桑基图显示整体研究人群(A)和死亡患者(B)中患者数量在 MELD-Na 与 MELD 3.0 之间的变化
进一步分析发现,当从MELD-Na转换为MELD 3.0和GEMA-Na时,分别有196例和194例患者出现≥2分的评分变化。具体而言,MELD 3.0转换表现为55.5%的评分上调和7.4%的下调,而GEMA-Na转换则呈现45.2%的上调和17.4%的下调。尤为重要的是,与MELD-Na相比,MELD 3.0在女性患者(63.6% vs 51%,P <0.001)和腹水患者(66.4% vs 57.7%,P <0.001)的识别上均显示出显著优势;而GEMA-Na虽在女性患者识别率上有所提升(59.9% vs 51%,P <0.001),但对腹水患者的识别准确性却出现下降(42.4% vs 57.7%,P <0.001)。
• MELD 3.0/GEMA-Na对住院肝硬化患者的预测效能评估
本研究采用time-ROC曲线分析评估各项评分对肝硬化住院患者全因死亡率的预测效能,如图2所示,MELD 3.0的曲线呈反向L形,其AUC值在大约90天时明显上升,并在180天至两年期间保持相对稳定。在模型区分能力方面,MELD 3.0表现最佳,MELD最差,而MELD-Na和MELD 3.0(无白蛋白)则居中。GEMA-Na在大约180天时达到最佳区分能力,并在两年内保持良好的效能。
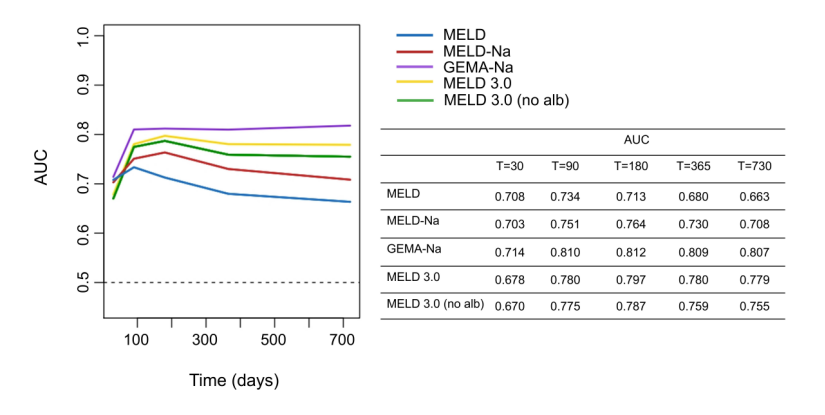
图2 基于time-ROC评估各项评分对全因死亡率的预测效能
在长期预后评估中,与MELD其他评分相比,MELD 3.0在预测2年死亡率和1年死亡率方面均表现出显著优势。与MELD 3.0相比,GEMA-Na在预测2年总死亡率方面略胜一筹(AUC:0.818 vs 0.783,P = 0.038),而在预测1年总死亡率方面两者相当(AUC:0.810 vs 0.786,P = 0.170)(如图3所示)。
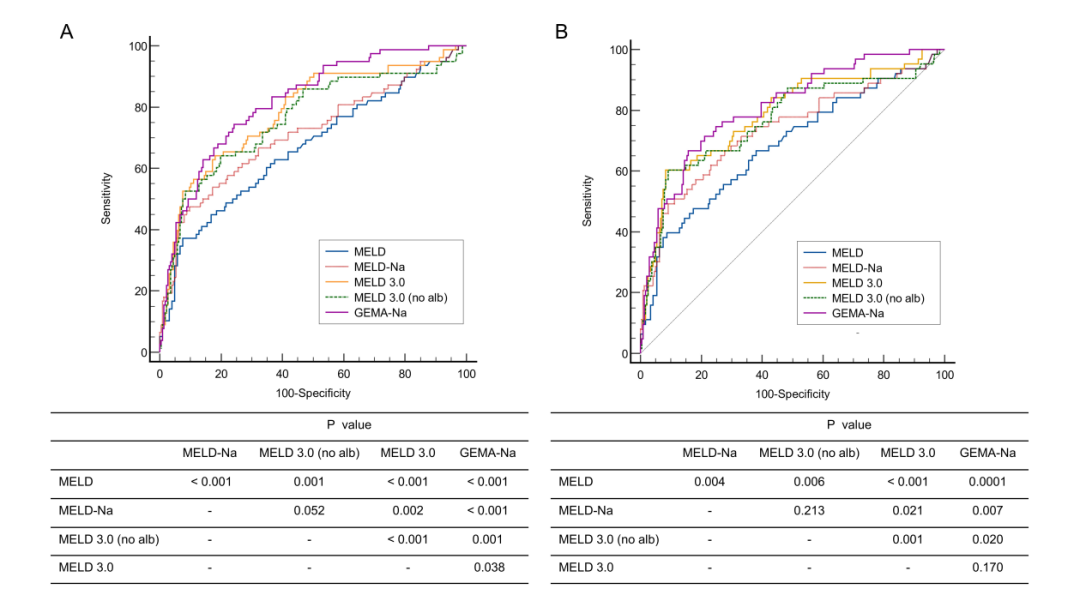
图3 各项评分对肝硬化患者两年(A)和一年(B)死亡率的预测效能
• 两年死亡率风险分层最佳截断值的确定
基于最大选择秩统计量和X-tile分析,确定MELD 3.0的最佳截断值为18,据此将患者分为高死亡风险组和低死亡风险组。结果显示,MELD 3.0 >18的患者生存结局较差(Log-rank检验:P <0.001)(图4B)。性别亚组分析表明,该阈值在男性(图4C)和女性(图4D)患者中均展现出良好的预测稳定性。此外,X-tile分析确定GEMA-Na的最佳截断值为20,这部分患者的生存状况同样较差。

图4 基于最大选择秩统计量确定两年死亡率分层的最佳截断值(A)。针对整体人群(B)、男性患者(C)和女性患者(D)绘制K-M生存曲线
• MELD 3.0/GEMA-Na风险分层与两年死亡率的关联性
单因素Cox回归分析显示,总胆红素、白细胞计数、血钠水平、血清白蛋白、肌酐、NLR、CTP分级、肝性脑病、腹水、酒精性肝硬化以及所有预后评分系统均与死亡率显著相关。在调整相关因素后,GEMA-Na(HR:1.12,95%CI:1.10-1.17,P <0.001)和MELD 3.0(HR:1.13,95%CI:1.10-1.17,P <0.001)仍是两年死亡率的独立危险因素。
• 外部队列验证
为验证上述发现,我们纳入了来自另一家三甲医院的120例失代偿期肝硬化患者作为外部验证队列(中位年龄67岁,女性占52.5%)。生存分析和多因素Cox回归同样表明,GEMA-Na(HR:4.71,95%CI:2.35-9.44,P <0.001)和MELD 3.0(HR:3.27,95%CI:1.74-6.16,P <0.001)及其相应截断值与失代偿期肝硬化的长期预后密切相关。
四、讨论
本研究通过多中心队列研究,对MELD 3.0和GEMA-Na两种新型预后评分系统在住院肝硬化患者全因死亡率的预测效能方面进行了评估。数据表明,相较于传统评分体系,这两种新型模型均展现出显著的优势,其预测准确性在长期随访过程中保持稳定,未观察到明显的时效性衰减现象。这一优势通过平滑稳定的time-ROC曲线得到了充分证实。GEMA-Na评分表现尤为突出,在两年随访期间保持AUC >0.8,成为本研究中预测效能最为稳健的评估工具。本研究具有多重价值:首先,明确了两种新型评分系统的风险分层能力;其次,证实了其与无移植生存期的独立相关性;最后,通过外部验证队列证实了所提出的截断值能有效识别失代偿期肝硬化患者的死亡风险,为临床实践提供了可靠依据。
新型预后评分系统的开发源于肝硬化流行病学特征的转变及治疗手段的进步。Godfrey等学者的研究表明,原始MELD及MELD-Na评分在预测短期死亡率方面呈现出显著的时效性衰减,而这主要归咎于肝硬化病因谱系的转变。有报道MELD相关评分系统在HCV感染或胆汁淤积性肝病患者群体中保持着良好的预测效能,在酒精性肝病和非酒精性脂肪性肝炎人群中的预测可靠性降低。这一现象与本研究高度一致:酒精性肝病已跃居肝硬化主要病因,而非酒精性脂肪性肝病(NAFLD)相关肝硬化的患病率亦呈现攀升态势。NAFLD患者常合并代谢综合征(包括高血压、血脂异常、糖尿病等)及慢性肾脏疾病等多系统功能障碍,这些病生理改变使得传统的肝功能检测参数难以准确地评估患者的真实预后。此外,酒精性肝病患者因其相对较轻的疾病负荷,在现行器官分配体系中往往获得更高的移植优先级,并表现出更好的术后恢复情况。这可能导致MELD/MELD-Na评分在实际应用中高估此类人群的生存状况。
MELD 3.0和GEMA-Na具有多重预测优势:MELD 3.0通过降低肌酐权重,有效规避了NAFLD患者因慢性肾病导致的假性肌酐水平升高的干扰[1];GEMA-Na采用肝硬化特异性RFH-GFR公式代替传统血清肌酐检测,显著减少了肾功能评估偏倚[2];此外,GEMA-Na通过对INR和胆红素的优化加权,进一步提升了预测精度[5]。
基于英国9,320例患者数据开发的GEMA-Na评分,在90天复合终点(死亡或移植名单退出)方面展现出显著临床价值,使用GEMA-Na替代MELD-Na可避免约12.5%的女性患者死亡,这与我们观察到的GEMA-Na在预测两年全因死亡率时优于MELD 3.0的结果一致。Sealock研究证实经性别校正的评分可提高女性移植率的同时降低总死亡率。Marrone团队数据显示,GEMA-Na在预测90天移植名单退出方面具有最佳性能(预测准确性提升4.4%,可避免约11.1%的病例退出)[4]。
本研究的重要发现在于确立了MELD 3.0评分在长期预后评估中的独特临床价值,其预测效能在90天时即展现出一定优势(AUC稳定维持在0.780),并在长达两年的观察中持续保持优于其他MELD评分的性能。MELD 3.0采用严谨的参数交互项进行模型优化,而非机械添加性别或白蛋白等单一变量,从而更精准地反映肝硬化患者的病生理状态。多项研究已证实MELD 3.0的临床适用性:在酒精性肝炎患者队列(71%合并肝硬化)中,该评分在预测透析需求和90天死亡率方面显著优于MELD-Na;Yoo研究团队基于东亚人群的数据表明,MELD 3.0对肝移植等待者短期预后具有更好的预测准确性[3];Song等学者在中国肝硬化人群(平均MELD 3.0评分为11.0分,与本研究队列特征相似)中的研究进一步验证了该系统在不同预后时间节点的稳健性。然而,上述研究仅针对接受TIPS治疗的特殊人群,对于普通失代偿期住院患者的临床应用仍存在证据缺口,我们的发现有效拓展了MELD 3.0的临床应用场景。这不仅为肝硬化患者的精准风险分层提供了可靠工具,还将显著优化临床决策流程,有力推动精准医疗理念在肝病诊疗领域的实践与发展。
MELD 3.0评分在本研究中表现出的卓越预测稳定性,充分反映了其对肝硬化进展过程中多系统并发症及复杂病生理改变的准确捕捉能力。值得注意的是,此评分系统与营养不良、肌少症等显著相关。我们前期多项研究证实,上述状态可通过多重机制协同恶化患者临床预后。基于现有证据,我们认为这一优化后的评分系统未来在不同临床情境下可展现出超越传统评分的价值。
本研究存在以下局限性:首先,采用回顾性队列设计可能存在选择偏倚和信息偏倚,影响因果关系的准确推断。研究对象限定为失代偿期患者,其结论可能无法推广至更广泛的肝移植群体。虽然排除慢加急性肝衰竭患者有助于控制短期死亡率对结果的干扰,但可能限制了研究结论的外延。其次,研究样本量由入组期间住院患者数量决定,未进行前瞻性的样本量估算,可能影响统计效力。第三,尽管MELD 3.0和GEMA-Na评分在多个时间节点表现出良好的稳定性,但其判别效能(AUC <0.9)仍有提升空间。整合营养状态评估等指标或可进一步提升预测准确性。第四,由于影像学检查数据的缺失,肌肉异常未被纳入分析,可能导致肌酐评估中存在未被校正的性别偏倚。
此外,缺乏评分动态变化数据也限制了对不良结局的时序性分析。需注意的是,随着流行病学特征变迁,模型预测准确性可能出现下降,且在肝恶性肿瘤、自发性细菌性腹膜炎等特定情况下适用性受限。建议在临床实践中定期更新评分,尤其在患者出现显著病情变化时更应重新评估。未来需要开展大规模前瞻性队列研究以验证当前发现,并探索通过整合多维度指标来优化预后预测模型。
五、结论
在肝硬化住院患者的长期预后评估中,MELD 3.0相较于其他MELD衍生评分更具优势,而GEMA-Na同样展现出了较高的准确性和不俗表现。这两种评分在预测两年全因死亡率方面均呈现出独立且稳健的关联性,并籍由外部验证队列得到了充分证实。未来的研究应当继续阐明将上述评分与其他临床指标相结合的可能性,以期进一步提升预测能力,力争将其应用范围延伸到更广泛的患者群体。
【参考文献】
[1] Kim WR, Mannalithara A, Heimbach JK, Kamath PS, Asrani SK, Biggins SW, et al. MELD 3.0: The Model for End-Stage Liver Disease Updated for the Modern Era. Gastroenterology 2021;161(6):1887-1895.e4. doi: 10.1053/j.gastro.2021.08.050. PMID: 34481845.
[2] Rodríguez-Perálvarez ML, Gómez-Orellana AM, Majumdar A, Bailey M, McCaughan GW, Gow P, et al. Development and validation of the Gender-Equity Model for Liver Allocation (GEMA) to prioritise candidates for liver transplantation: a cohort study. Lancet Gastroenterol Hepatol 2023;8(3):242-252. doi: 10.1016/S2468-1253(22)00354-5. PMID: 36528041.
[3] Yoo JJ, Chang JI, Moon JE, Sinn DH, Kim SG, Kim YS. Validation of MELD 3.0 scoring system in East Asian patients with cirrhosis awaiting liver transplantation. Liver Transpl 2023;29(10):1029-1040. doi: 10.1097/LVT.0000000000000126. PMID: 36929833.
[4] Marrone G, Giannelli V, Agnes S, Avolio AW, Baiocchi L, Berardi G, et al. Superiority of the new sex-adjusted models to remove the female disadvantage restoring equity in liver transplant allocation. Liver Int 2024;44(1):103-112. doi: 10.1111/liv.15735. PMID: 37752798.
[5] Majumdar A, Rodríguez-Perálvarez ML, Tsochatzis E. GEMA-Na: A crucial step in solving the MELD-creatinine dilemma. J Hepatol 2024:S0168-8278(24)02714-4. doi: 10.1016/j.jhep.2024.11.016. PMID: 39551389.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)