首页 > 医疗资讯/ 正文
黑色素瘤作为一种高度侵袭性的恶性皮肤癌,其高复发和转移能力导致临床治疗面临重大挑战。传统免疫治疗常因为低免疫原性和肿瘤乏氧微环境所引发的免疫抑制效应而疗效有限。声动力疗法(SDT)作为一种新兴的非入侵性治疗手段,可以产生丰富活性氧(ROS)诱导细胞非凋亡性死亡,从而引发高效的肿瘤免疫。因此开发能够逆转肿瘤免疫抑制并诱导高免疫原性死亡的新型声敏剂迫在眉睫。

2025年4月28日,中山大学化学学院巢晖教授团队在化学领域顶刊《Journal of the American Chemical Society》杂志在线发表了题为“Narrow-Bandgap Iridium(III)-C3N5Nanocomplex as an Oxygen Self-SufficientPiezo-Sonosensitizer for Hypoxic Tumor Sonodynamic Immunotherapy”的工作,该工作通过Ir(III)配位C3N5纳米片构建了一种新型自给氧高效压电声敏剂,在超声作用下,可以高效产生ROS诱导细胞自噬抑制和焦亡激活机体先天免疫和获得性免疫,为突破黑色素瘤免疫治疗瓶颈提供了全新解决方案。
在该工作中,研究团队创新性地将C3N5纳米片作为纳米配体,与Ir(III)配合物前体(Ir(tpy)Cl3)进行配位构建新型纳米配合物Ir-C3N5(图1)。首先,通过投射电镜(TEM)、Zeta电位和光电子能谱(XPS)验证了[Ir(tpy)Cl2]前体与C3N5纳米片的配位。随后,通过密度泛函理论(DFT)和X射线吸收近边结构(XANES)证实Ir-C3N5的配位模式为Ir与C3N5三唑环的N1单配位。
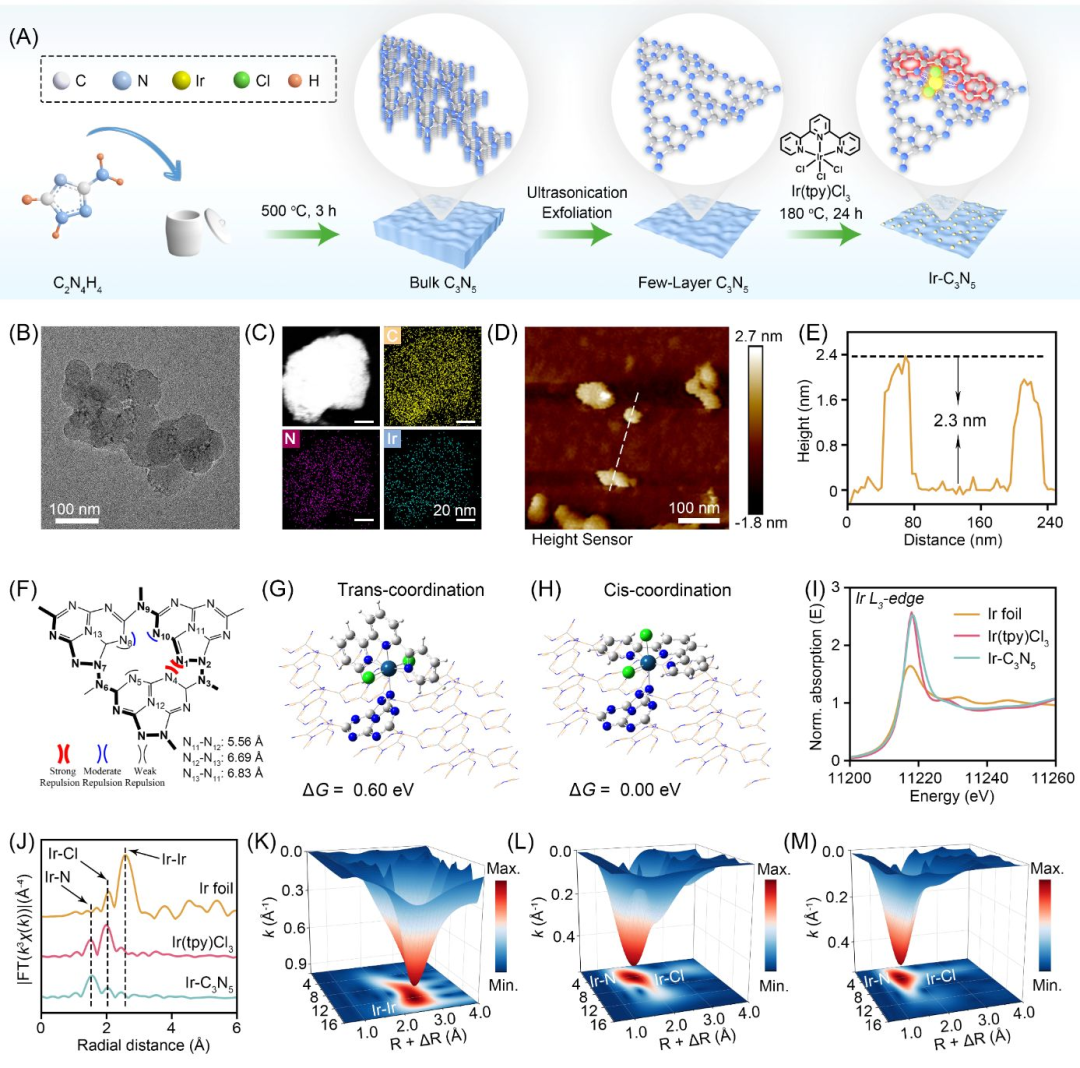
图1 Ir-C3N5纳米配合物的合成与表征(图源:Wu et al., Journal of the American Chemical Society. 2025)
作者进一步评估了Ir-C3N5纳米配合物的压电催化性能。通过压电力显微镜(PFM)显示C3N5和Ir-C3N5的压电振幅曲线均为典型的蝶形,其中Ir-C3N5的压电系数(d33= 1.98nm/V)远大于C3N5(d33= 1.26 nm/V),证实Ir(III)配位后压电效果显著增加。优异的压电特性赋予Ir-C3N5纳米配合物高效的载流子分离能力,在超声下电荷分离能力是C3N5的2.5倍,三重态寿命延长13倍(7.6→99.3 ns),在超声作用下可以产生0.73V的压电电势。理论计算揭示了Ir(III)配位调控的电子结构对压电性质影响的机理。在超声激活下电子由金属中心反向迁移至C3N5,载流子分离增强。此外,Ir-C3N5纳米配合物使偶极矩由2.04D增加到3.84D。Ir-C3N5纳米配合物展现出更窄的带隙(1.56 eV)和更大的偶极矩(3.84 D)(图2)。
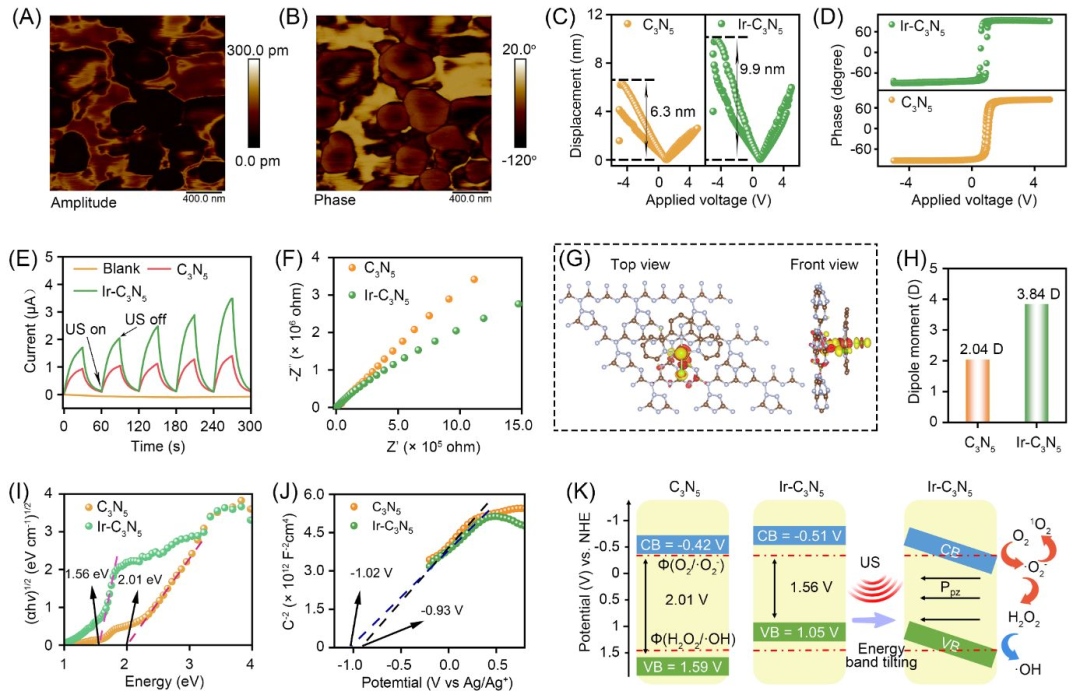
图2 Ir-C3N5纳米配合物的压电催化性能与机理
(图源:Wu et al., Journal of the American Chemical Society. 2025)
通过紫外-可见光漫反射光谱和Mott-Schottky曲线进一步确认Ir-C3N5纳米配合物的能带结构:作为n型半导体,Ir(III)配位使带隙由2.01eV降低至1.56eV,导带(CB)和价带(VB)分别为-0.51 V和1.05 V,导带电子可还原O₂生成•O₂⁻,价带空穴能氧化H₂O₂产生•OH,在超声作用下可以产生0.73V的压电势更有利于ROS的产生。电子自旋共振光谱(ESR)结果也证实了Ir-C3N5在乏氧条件下与超声与H₂O₂共同作用下可以有效产生1O2、•OH、•O2-,ROS的生成速率是TiO2的3.5倍(图3)。
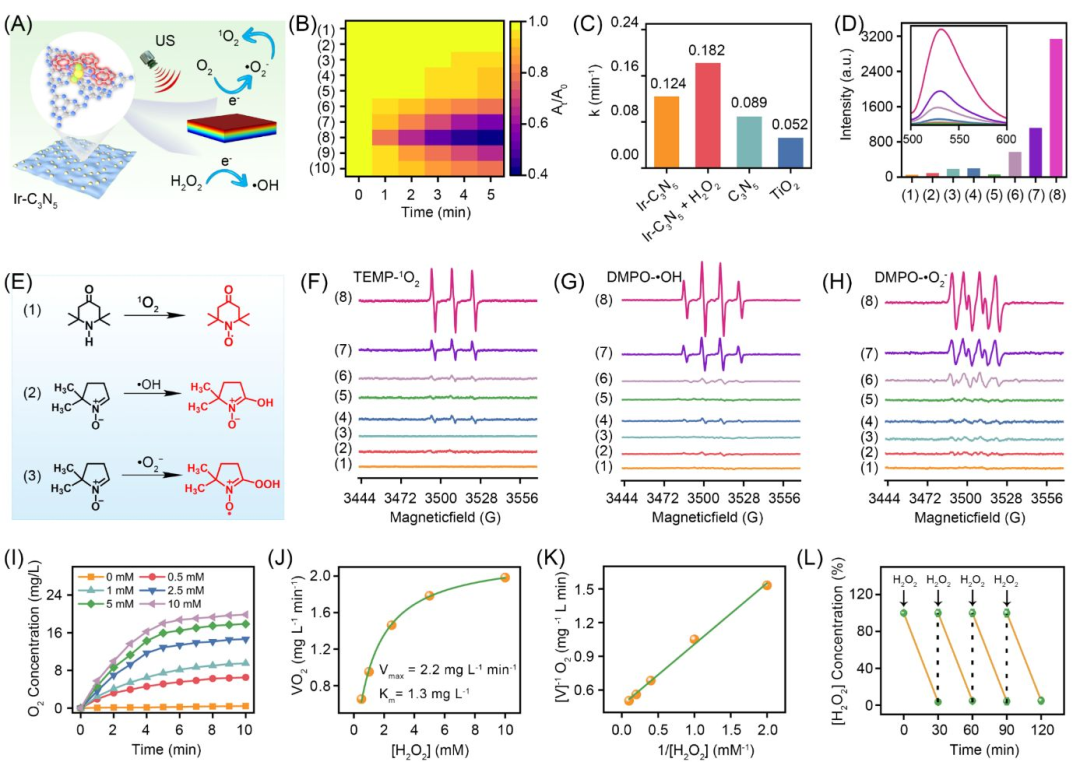
图3 Ir-C3N5纳米配合物的压电催化产生ROS和产氧性能(图源:Wu et al., Journal of the American Chemical Society. 2025)
体外细胞实验证明Ir-C3N5展现出优异的肿瘤杀伤能力,经超声处理后,A375和B16F10细胞的存活率分别为37.5%和32.1%。作者通过激光共聚焦显微镜、TEM证明Ir-C3N5纳米配合物可以有效靶向溶酶体,并在超声作用下破坏溶酶体膜。此外,通过DCFH-DA和乏氧探针证明Ir-C3N5纳米配合物可以缓解肿瘤乏氧和诱导肿瘤细胞发生氧化应激。同时,作者通过荧光成像和流式证明在超声作用下,Ir-C3N5纳米配合物可以杀伤肿瘤细胞和导致线粒体膜电位损伤(图4)。
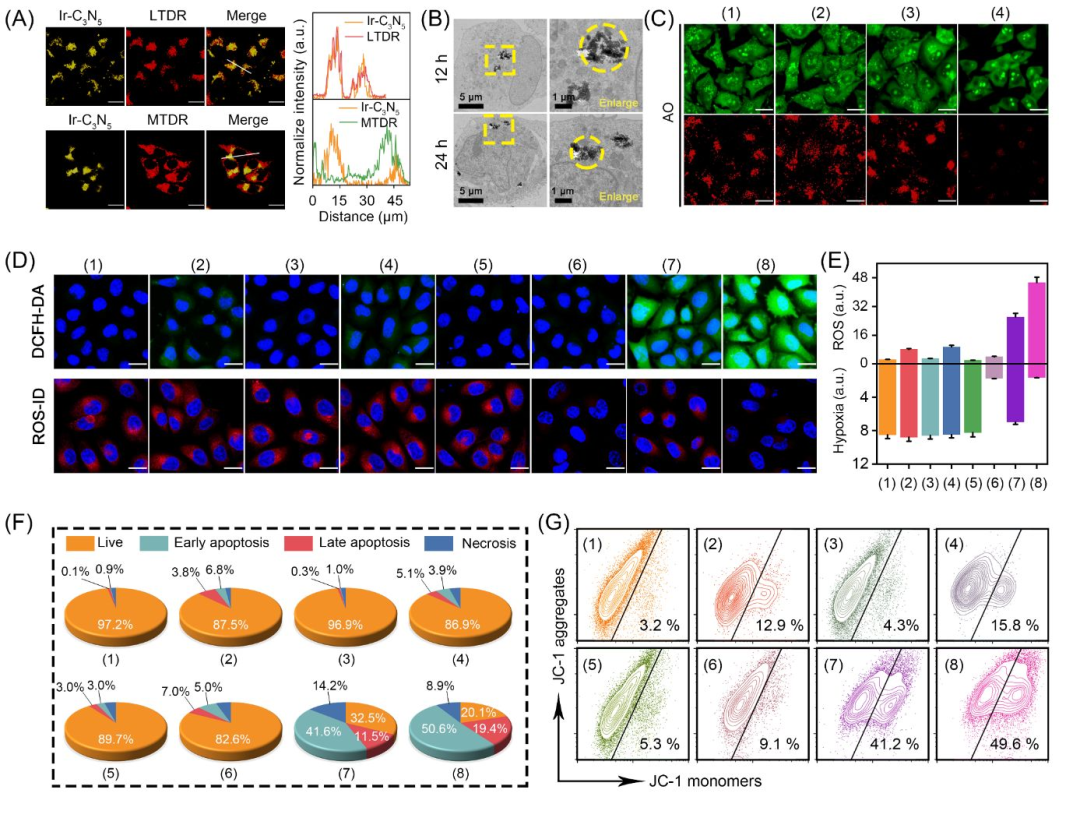
图4 Ir-C3N5纳米配合物的体外溶酶体靶向与压电催化性能(图源:Wu et al., Journal of the American Chemical Society. 2025)
作者进一步评估Ir-C3N5纳米配合物压电催化导致细胞死亡的方式。通过蛋白免疫印迹(WB)实验显示自噬标记物LC3-II蛋白水平升高3.2倍,自噬底物p62/SQSTM1积累2.5倍。同时通过TME观察到肿瘤细胞中自噬小体和自噬溶酶体的累积,证明了经过Ir-C3N5作用后,肿瘤细胞会发生自噬抑制。此外,实验结果还证明了细胞内焦亡蛋白(cleaved caspase-1,GSDMD)和炎症因子IL-1β的增加,并观察到细胞发生肿胀。综上结论,证明黑色素肿瘤细胞经过Ir-C3N5纳米配合物的压电催化治疗之后会发生自噬抑制增强的细胞焦亡(图5)。
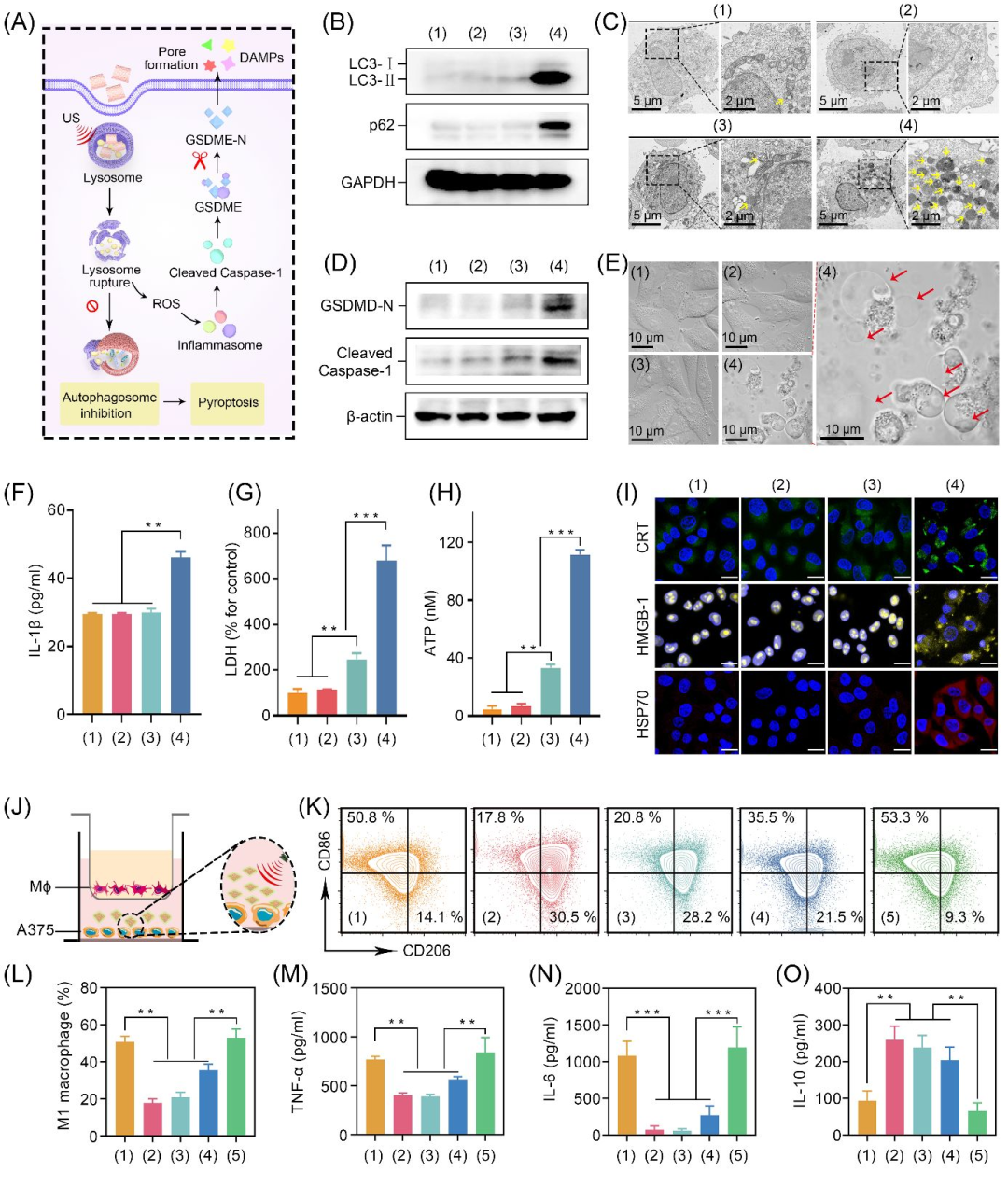
图5 Ir-C3N5纳米配合物的自噬、焦亡与免疫激活检测(图源:Wu et al., Journal of the American Chemical Society. 2025)
基于小鼠皮下肿瘤模型,作者系统评估了Ir-C3N5纳米配合物的体内抗肿瘤效果。结果显示,“Ir-C3N5 + US”组对原发和远端肿瘤的抑制率均超过96%。流式免疫结果进一步证明经过Ir-C3N5 + US组治疗后,小鼠肿瘤中M1型巨噬细胞增多、M2型巨噬细胞下降,细胞毒性T细胞和辅助性T细胞激活,脾脏中树突细胞(DC)成熟。此外,通过RNA测序,“Ir-C3N5 + US”组显著激活了肿瘤细胞焦亡、免疫细胞浸润和免疫反应相关通路,包括IL-1β的产生、T细胞活化、自然杀伤细胞活化、适应性免疫反应和免疫反应活化(图6)。
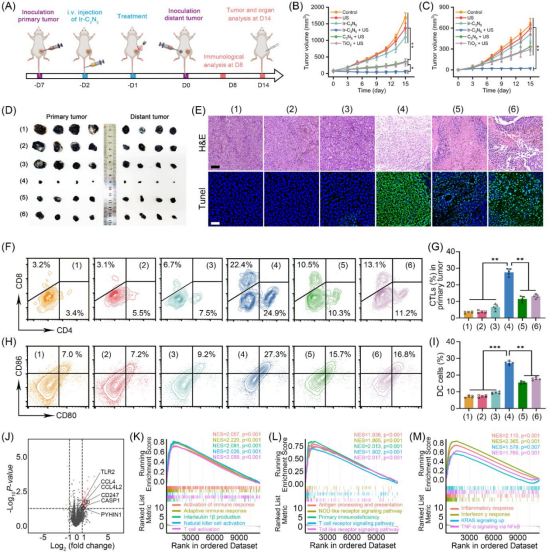
图6 Ir-C3N5纳米配合物压电催化激活免疫反应及转录组学分析(图源:Wu et al., Journal of the American Chemical Society. 2025)
在黑色素瘤转移性前哨淋巴结模型中也观察到记忆T细胞(Tem)比例增加2.5倍,肺转移结节减少83.9%,证明经过Ir-C3N5纳米配合物的免疫治疗可以有效抑制肿瘤转移。同时Ir-C3N5尾静脉注射后优先富集于肿瘤(24小时达峰值),主要脏器未见损伤,体重波动<5%,并可以通过粪便和尿液代谢(96小时清除率>90%),血液生化指标正常(溶血率<2.5%)证明其高靶向性与生物安全性(图7)。
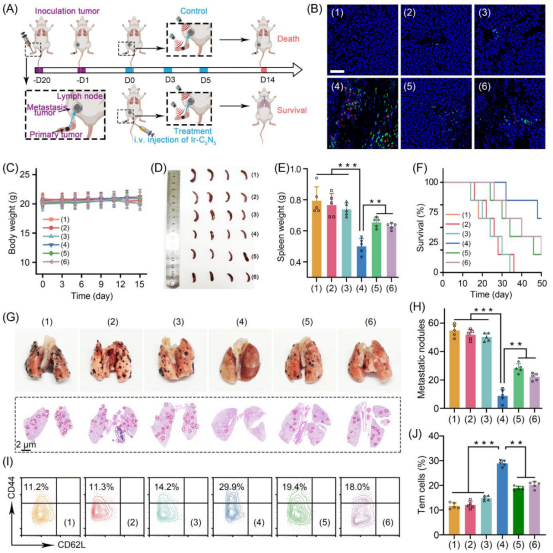
图7 淋巴结免疫反应和淋巴肿瘤治疗(图源:Wu et al., Journal of the American Chemical Society. 2025)
综上所述,该研究构建了一种用于乏氧的窄带隙压电声敏剂Ir-C3N5纳米配合物,经过Ir(III)配位之后,纳米片展现出优异的压电催化性能。Ir-C3N5可以高选择性地靶向肿瘤细胞的溶酶体中,可以有效抑制HIF-1α和VEGF-A的表达,从而逆转肿瘤乏氧微环境造成的免疫抑制。同时,Ir-C3N5的压电催化可以诱导细胞溶酶体破裂并触发自噬抑制和焦亡,激活肿瘤细胞ICD,触发免疫反应,实现高效抗肿瘤与长期抗肿瘤免疫记忆,有效抑制肿瘤生长与转移。
论文第一作者为中山大学博士生吴贤波,通讯作者为中山大学巢晖教授和广州大学张喜庭副教授。该研究得到国家自然科学基金、湖南省科技创新计划项目和聚合物复合材料及功能材料教育部重点实验室基金的支持。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)