首页 > 医疗资讯/ 正文
综 述
血管性认知障碍(VCI)是由慢性脑低灌注(CCH)、脑缺血再灌注(CI/R)等脑血管因素引起的一类认知障碍综合征,包括从轻度认知功能损害到血管性痴呆,占所有痴呆病例的20%~40%,成为第二大痴呆类型[1]。VCI发病率随年龄增长而显著升高,在老年人群中尤为显著。国内流行病学调查显示,在65岁及以上人群中,约8.7%患有VCI [2]。VCI患者临床表现为记忆、学习能力下降和认知功能缺陷,严重影响其日常生活。然而,现有治疗手段对VCI的干预疗效有限,亟需进一步研究其发病机制,以开发更有效的治疗方法。
线粒体是具有多种功能的动态细胞器,是细胞进行有氧呼吸并利用氧化磷酸化产生三磷酸腺苷(ATP)的场所,在能量代谢、钙稳态中发挥关键作用。自噬是细胞降解、回收蛋白质和细胞器以维持细胞内稳态的过程,根据底物进入溶酶体的形式,可分为巨自噬、分子伴侣介导的自噬及微自噬[3]。线粒体自噬属于巨自噬,其通过线粒体衍生的囊泡选择性识别受损或功能异常线粒体,随后将其运输至溶酶体或过氧化物酶体进行分解和清除,从而维持细胞的能量平衡与代谢稳态[4]。
近年来研究表明,线粒体自噬与神经退行性疾病密切相关[5],适当调节线粒体自噬水平可改善脑组织的病理特征,缓解氧化应激、炎症反应,抑制神经元凋亡,从而减轻神经损伤、提高认知功能。因此,线粒体自噬在VCI进程中可能扮演重要角色。故本文回顾近年来线粒体自噬与VCI病理特征的关系研究,分析其在VCI中的调控机制,探讨以线粒体自噬为靶点的潜在治疗策略。
1 线粒体与线粒体自噬
大脑是一个高耗能器官,其氧气和能量的消耗占人体总量的20%,因此中枢神经系统细胞易受到缺血和缺氧影响,显著损害脑功能[6]。脑部组织所需能量大部分来源于线粒体,其是产生能量的关键细胞器,对细胞代谢和存活至关重要,特别是在维持神经元的功能和活性方面。在缺血、缺氧期间,葡萄糖和氧气供应减少,导致线粒体氧化磷酸化解偶联及ATP酶活性降低,这种能量缺乏与线粒体的钙稳态、氧化还原平衡、自噬和质量控制机制紊乱相关,干扰了神经递质的释放和传递、神经元发育、髓鞘形成和轴突运输等关键生理过程,最终可能导致神经元功能障碍和细胞死亡。因此,线粒体质量和功能保持相对稳定对于机体正常生理活动尤为重要。线粒体质量控制系统由线粒体生物发生、线粒体动力学和线粒体自噬三大过程构成,其中线粒体自噬途径对海马神经元的存活至关重要,直接影响VCI的发展。
线粒体自噬是一种巨自噬形式,其通过自噬-溶酶体途径选择性识别衰老或受损线粒体,并吞噬这些线粒体,从而保持线粒体功能正常运行及细胞内环境稳态[7]。目前,线粒体自噬途径主要包括两大类:磷酸酯酶与张力蛋白同源物(PTEN)诱导假定激酶1(PINK1)/帕金森病蛋白(Parkin)信号通路介导的泛素化通路和Bcl-2/腺病毒E1B-19 kDa相互作用蛋白3(BNIP3)/Nip3样蛋白X(NIX)以及FUN14结构域包含体蛋白1(FUNDC1)受体蛋白介导的通路。
此外,磷脂酰肌醇3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶B(Akt)/哺乳动物雷帕霉素靶标(mTOR)和AMPK通路能够靶向线粒体自噬泛素化酶及受体蛋白,间接调控线粒体功能。然而,线粒体自噬是一把双刃剑,适量的线粒体自噬支持细胞内稳态和线粒体质量控制,而无序或过度的线粒体自噬可导致线粒体丢失和细胞凋亡增加[8],因此正确调节线粒体自噬水平有助于疾病防治。
2 线粒体自噬在VCI中的作用
线粒体是参与细胞能量代谢最重要的细胞器,在细胞信号转导、自由基产生和细胞凋亡诱导中发挥关键作用,决定细胞的存亡。在脑组织长期缺血、缺氧过程中,海马区发生多种病理变化,如氧化应激、神经炎症、神经元凋亡,最终引起大脑学习、记忆及认知功能损伤,导致VCI。研究发现,线粒体自噬与这些生物过程相互作用以调节线粒体质量,影响神经细胞的存活。
2.1 调节氧化应激水平
氧化应激是VCI的重要病理机制。脑组织长期缺血、缺氧引起线粒体功能障碍,产生大量氧化物质导致线粒体DNA、膜蛋白和脂质分子氧化,引起线粒体膜电位丧失以及通透性转换孔病理性开放[9],导致活性氧(ROS)、活性氮释放过量,发生氧化应激,启动细胞凋亡级联反应,加重VCI [10]。而线粒体自噬机制的存在能够及时处理损伤的线粒体和过量线粒体活性氧(mtROS)[11]。研究表明,一定程度上激活线粒体自噬可有效减少线粒体ROS积累,缓解认知损伤[12]。
此外,有研究发现,缺血预处理可激活线粒体自噬,保护线粒体功能,并抑制线粒体去极化和ROS产生,防止组织再灌注损伤[13]。上述研究结果表明,线粒体自噬可通过减少活性氧含量,降低氧化应激程度,进而改善VCI。相反,线粒体自噬对受损线粒体的清除不充分也可导致氧化产物增加,使氧化应激水平增高,进而加重VCI[14]。因此,靶向线粒体自噬调控VCI的氧化应激水平,可能为疾病治疗提供新思路。
2.2 调控神经炎症
神经炎症是中枢神经系统对病原体或各种病理生理机制(如生物能量失衡、兴奋性、线粒体功能障碍和氧化应激)的反应,通常导致大脑常驻免疫细胞(如神经胶质细胞)产生促炎细胞因子和趋化因子增加,以及外周免疫细胞浸润。据报道,炎症反应贯穿VCI发展的始终,在VCI 患者体内可检测到白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α 和 C 反应蛋白等水平升高,这些经典炎症介质导致组织基质降解和外周免疫细胞浸润,最终引起各种形式的细胞凋亡[1]。
CCH期间,线粒体功能障碍导致线粒体ROS的释放和累积,随后激活炎症小体,从而引发细胞焦亡。He等[15]在大脑中动脉闭塞大鼠模型中发现,增强线粒体自噬可显著抑制核苷酸结合寡聚结构域样受体蛋白3(NLRP3)炎症小体介导的炎症反应,改善脑损伤。此外,Ding等[16]研究发现,线粒体自噬激活后,脑损伤模型大鼠的脑微血管内皮细胞炎症因子水平显著降低,认知功能障碍明显改善。因此,深入探究线粒体自噬与神经炎症之间的潜在机制,有助于VCI的防治。
2.3 调控神经元凋亡
海马神经元与学习和记忆能力密切相关,且其存活受B淋巴细胞瘤-2 (Bcl-2)和Bcl-2相关X蛋白(Bax)以及半胱天冬酶3/9(caspase- 3/9)等凋亡相关基因调控,因此抑制神经元凋亡可能有助于改善VCI患者的认知功能[17]。在脑缺血早期,线粒体功能障碍引起细胞色素C泄露、ROS增加、线粒体自噬途径受阻,导致神经元凋亡,而线粒体自噬的激活通过识别和清除过多的ROS、膜电位下降或呼吸链功能异常线粒体,减少细胞色素C的释放,进而抑制caspase-9和 caspase-3的激活,最终抑制细胞凋亡。Wu等[18]研究发现,激活线粒体自噬能够抑制大脑中动脉闭塞(MCAO)小鼠的神经元凋亡。然而,也有研究发现,在MCAO大鼠体内注射线粒体抑制剂后加重了神经元凋亡[19]。上述研究提示,线粒体自噬在抑制VCI的神经元凋亡方面起着重要作用。
3 线粒体自噬在VCI中的调控途径
血管异常、脑血流量持续减少是VCI的主要病理因素,CCH、脑组织缺血缺氧导致线粒体膜电位破坏、神经元氧化应激、神经炎症、兴奋性毒性和自噬通路异常激活[20]。在与认知相关的神经系统疾病试验中,可检测到海马区线粒体自噬相关蛋白异常表达[21]。线粒体自噬系统紊乱引起线粒体质量和数量控制失调,严重损害神经细胞正常功能,最终导致认知功能下降[22]。现对VCI中常见的线粒体自噬途径进行阐述,线粒体自噬机制详见图1。
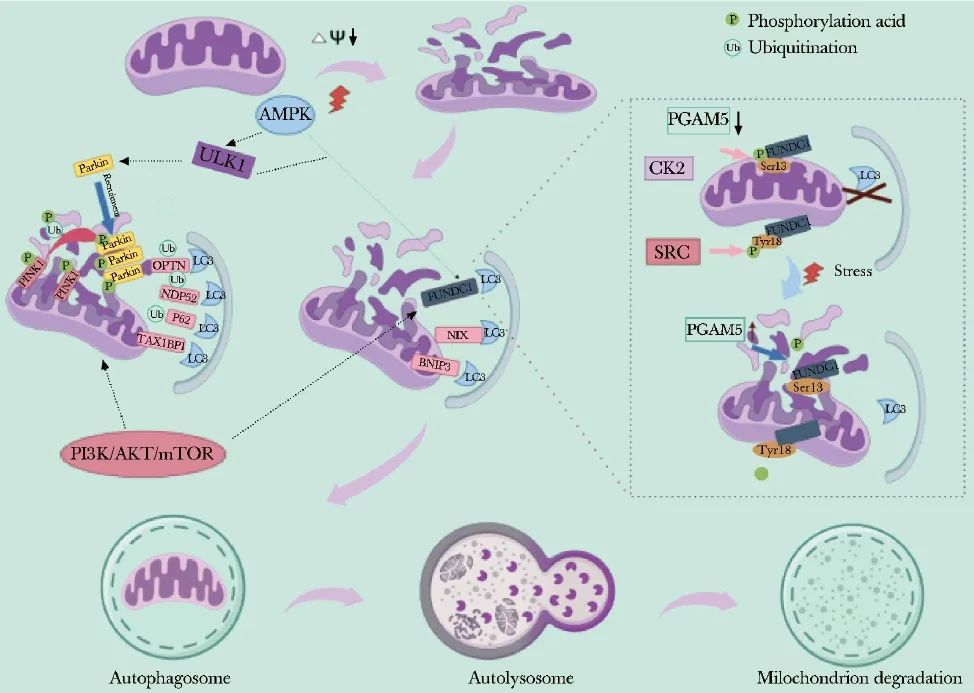
图1 线粒体自噬机制图
Phosphorylation acid:磷酸化;Ubiquitination:泛素化;AMPK:腺苷5′-单磷酸活化蛋白激酶;ULK1:UNC-51样自噬激活激酶1;PINK:磷酸酯酶与张力蛋白同源物(PTEN)诱导假定激酶;Parkin:帕金森病蛋白;OPTN:磷酸化视神经蛋白;NDP52:核仁点蛋白52;TAXBP1:TAX1结合蛋白1;LC3:微管相关蛋白1轻链3;PI3K/Akt/mTOR:磷脂酰肌醇3-激酶/丝氨酸/苏氨酸蛋白激酶B/哺乳动物雷帕霉素靶标;BNIP3:B淋巴细胞瘤-2/腺病毒E1B-19kDa相互作用蛋白3;NIX:Nip3样蛋白X;FUNDC1:FUN14结构域包含体蛋白1;PGAM5:磷酸甘油变位酶家族蛋白5;CK2:酪氨酸激酶Ⅱ;SRC:原癌基因酪氨酸蛋白激酶;Autophagosome:自噬体;Autolysosomes:自噬溶酶体;Mitochondrion degradation:线粒体降解
注:本图采用Figdraw绘制(By Figdraw)
3.1 PINK1/Parkin介导的线粒体自噬途径
PINK1是一种靶向线粒体应激的丝氨酸/苏氨酸泛素激酶,其下游分子Parkin是驻留在胞质溶胶中的E3泛素连接酶,大部分线粒体自噬是由PINK1/Parkin通路介导,被认为是中枢神经系统最有前景的靶点[23]。正常情况下,PINK1在线粒体内膜(IMM)被基质加工肽酶和早老素相关菱形样丝氨酸蛋白酶依次切割和降解,以低水平存在于细胞中[24]。
CCH或I/R期间,脑组织出现缺血、缺氧,线粒体膜电位降低,线粒体外膜(OMM)发生去极化,PINK1通过OMM上移位酶的作用而稳定于外膜上,募集和磷酸化Parkin,并泛素化多种线粒体外膜蛋白[25],如自噬衔接蛋白p62/SQSTM1(sequestosome 1)、核仁点蛋白52(NDP52)、磷酸化视神经蛋白(OPTN)、BRCA邻近基因1(NBR1)和TAX1结合蛋白1(TAX1BP1)[26]。
Parkin蛋白通过结合泛素结合结构域进而与微管相关蛋白1轻链3(MAP1LC3)相互作用,导致泛素化蛋白转移至线粒体自噬体,并与溶酶体酶结合,形成自噬溶酶体。最后,泛素化蛋白被溶酶体水解酶降解,触发自噬。p62通过与LC3和其他蛋白质结合被溶酶体降解,从而完成线粒体自噬过程,以维持线粒体稳态[27]。
在轻度认知功能障碍患者体内及VCI动物海马中均可检测到PINK1和Parkin水平显著降低以及线粒体自噬功能障碍。研究发现,PINK1/Parkin线粒体自噬途径是膳食亚精胺(一种促进自噬的天然多胺)改善认知功能障碍的作用机制之一[28]。尽管大量证据表明,PINK1/Parkin介导的线粒体自噬在脑缺血再灌注损伤后是有益的,但并非所有研究均认为线粒体自噬水平上调对中枢神经系统有益,过度的线粒体自噬反而会引起线粒体功能受损,加速神经元凋亡,影响认知功能。研究发现,过度激活PINK1/Parkin信号通路,可增加线粒体损伤和细胞凋亡相关蛋白表达,促进细胞凋亡,而敲低PINK1可抑制神经损伤,改善认知功能[29]。
一些研究通过调控PINK1/Parkin信号通路的上游因子,以探究改善脑缺血损伤的潜在机制。沉默调节蛋白Sirtuins(SIRT)是一种依赖烟碱腺嘌呤二核苷酸(NAD+)的组蛋白脱乙酰酶家族,其中SIRT1、SIRT3主要存在于细胞核、线粒体内,调节线粒体代谢、氧化应激、自噬、DNA修复和炎症相关等多种关键信号通路。在中动脉闭塞的小鼠模型中,神经酰胺激酶样蛋白(CERKL)[30]和Apelin-36神经肽[31]均通过促进SIRT1稳定性,介导PINK1/Parkin依赖性线粒体自噬,从而降低海马神经元氧化应激水平、缓解线粒体功能障碍。拟黑多刺蚁的活性成分(AFPR)[32]及二甲双胍[33]通过上调SIRT3介导的PINK1/Parkin信号通路刺激线粒体自噬,可延缓认知功能障碍发生。
此外,研究表明,转录共激活因子过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)作为STRT1靶向调控的下游蛋白之一,可直接参与调控线粒体自噬[34]。Han等[35]在VD模型中发现,海马神经元PGC-1α过表达可显著改善小鼠的认知缺陷,为进一步揭示其参与的信号通路,采用KEGG通路分析[36],结果表明线粒体自噬途径是PGC-1α改善VD小鼠认知功能损伤的潜在机制,但具体信号通路有待探究。二十二碳六烯酸(DHA)是机体必需的多不饱和脂肪酸,具有促进神经发育、延缓脑组织衰老、增强记忆功能等作用。研究发现,DHA可增加神经元LC3、PINK1和Parkin的表达水平,改善线粒体功能,对于脑缺血小鼠具有良好治疗效果,可减轻脑梗死面积、神经元凋亡和行为功能障碍[37]。
综上,PINK1/Parkin介导的线粒体自噬在维持线粒体功能稳态和改善脑缺血再灌注损伤及认知功能障碍中发挥重要作用,通过调控上游因子如SIRT1、SIRT3、PGC-1α及补充DHA等干预手段,可激活或调节该通路,从而减轻氧化应激反应、改善线粒体功能障碍,并延缓神经退行性病变。然而,线粒体自噬的过度激活可能对神经元产生不利影响,因此未来研究需进一步探索其精确调控机制,以期为中枢神经系统疾病的治疗提供安全有效的靶向策略。
3.2 BNIP3/NIX受体介导的线粒体自噬途径
BNIP3/Nip样蛋白(NIX/BNIP3L)最初仅被认为是Bcl-2家族促凋亡蛋白,近年来研究发现其定位于OMM,且发挥线粒体自噬调节剂作用。BNIP3和NIX中的BH3结构域可直接结合LC3,促进线粒体与自噬体结合[38]。此外,BH 3结构域竞争性结合Bcl-2和自噬相关蛋白Beclin-1,介导细胞的线粒体自噬。
Wu等[39]构建了永久性脑缺血小鼠模型,发现BNIP3的二聚体形式在泛素-蛋白酶体途径中降解,导致线粒体自噬减少。Yuan等[40]在MCAO模型小鼠中发现,BNIP3基因敲除后,线粒体自噬功能受损,脑缺血再灌注损伤加重,而BNIP3基因过表达可通过抑制胱天蛋白酶3活化而减轻神经元损伤。MCAO/R模型大鼠经铂诱导后,自噬蛋白BNIP3高表达,BNIP3与LC3的免疫共沉淀增强,脑梗死病变显著减少,神经学评分明显升高,表明上调BNIP3/LC3线粒体自噬信号通路可改善脑组织缺血、缺氧损伤[41]。
研究发现,靶向BNIP3/NIX可治疗缺血、缺氧诱导的脑损伤,进而改善认知能力。微核糖核酸(microRNA,miRNA)-137是新的缺氧反应性miRNA,早期发现其通过靶向线粒体自噬受体FUNDC1和NIX,显著抑制缺氧诱导的线粒体过度自噬[42]。研究表明,升高miR-137表达可抑制NIX基因表达,减轻缺血再灌注过程中线粒体的过度自噬,减轻氧化应激水平和炎症反应,进而改善大鼠脑损伤,发挥神经元保护作用,保护认知功能[43]。但在OGD/R诱导HT22小鼠海马神经元模型中,通过miR-182-5p靶向BINP3基因,却激活线粒体过度自噬,促进神经元损伤,加重认知功能障碍[44]。此外,糖皮质激素可与受体结合,直接与PGC-1α启动子相互作用,下调其表达,选择性减少了NIX依赖性途径中的线粒体自噬,导致突触功能障碍和细胞凋亡,损伤学习记忆能力,加重认知功能障碍[45]。综上,BNIP3/NIX亦是脑组织缺血损伤导致VCI的潜在治疗靶点。
3.3 FUNDC1受体介导的线粒体自噬途径
FUNDC1是一种位于OMM上的蛋白质,其通过磷酸化和去磷酸化调节线粒体自噬活性而响应细胞内信号变化。在磷酸化过程中,UNC-51样自噬激活激酶1(ULK1)通过磷酸化FUNDC1的Ser17,促进线粒体自噬激活。相反,原癌基因酪氨酸蛋白激酶(SRC)和酪氨酸激酶Ⅱ(CK2)激酶通过磷酸化Tyr18和Ser13位点,破坏FUNDC1与LC3的相互作用,抑制线粒体自噬。在CCH或脑组织缺血、缺氧情况下,SRC活性受到抑制,FUNDC1发生去磷酸化,其与LC3之间的相互作用增强,进而促进受损线粒体自噬[46]。磷酸甘油变位酶家族蛋白5(PGAM5)通过去磷酸化Ser13以增强FUNDC1与LC3之间的相互作用,从而激活线粒体自噬[47]。FUNDC1过表达增加了线粒体自噬和细胞增殖[48]。Zhang等[49]研究证实,FUNDC1在线粒体自噬中的调节作用与神经细胞凋亡相关。Wang等[50]在脑梗死的PC-12细胞模型中发现,ULK1过表达增强了FUNDC1活性,从而减轻缺氧PC-12细胞的凋亡。因此,推测FUNDC1可能通过调节细胞线粒体自噬而对缺血神经元发挥保护作用,但其机制尚不明确。FUNDC1能否通过调节线粒体自噬影响VCI的发生发展,尚待进一步研究证实。
值得注意的是,线粒体分裂和融合是线粒体发生自噬的先决条件。在正常条件下,FUNDC1通过与OPA1相互作用参与线粒体融合过程,而在缺氧时,PGAM5与FUNDC1Ser13位点的LC3相互作用结构域结合,使FUNDC1去磷酸化,进而从OPA1解离,继而与Drp1相互作用,诱导线粒体裂变[51-52],促进线粒体自噬。Chai等[53]首次报道在缺氧条件下,泛素特异性肽酶19(USP19)可在内质网-线粒体接触位点与FUNDC1结合并使其去泛素化,促进Drp1寡聚化、GTP结合和水解,并驱动线粒体分裂。
3.4 PI3K/Akt/mTOR通路介导的线粒体自噬治疗VCI
PI3K/Akt/mTOR信号通路被认为是调节细胞自噬的经典通路,其具体作用机制为:激活的PI3K生成第二信使PIP3,PIP3与磷酸肌醇依赖性激酶1(PDK1)的PH结构域结合使其激活,进而通过磷酸化下游分子Akt,影响其下游的mTOR复合体,从而抑制自噬发生。然而,近年来不少研究表明,该通路也与线粒体自噬具有密不可分的联系。Liu等[54]在慢性肾小球肾炎模型大鼠中研究发现,抑制PI3K/Akt/mTOR通路,PI3K、p-Akt和p-mTOR蛋白表达下调,而线粒体自噬相关蛋白p62、HSP60、TOMM20表达升高,且LC3与线粒体标志物COXIV的共定位增强。Sun等[55]也在研究中发现,PI3K/Akt/mTOR能够调节线粒体自噬。雷帕霉素被广泛用作mTOR变构抑制剂,可直接与mTOR复合物结合,刺激多种真核生物自噬。研究发现,雷帕霉素可通过增加自噬以改善AD大鼠的认知功能缺陷[56],表明PI3K/Akt/mTOR通路介导的自噬与认知功能密切相关。
此外,Zhang等[57]在双侧颈总动脉结扎诱导的VD大鼠模型中研究发现,雷帕霉素组VD大鼠的空间记忆力较模型组明显改善,线粒体自噬体数量增加,PINK1、Parkin和LC3B的表达水平进一步上调,而使用mTOR激活剂MHY1485后,逆转了雷帕霉素的治疗作用,进一步支持了PI3K/Akt/mTOR通路可通过激活PINK1-Parkin介导的线粒体自噬,进而改善VD症状。然而,有证据表明,PI3K/Akt/mTOR通路可抑制FUNDC1受体介导的线粒体自噬,恢复线粒体膜电位水平、ATP含量,并降低ROS含量、减少细胞凋亡[58]。上述研究结果表明,PI3K/Akt/mTOR能够动态调节线粒体自噬并改善VCI。
3.5 AMPK通路介导的线粒体自噬治疗VCI
除上述分子机制外,腺苷5′-单磷酸活化蛋白激酶(AMPK)通路正成为线粒体代谢和线粒体自噬的关键参与者,是另一种在线粒体稳态中发挥广泛作用的细胞应激感应通路。细胞能量传感器AMPK是一种异源三聚体全酶,由三个亚基组成:催化α(α1或α2)、支架β(β1或β2)和调节γ(γ1、γ2或γ3)亚基。在生理条件下,AMPK通过监测线粒体AMP或ADP水平以感知细胞能量状态,AMP 或 ADP与 AMPK的γ亚基结合,导致构象变化,催化α亚基在T172位点发生磷酸化,最终使AMPK活化。据报道,线粒体泛素化酶Parkin在线粒体应激后,通过AMPK/ULK1信号转导通路在ACT结构域的Ser108位点快速发生磷酸化,进而激活线粒体自噬[59]。Guo等[60]研究发现,二甲双胍可有效降低脑缺血再灌注损伤,其具体作用机制是通过激活AMPK/ULK1/PINK1-Parkin通路,增加线粒体自噬水平,恢复线粒体膜电位,减少脑梗死体积和神经元凋亡,发挥VCI神经保护作用,但自噬抑制剂3-甲基腺嘌呤(3MA)和AMPK抑制剂化合物C逆转了这种保护作用。此外,p-AMPK也可激活FUNDC1介导的线粒体自噬途径,改善线粒体功能,抑制细胞凋亡并挽救再灌注损伤[61]。
4 通过影响线粒体自噬改善VCI的药物和疗法
4.1 中药治疗
近年来,大量研究发现中药可通过靶向线粒体自噬改善VCI[62-63],主要有滋肾活血汤、补阳还五汤、川芎内酯、灯盏细辛注射液、姜黄素、红景天苷、羟基红花黄色素A、补肾益智方(表1)。
表1 近5年中药调控线粒体自噬改善VCI的研究

研究已证实滋肾活血汤可改善认知障碍。Zhao等[64]以滋肾活血汤(1 mL/100 g)连续灌胃 VD大鼠28 d,发现其以剂量依赖性改善2VO模型大鼠的学习记忆功能,并逆转其海马CA1区神经元病理性损伤,该药方治疗作用与上调PINK1、Parkin蛋白表达和LC3Ⅱ/LC3Ⅰ比率、下调p62的表达,通过PINK1/Parkin轴增强线粒体吞噬功能,改善痴呆大鼠海马CA1区线粒体的结构和功能,减轻氧化应激和神经细胞凋亡,从而达到改善痴呆大鼠认知功能,提高学习和空间记忆的疗效。
补阳还五汤具有益气、补血之效,临床上多用于治疗脑血管疾病。在大脑中动脉闭塞模型大鼠中观察到,补阳还五汤可使MCAO/R大鼠线粒体自噬体增多,LC3Ⅱ/LC3Ⅰ比率升高,p62蛋白表达抑制,PINK1和Parkin蛋白表达增强,以及焦亡相关蛋白表达降低,发挥对CI/R的神经保护作用[65]。
川芎内酯是从川芎和当归中提取的天然化合物,也具有强大的神经保护作用。Mao等[66]研究显示,在脑缺血体内外实验中,川芎内酯通过调节PINK1/Parkin通路中关键蛋白的表达,改善神经元损伤,进而改善认知障碍。而当PINK1基因选择性敲除或线粒体自噬抑制剂(midivi-1)和川芎内酯联用时,川芎内酯的治疗作用被逆转。
灯盏细辛注射液(DX)是一种从中药灯盏细辛中提取的制剂,含有野黄芩苷、二咖啡酰基奎宁酸、咖啡酸等多种成分,在我国广泛应用于脑缺血后遗症的临床治疗。Yang等[67]研究发现,在MCAO模型大鼠中,DX对脑缺血的保护作用归因于线粒体自噬上调。与模型组相比,DX可显著改善缺血引起的神经功能缺损、区域性脑血流量不足和脑梗死,显著降低活性氧和丙二醛水平,逆转线粒体自噬障碍,通过增加自噬溶酶体数量以维持线粒体超微结构,提高线粒体自噬相关LC3、PINK1和Parkin蛋白的表达,降低p62和TOM20蛋白的表达。
姜黄素是从传统食用中药中提取的复合物,防治IC/R损伤。Wang等[68]通过体外实验研究发现,姜黄素能够改善MCAO/R大鼠的神经功能评分,减少脑梗死面积;免疫荧光结果显示,LC3B与VDAC1的共定位信号增强,表明姜黄素通过改善线粒体自噬和保留线粒体功能而防止脑I/R损伤。已知过度的炎症反应可引起细胞凋亡、血脑屏障损伤等病理变化,触发或加重VCI及痴呆的发展[69],而线粒体自噬可降低缺血、缺氧诱导的神经炎症水平。
红景天苷(SAL)是中药红景天的提取物,其药理功效多样,具有抗氧化、抗炎、促进血管生成、调节自噬等作用。荣幸等[70]对颈内外动脉结扎模型大鼠腹腔注射SAL后,发现大鼠脑组织SOD水平升高,MDA水平降低,BNIP3/NIX蛋白表达及LC3Ⅱ/LC3Ⅰ水平显著升高,然而给予线粒体抑制剂Mdivi-1后,BNIP3和LC3蛋白表达均被抑制,SAL的神经保护作用发生逆转。上述研究结果提示,SAL可能通过激活BNIP3/NIX信号通路,上调自噬发挥抗氧化作用,减轻大鼠脑缺血损伤,改善其认知功能。
羟基红花黄色素A(HSYA)是一种属于单查尔酮类化合物的糖苷,是中药藏红花中最有效的水溶性单体成分,具有神经元保护功效。Wei等[71]将神经元细胞(SH-SY5Y)进行OGD/R造模诱导脑缺血再灌注损伤,结果发现HSYA上调了HIF-1α、BNIP3、LC3和Beclin-1的表达水平,下调了p62的表达水平,而抑制HIF-1α减少了HSYA诱导的自噬激活,给予自噬抑制剂(3-MA)可促进细胞凋亡,HSYA的神经保护作用被逆转,上述研究结果均提示HSYA的神经保护作用是通过激活HIF-1α/BNIP3信号通路介导的线粒体自噬发挥作用。
也有研究表明,线粒体自噬加重认知功能障碍。补肾益智方(BSYZ)是一种广泛用于治疗智力低下和神经退行性疾病伴肾虚的中药复方,具有抗氧化应激、抗炎、调节神经元凋亡、改善认知损伤的作用。Xiao等[72]通过双侧颈总动脉闭塞建立体内大鼠CCH模型,给予BSYZ灌胃后,模型大鼠海马区的细胞凋亡和淀粉样蛋白异常沉积减少。BSYZ通过抑制线粒体自噬激活的氧化应激损伤,改善了VCI大鼠的认知和记忆能力,而在体外实验中,通过使用氯喹抑制线粒体自噬溶酶体,逆转了BSYZ抗氧化和保护线粒体膜的作用。
4.2 物理因子疗法
物理因子疗法是利用天然或人工物理因子的物理能,通过神经、体液、内分泌等生理调节机制作用于人体,以达到预防和治疗疾病的方法,包括电疗法、光疗法、超声波疗法、磁疗法、水疗法、冷疗法、生物反馈疗法等,其中电疗法在调控线粒体自噬方面应用广泛。研究发现,电脉冲刺激能够激活C2C12细胞AMPK/ULK1通路,并诱导FUNDC1依赖性线粒体自噬发生,从而维持线粒体功能稳态[73]。经皮穴位电刺激是在中医经络理论指导下,将经皮神经电刺激与穴位刺激相结合的一种新疗法[74]。研究表明,经皮穴位电刺激可通过改善脑血流量和加强脑区之间的神经元连接以促进学习和记忆恢复[75]。Hu等[63]研究改良的双侧颈总动脉闭塞大鼠模型发现,经皮穴位电刺激可显著上调PINK1、Parkin 和LC3Ⅱ的表达,下调LC3Ⅰ和p62的表达,新物体识别试验和Morris水迷宫试验结果均提示VD大鼠认知功能缺陷显著改善。然而,将自噬抑制剂3-MA注射至大脑外侧脑室后,线粒体自噬相关蛋白表达发生逆转,表明经皮穴位电刺激是通过PINK1/Parkin介导的线粒体自噬改善VD大鼠的认知功能。Tan等[76]研究发现,经颅神经电刺激可通过调节TXNIP、BRCC3/NLRP3和HIF-1α/BNIP3通路,抑制神经元氧化应激和焦亡,并激活线粒体自噬以减轻缺血性卒中后的脑损伤。
4.3 其他治疗
既往研究报道,脂肪酸酰胺水解酶抑制剂URB597(URB)在治疗CCH诱导的神经炎症和自噬功能障碍方面具有治疗潜力[77]。Su等[78]研究发现,在BCCAO模型中,腹腔注射URB治疗VCI模型大鼠12周后,URB通过减少线粒体ROS和小胶质细胞过度激活及恢复溶酶体功能,从而减轻受损细胞自噬和线粒体自噬,进一步抑制NLRP3-CASP1通路激活,缓解CCH诱导的脑慢性缺血性损伤,预防认知功能障碍发生。
组织型纤溶酶原激活剂tPA是美国食品药品监督管理局批准的唯一用于治疗超早期缺血性卒中的溶栓药物,具有神经保护作用。Cai等[61]研究发现,在tPA治疗后的I/R小鼠体内和暴露于tPA条件下的神经细胞群体中,免疫荧光检测到LC3Ⅱ与线粒体共定位增加。WB和PCR实验显示,p-AMPK、FUNDC1表达升高,而这些结果在tPA、FUNDC1基因敲除后即发生逆转,表明tPA通过AMPK/FUNDC1介导的线粒体自噬途径在某种程度上减少了脑缺血再灌注损伤。
右美托咪定(Dex)是一种麻醉剂,在缓解术后认知功能障碍方面具有显著疗效。在术后认知功能障碍大鼠模型中,Dex激活PINK1介导的线粒体自噬,抑制caspase-1/11-GSDMD依赖性海马神经元焦亡,并改善老年大鼠术后的认知功能[79]。
藤黄酮B是一种从藤黄素中提取的新型黄酮化合物,可诱导线粒体自噬标志物YFP-Parkin点状物形成,其通过稳定OMM上的PINK1蛋白,激活线粒体自噬,以PINK1/Parkin依赖性方式抑制细胞凋亡,在缺血-再灌注模型中表现出神经保护作用[18]。
褪黑素是一种线粒体靶向抗氧化剂,因具有两亲性而易穿过线粒体膜,并被线粒体选择性摄取。研究发现,褪黑素通过降低缺血性脑卒中模型小鼠的线粒体自噬蛋白PINK1和Parkin水平,进而抑制过度的线粒体自噬,减少神经元丢失,从而改善卒中小鼠的认知缺陷[80]。
5 小结与展望
近年来,全球人口老龄化加剧,VCI患病率逐年上升,深入探索其发病机制、寻求治疗方案迫在眉睫。研究发现,异常线粒体自噬可显著影响神经元健康和脑血管功能,加速认知功能障碍。本文详细阐述了线粒体自噬与VCI病理机制的关系,如氧化应激、神经炎症、神经元凋亡;介绍了线粒体自噬相关分子机制,如PINK1/Parkin泛素化通路、BNIP3/NIX受体通路、FUNDC1受体通路、PI3K/Akt/mTORtongl通路及AMPK通路;总结了基于上述通路缓解VCI症状的干预措施,这些疗法有望为VCI的治疗带来突破性进展。
但目前研究仍存在不足之处:(1)VCI发病机制复杂,目前尚未明确线粒体自噬是单独还是与其他病理机制串扰影响VCI;(2)部分药物作用于线粒体自噬的具体物质基础尚不清楚;(3)相关研究停留在基础实验阶段,未转化为临床试验进行验证。
未来研究应进一步关注以下方面:(1)深入探索线粒体自噬三大通路在VCI不同病理阶段的作用特征,为个性化治疗提供依据;(2)研发能够精准激活或抑制特定自噬通路的药物,并通过临床试验证实其安全性和有效性;(3)结合现代神经成像和分子生物学技术,开发实时监测线粒体自噬状态的手段,从而实现早期诊断和动态疗效评估。通过多学科协作和技术创新,线粒体自噬调控有望成为治疗VCI的有效策略,为患者带来更高生活质量。
参考文献
[1]Rundek T, Tolea M, Ariko T, et al. Vascular cognitive impairment (VCI)[J]. Neurotherapeutics, 2022, 19(1): 68-88.
[2]Han Y, Zhou A H, Li F Y, et al. Apolipoprotein E ε4 allele is associated with vascular cognitive impairment no dementia in Chinese population[J]. J Neurol Sci, 2020, 409: 116606.
[3]Galluzzi L, Baehrecke E H, Ballabio A, et al. Molecular definitions of autophagy and related processes[J]. EMBO J, 2017, 36(13): 1811-1836.
[4]陈丽敏, 白艳杰, 王岩, 等. 线粒体质量控制失调介导卒中后认知障碍的研究进展[J]. 中国病理生理杂志, 2022, 38(7): 1320-1327.
[5]Li X N, Huang L J, Lan J Q, et al. Molecular mechanisms of mitophagy and its roles in neurodegenerative diseases[J]. Pharmacol Res, 2021, 163: 105240.
[6]Siwicka-Gieroba D, Robba C, Go acki J, et al. Cerebral oxygen delivery and consumption in brain-injured patients[J]. J Pers Med, 2022, 12(11): 1763.
[7]Lu Y Y, Li Z J, Zhang S Q, et al. Cellular mitophagy: mechanism, roles in diseases and small molecule pharmacological regulation[J]. Theranostics, 2023, 13(2): 736-766.
[8]Li J, Wu J Y, Zhou X Y, et al. Targeting neuronal mitophagy in ischemic stroke: an update[J]. Burns Trauma, 2023, 11: tkad018.
[9]Sies H, Jones D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents[J]. Nat Rev Mol Cell Biol, 2020, 21(7): 363-383.
[10]Wang F X, Cao Y, Ma L N, et al. Dysfunction of cerebrovascular endothelial cells: prelude to vascular dementia[J]. Front Aging Neurosci, 2018, 10: 376.
[11]Schofield J H, Schafer Z T. Mitochondrial reactive oxygen species and mitophagy: a complex and nuanced relationship[J]. Antioxid Redox Signal, 2021, 34(7): 517-530.
[12]Sun W, Li X Y, Chu Z H, et al. Euxanthone improves cognitive impairment by attenuating mitochondrial fragmentation and suppressing oxidative stress[J]. Cent Eur J Immunol, 2021, 46(4): 446-455.
[13]Livingston M J, Wang J H, Zhou J L, et al. Clearance of damaged mitochondria via mitophagy is important to the protective effect of ischemic preconditioning in kidneys[J]. Autophagy, 2019, 15(12): 2142-2162.
[14]Shefa U, Jeong N Y, Song I O, et al. Mitophagy links oxidative stress conditions and neurodegenerative diseases[J]. Neural Regen Res, 2019, 14(5): 749-756.
[15]He Q, Li Z Y, Meng C C, et al. Parkin-dependent mitophagy is required for the inhibition of ATF4 on NLRP3 inflammasome activation in cerebral ischemia-reperfusion injury in rats[J]. Cells, 2019, 8(8): 897.
[16]Ding H G, Li Y, Chen S L, et al. Fisetin ameliorates cognitive impairment by activating mitophagy and suppressing neuroinflammation in rats with sepsis-associated encephalopathy[J]. CNS Neurosci Ther, 2022, 28(2): 247-258.
[17]Kuang H, Zhou Z F, Zhu Y G, et al. Pharmacological treatment of vascular dementia: a molecular mechanism perspective[J]. Aging Dis, 2021, 12(1): 308-326.
[18]Wu M, Lu G, Lao Y Z, et al. Garciesculenxanthone B induces PINK1-Parkin-mediated mitophagy and prevents ischemia-reperfusion brain injury in mice[J]. Acta Pharmacol Sin, 2021, 42(2): 199-208.
[19]Wang H Y, Chen S H, Zhang Y M, et al. Electroacupuncture ameliorates neuronal injury by Pink1/Parkin-mediated mitophagy clearance in cerebral ischemia-reperfusion[J]. Nitric Oxide, 2019, 91: 23-34.
[20]Liu Y W, Chen X, Gong Q H, et al. Osthole improves cognitive function of vascular dementia rats: reducing Aβ deposition via inhibition NLRP3 inflammasome[J]. Biol Pharm Bull, 2020, 43(9): 1315-1323.
[21]Büeler H. Mitochondrial and autophagic regulation of adult neurogenesis in the healthy and diseased brain[J]. Int J Mol Sci, 2021, 22(7): 3342.
[22]Bakula D, Scheibye-Knudsen M. MitophAging: mitophagy in aging and disease[J]. Front Cell Dev Biol, 2020, 8: 239.
[23]Poláchová E, Bach K, Heuten E, et al. Chemical blockage of the mitochondrial rhomboid protease PARL by novel ketoamide inhibitors reveals its role in PINK1/Parkin-dependent mitophagy[J]. J Med Chem, 2023, 66(1): 251-265.
[24]Picca A, Faitg J, Auwerx J, et al. Mitophagy in human health, ageing and disease[J]. Nat Metab, 2023, 5(12): 2047-2061.
[25]Li J, Yang D M, Li Z P, et al. PINK1/Parkin-mediated mitophagy in neurodegenerative diseases[J]. Ageing Res Rev, 2023, 84: 101817.
[26]Lamark T, Johansen T. Mechanisms of selective autophagy[J]. Annu Rev Cell Dev Biol, 2021, 37: 143-169.
[27]Onishi M, Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy[J]. EMBO J, 2021, 40(3): e104705.
[28]Schroeder S, Hofer S J, Zimmermann A, et al. Dietary spermidine improves cognitive function[J]. Cell Rep, 2021, 35(2): 108985.
[29]Hong T S, Zhou Y, Peng L, et al. Knocking down peroxiredoxin 6 aggravates cerebral ischemia-reperfusion injury by enhancing mitophagy[J]. Neuroscience, 2022, 482: 30-42.
[30]Huang S Y, Hong Z, Zhang L G, et al. CERKL alleviates ischemia reperfusion-induced nervous system injury through modulating the SIRT1/PINK1/Parkin pathway and mitoph-agy induction[J]. Biol Chem, 2022, 403(7): 691-701.
[31]Shao Z Q, Dou S S, Zhu J G, et al. Apelin-36 protects HT22 cells against oxygen-glucose deprivation/reperfusion-induced oxidative stress and mitochondrial dysfunction by promoting SIRT1-mediated PINK1/Parkin-dependent mitophagy[J]. Neurotox Res, 2021, 39(3): 740-753.
[32]Wei J, Xie J X, He J H, et al. Active fraction of Polyrhachis vicina (Roger) alleviated cerebral ischemia/reperfusion injury by targeting SIRT3-mediated mitophagy and angiogenesis[J]. Phytomedicine, 2023, 121: 155104.
[33]Wang C Z, Yang Y, Zhang Y Q, et al. Protective effects of metformin against osteoarthritis through upregulation of SIRT3-mediated PINK1/Parkin-dependent mitophagy in primary chondrocytes[J]. Biosci Trends, 2019, 12(6): 605-612.
[34]Zhao Y, Zhang J W, Zheng Y L, et al. NAD+ improves cognitive function and reduces neuroinflammation by ameliorating mitochondrial damage and decreasing ROS production in chronic cerebral hypoperfusion models through Sirt1/PGC-1α pathway[J]. J Neuroinflammation, 2021, 18(1): 207.
[35]Han B, Jiang W, Liu H J, et al. Upregulation of neuronal PGC-1α ameliorates cognitive impairment induced by chronic cerebral hypoperfusion[J]. Theranostics, 2020, 10(6): 2832-2848.
[36]Han B, Zhao H, Gong X J, et al. Upregulation of PGC-1α attenuates oxygen-glucose deprivation-induced hippocampal neuronal injury[J]. Neural Plast, 2022, 2022: 9682999.
[37]Sun E Y, Zhang J, Deng Y, et al. Docosahexaenoic acid alleviates brain damage by promoting mitophagy in mice with ischaemic stroke[J]. Oxid Med Cell Longev, 2022, 2022: 3119649.
[38]Marinkovic' M, Šprung M, Novak I. Dimerization of mito-phagy receptor BNIP3L/NIX is essential for recruitment of autophagic machinery[J]. Autophagy, 2021, 17(5): 1232-1243.
[39]Wu X L, Zheng Y R, Liu M R, et al. BNIP3L/NIX degradation leads to mitophagy deficiency in ischemic brains[J]. Autophagy, 2021, 17(8): 1934-1946.
[40]Yuan Y, Zheng Y R, Zhang X N, et al. BNIP3L/NIX-mediated mitophagy protects against ischemic brain injury independent of PARK2[J]. Autophagy, 2017, 13(10): 1754-1766.
[41]Luo J, Tan J Y, Jiang N, et al. Platonin protects against cerebral ischemia/reperfusion injury in rats by inhibiting NLRP3 inflammasomes via BNIP3/LC3 signaling mediated autophagy[J]. Brain Res Bull, 2022, 180: 12-23.
[42]Li W, Zhang X L, Zhuang H X, et al. MicroRNA-137 is a novel hypoxia-responsive microRNA that inhibits mitophagy via regulation of two mitophagy receptors FUNDC1 and NIX[J]. J Biol Chem, 2014, 289(15): 10691-10701.
[43]秦红玲, 胡跃强, 谭露露, 等. 清热化瘀方调控miR-137/Nix通路介导的线粒体自噬改善大鼠脑缺血-再灌注损伤[J]. 中药材, 2023, 46(1): 191-196.
[44]Deng Z X, Ou H, Ren F, et al. LncRNA SNHG14 promotes OGD/R-induced neuron injury by inducing excessive mitophagy via miR-182-5p/BINP3 axis in HT22 mouse hippocampal neuronal cells[J]. Biol Res, 2020, 53(1): 38.
[45]Choi G E, Lee H J, Chae C W, et al. BNIP3L/NIX-mediated mitophagy protects against glucocorticoid-induced synapse defects[J]. Nat Commun, 2021, 12(1): 487.
[46]Kuang Y, Ma K L, Zhou C Q, et al. Structural basis for the phosphorylation of FUNDC1 LIR as a molecular Switch of mitophagy[J]. Autophagy, 2016, 12(12): 2363-2373.
[47]Wu W X, Li W, Chen H, et al. FUNDC1 is a novel mitochondrial-associated-membrane (MAM) protein required for hypoxia-induced mitochondrial fission and mitophagy[J]. Autophagy, 2016, 12(9): 1675-1676.
[48]Liu R X, Xu C L, Zhang W L, et al. FUNDC1-mediated mitophagy and HIF1α activation drives pulmonary hypertension during hypoxia[J]. Cell Death Dis, 2022, 13(7): 634.
[49]Zhang Y N, Lian Y J, Lian X L, et al. FUNDC1 mediated mitophagy in epileptic hippocampal neuronal injury induced by Magnesium-Free fluid[J]. Neurochem Res, 2023, 48(1): 284-294.
[50]Wang L, Wang P, Dong H, et al. Ulk1/FUNDC1 prevents nerve cells from Hypoxia-Induced apoptosis by promoting cell autophagy[J]. Neurochem Res, 2018, 43(8): 1539-1548.
[51]Mao H, Chen W, Chen L X, et al. Potential role of mitochondria-associated endoplasmic reticulum membrane proteins in diseases[J]. Biochem Pharmacol, 2022, 199: 115011.
[52]周曼丽, 冯宇, 钱舒乐, 等. 心肌缺血再灌注损伤潜在治疗靶点-线粒体动力学相关蛋白的研究进展[J]. 中国中药杂志, 2020, 45(17): 4183-4195.
[53]Chai P Y, Cheng Y R, Hou C Y, et al. USP19 promotes hypoxia-induced mitochondrial division via FUNDC1 at ER-mitochondria contact sites[J]. J Cell Biol, 2021, 220(7): e202010006.
[54]Liu B H, Cao Y W, Wang D J, et al. Zhen-Wu-Tang induced mitophagy to protect mitochondrial function in chronic glomerulonephritis via PI3K/AKT/mTOR and AMPK pathways[J]. Front Pharmacol, 2021, 12: 777670.
[55]Sun W Y, Lei Y T, Jiang Z H, et al. BPA and low-Se exacerbate apoptosis and mitophagy in chicken pancreatic cells by regulating the PTEN/PI3K/AKT/mTOR pathway[J]. J Adv Res, 2025, 67: 61-69.
[56]Kaeberlein M, Galvan V. Rapamycin and Alzheimer's disease: time for a clinical trial?[J]. Sci Transl Med, 2019, 11(476): eaar4289.
[57]Zheng G M, Wang L, Li X Q, et al. Rapamycin alleviates cognitive impairment in murine vascular dementia: the enhancement of mitophagy by PI3K/AKT/mTOR axis[J]. Tissue Cell, 2021, 69: 101481.
[58]Wang L, Jiang W Z, Wang J, et al. Puerarin inhibits FUNDC1-mediated mitochondrial autophagy and CSE-induced apoptosis of human bronchial epithelial cells by activating the PI3K/AKT/mTOR signaling pathway[J]. Aging (Albany NY), 2022, 14(3): 1253-1264.
[59]Hung C M, Lombardo P S, Malik N, et al. AMPK/ULK1-mediated phosphorylation of Parkin ACT domain mediates an early step in mitophagy[J]. Sci Adv, 2021, 7(15): eabg4544.
[60]Guo Y Q, Jiang H F, Wang M, et al. Metformin alleviates cerebral ischemia/reperfusion injury aggravated by hyperglycemia via regulating AMPK/ULK1/PINK1/Parkin pathway-mediated mitophagy and apoptosis[J]. Chem Biol Interact, 2023, 384: 110723.
[61]Cai Y, Yang E Y, Yao X H, et al. FUNDC1-dependent mitophagy induced by tPA protects neurons against cerebral ischemia-reperfusion injury[J]. Redox Biol, 2021, 38: 101792.
[62]Castellazzi M, Patergnani S, Donadio M, et al. Autophagy and mitophagy biomarkers are reduced in sera of patients with Alzheimer's disease and mild cognitive impairment[J]. Sci Rep, 2019, 9(1): 20009.
[63]Hu Z W, Wen T S, Hu K, et al. Transcutaneous electrical acupoint stimulation ameliorates cognitive function through PINK1/Parkin mediated mitophagy in VD rats[J]. Evid Based Complement Alternat Med, 2022, 2022: 2810794.
[64]Zhao Z T, Xie L, Shi J Y, et al. Neuroprotective effect of Zishen Huoxue decoction treatment on vascular dementia by activating PINK1/Parkin mediated mitophagy in the hippocampal CA1 region[J]. J Ethnopharmacol, 2024, 319(Pt 1): 117172.
[65]Jiao K Y, Lai Z L, Cheng Q C, et al. Glycosides of Buyang Huanwu decoction inhibits inflammation associated with cerebral ischemia-reperfusion via the PINK1/Parkin mitophagy pathway[J]. J Ethnopharmacol, 2024, 325: 117766.
[66]Mao Z G, Tian L Y, Liu J, et al. Ligustilide ameliorates hippocampal neuronal injury after cerebral ischemia reperfusion through activating PINK1/Parkin-dependent mitophagy[J]. Phytomedicine, 2022, 101: 154111.
[67]Yang L, Tao Y W, Luo L L, et al. Dengzhan Xixin injection derived from a traditional Chinese herb erigeron breviscapus ameliorates cerebral ischemia/reperfusion injury in rats via modulation of mitophagy and mitochondrial apoptosis[J]. J Ethnopharmacol, 2022, 288: 114988.
[68]Wang W W, Xu J P. Curcumin attenuates cerebral ischemia-reperfusion injury through regulating mitophagy and preserving mitochondrial function[J]. Curr Neurovasc Res, 2020, 17(2): 113-122.
[69]Tian Z M, Ji X M, Liu J. Neuroinflammation in vascular cognitive impairment and dementia: current evidence, advances, and prospects[J]. Int J Mol Sci, 2022, 23(11): 6224.
[70]荣幸, 李育, 岳远佳, 等. 红景天苷调节BNIP3介导的线粒体自噬通路对脑缺血神经保护的机制研究[J]. 中药材, 2024(9): 2334-2338.
[71]Wei R H, Song L J, Miao Z Y, et al. Hydroxysafflor yellow a exerts neuroprotective effects via HIF-1α/BNIP3 pathway to activate neuronal autophagy after OGD/R[J]. Cells, 2022, 11(23): 3726.
[72]Xiao Q, Liu H N, Yang C, et al. Bushen-Yizhi formula exerts neuroprotective effect via inhibiting excessive mitophagy in rats with chronic cerebral hypoperfusion[J]. J Ethnopharmacol, 2023, 310: 116326.
[73]Gao J X, Yu L, Wang Z, et al. Induction of mitophagy in C2C12 cells by electrical pulse stimulation involves increasing the level of the mitochondrial receptor FUNDC1 through the AMPK-ULK1 pathway[J]. Am J Transl Res, 2020, 12(10): 6879-6894.
[74]Chi Y L, Zhang W L, Yang F, et al. Transcutaneous electrical acupoint stimulation for improving postoperative recovery, reducing stress and inflammatory responses in elderly patient undergoing knee surgery[J]. Am J Chin Med, 2019, 47(7): 1445-1458.
[75]Xiong W, Zhao C M, An L X, et al. Efficacy of acupuncture combined with local anesthesia in ischemic stroke patients with carotid artery stenting: a prospective randomized trial[J]. Chin J Integr Med, 2020, 26(8): 609-616.
[76]Tan Z X, Dong F, Wu L Y, et al. Transcutaneous electrical nerve stimulation (TENS) alleviates brain ischemic injury by regulating neuronal oxidative stress, pyroptosis, and mitophagy[J]. Mediators Inflamm, 2023, 2023: 5677865.
[77]Su S H, Wu Y F, Wang D P, et al. Inhibition of excessive autophagy and mitophagy mediates neuroprotective effects of URB597 against chronic cerebral hypoperfusion[J]. Cell Death Dis, 2018, 9(7): 733.
[78]Su S H, Wu Y F, Lin Q, et al. URB597 protects against NLRP3 inflammasome activation by inhibiting autophagy dysfunction in a rat model of chronic cerebral hypoperfusion[J]. J Neuroinflammation, 2019, 16(1): 260.
[79]Chen Y Y, Wei G, Feng X J, et al. Dexmedetomidine enhances Mitophagy via PINK1 to alleviate hippocampal neuronal Pyroptosis and improve postoperative cognitive dysfunction in elderly rat[J]. Exp Neurol, 2024, 379: 114842.
[80]Shi Y, Fang Q, Hu Y, et al. Melatonin ameliorates post-stroke cognitive impairment in mice by inhibiting excessive mitophagy[J]. Cells, 2024, 13(10): 872.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)