首页 > 医疗资讯/ 正文
摘要
目的 1型发作性睡病(NT1)伴有脑脊液食欲素(Hcrt-1)的降低。目前国内检测Hcrt-1的方法多是利用进口试剂进行的放射免疫法测定(RIA),但此方法只能在有限的放射性同位素安全认证的实验室开展,而且受限于试剂中同位素的衰减、抗体依赖的方法学、缓慢与繁琐的步骤和较长的反应时间。本研究的目的在于探索出一种非放射性且非抗体依赖的脑脊液食欲素快速检测方法。方法 利用液相层析串联质谱法(LC-MS/MS)技术对临床确诊的14例NT1患者和10例非发作性睡病患者的脑脊液进行了反复测试,包括基本的方法学建立和优化。主要步骤是将加入非放射性同位素内标的脑脊液经过固相萃取后进行质谱信号捕获和定量分析,并与相应的RIA结果进行比较。结果 LC-MS/MS方法简单快速,且在5~2 500 pg/ml范围内显示良好的线性关系和重复性。虽然这种绝对定量的检测方法显示与RIA结果有数值方面的差异和不一致性,但它足以区分NT1和非发作性睡病对照组且不存在灰区。结论 LC-MS/MS是一种更便利、快速、安全、可靠的可用于NT1诊断的检测方法。
发作性睡病(narcolepsy)是一种以不可抗拒的日间过度思睡、猝倒、睡眠幻觉、睡眠瘫痪和夜间睡眠紊乱等为主要临床特点的中枢性睡眠障碍 。目前认为发作性睡病的主要病理生理机制是由于下丘脑分泌食欲素(hypocretin-1,Hcrt-1)的细胞由于自身免疫反应导致的凋亡造成的脑脊液(cerebrospinal fluid,CSF)中的Hcrt-1减少甚至消失。根据国际睡眠障碍分类-第三版-修订版(International Classification of Sleep Disorders,Third Edition Text Revision,ICSD-3-TR),按照CSF放射免疫测定法(radioimmunoassay,RIA)Hcrt-1水平是否≤110 pg/ml或低于正常值的1/3,分为1型发作性睡病(narcolepsy type 1,NT1)和2型发作性睡病(narcolepsy type 2,NT2)。目前国际认可的CSF食欲素检测方法为RIA,且绝大多数推荐运用125I放射免疫分析试剂盒测定(美国Phoenix Pharmaceuticals公司)。由于该方法只能在有限的放射性同位素安全认证的实验室开展,而且受限于试剂中同位素的衰减(125I半衰期约60 d)、国外试剂进口、物流特殊要求以及试剂盒中要求的抗原抗体反应的缓慢与繁琐的步骤(整个检测时间约48 h)等,所以此方法存在一定的局限性。此外,有研究使用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)测定CSF中食欲素水平,结果缺乏可靠性。由于RIA和ELISA上述两种方法的试剂批次差异,以及以抗体为基础方法的非特异性结合等问题,寻找更精确检测CSF中食欲素和替代非放射性的方法是当前需要解决的问题。
近年来以基于质谱技术为主的蛋白组学检测方法有了长足的发展,尤其是液相层析串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)。在多个医疗检测领域都有广泛的应用。国外利用质谱法检测Hcrt-1也陆续有报道,但国内尚未见报道。Hcrt-1是一个含有2个二硫键的约3 600道尔顿小蛋白,极易带电荷,不管是在NT1或非NT1的CSF中均能看到,但文献中显示与大家熟知的RIA相比LC-MS/MS检测的结果不同实验室间存在差别,特别是读值方面与RIA结果存在数倍到十几倍的差异,通常LC-MS/MS的读值普遍低于RIA。LC-MS/MS在目前的报道中显示在检测CFS中的Hcrt-1水平以诊断NT1方面有强大的优势,包括不依赖抗体、无放射性、可绝对定量、检测用时短、可以本土开展等。因此,本研究旨在基于国内人群应用LC-MS/MS探索出检测CFS中Hcrt-1水平的本土方法。
1 资料与方法
1.1 样本与患者信息
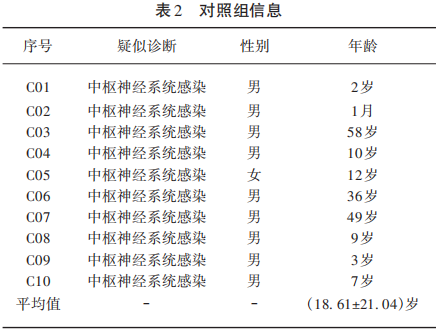
选取14例符合国际睡眠障碍分类第三版(International Classification of Sleep Disorders, 3rd Edition ,ICSD-3)诊断标准的1型发作性睡病(NT1)患者且均经过广州金域医学检验中心使用RIA测定CSF中的Hcrt-1 水平(Hcrt-1/Orexin A RIA试剂盒,Phoenix Pharmaceuticals)(见表1)。本研究选取10例可疑中枢神经系统感染患者作为对照组,且均完成腰椎穿刺。这些对照组均无日间过度思睡或猝倒发作(见表2)。

1.2 试剂与Hcrt-1测试方法
1.2.1 标准品及内标准备
合成的Hcrt-1(强耀生物,中国)稀释至50 ng/ml储备溶液,溶剂为25%乙腈(ACN)和0.1%甲酸(FA),并用作标准品。用于优化质谱的Hcrt-1浓度为100 ng/ml,溶剂为25%ACN和0.1%FA。内部标准(内标)采用13C和15N稳定同位素标记的Hcrt-1,在2个亮氨酸(Leu)残基上含有稳定的非放射性同位素(强耀生物,中国)。该内标与Hcrt-1化学性质相似,包括二硫键和其他修饰,但质量偏移为14 Da。内标储备溶液通过在同样的溶剂(25% ACN,1% FA)中溶解并分装,并储存于-80 ℃。工作溶液由25%ACN,0.1% FA稀释,使最终浓度约为10 ng/ml,因此如果在500 μl样本中加入50 μl内标,其最终浓度即为909 pg/ml。
1.2.2 质谱样品前处理
Hcrt-1通过固相萃取(solid-phase extraction,SPE)从CSF中提取,采用30 μm Oasis萃取板(96孔板格式,waters)。以500 µl甲醇(MeOH)和500 µl水预先润洗,然后加入550 μl样本(500 μl CSF样本和50 μl内标工作液的混合液),以200 μl MeOH/水/甲酸(80/10/10,v/v)洗脱食欲素,收集至96孔蛋白低吸附进样板(waters),在40 ℃下用真空离心浓缩至干,最后用100 μl HPLC 流动相(ACN/水/FA:25/74.9/0.1,v/v/v)重新溶解。
1.2.3 LC-MS/MS分析
样品分析仪器为AB Sciex液相色谱仪(AB Sciex, Citrine,USA),配备电喷雾离子源(electrospray ionization,ESI)完成。具体步骤如下:采用2.1 mm 内径×50 mm长Kinetex C18的反相色谱柱(2.6 μm颗粒,100Å孔径,Phenomenex)。流动相A为0.1% FA,流动相B为乙腈(ACN)/0.1% FA,利用梯度洗脱法将Hcrt-1洗脱并检测:0 min,20% B→1.3 min,95% B→2.3 min,95% B→2.4 min,20% B→3.0 min,20% ACN)。液相流速为400 μl/min;柱温保持40 ℃;样品盘温度为8 ℃,正电荷电喷雾离子化碰撞能量为20 eV,目标离子为Hcrt-1[M+5H]5+(质荷比m/z 713.1),主要碎片离子:m/z 858.6和854.1;内标质荷比m/z 715.9(目标离子)→862.2(碎片离子)。
1.2.4 RIA分析
严格采用标准RIA试剂盒及说明书进行检测CSF中Hcrt-1水平的操作,并参照梅奥诊所的诊断建议将110 pg/ml作为NT1的阈(cutoff)值,将111~200 pg/ml 设为中间(intermediate)值,200 pg/ml以上为正常(normal)。
1.3 统计学方法
采用Excel(版本:16.94)进行数据统计分析。数据采集软件Analyst 1.6.3,数据处理软件MultiQuant MD 3.0.3和SPSS 25.0。以(x±s)描述符合正态分布的定量资料,中位数(四分位数间距)[M(P25,P75)]描述不符合正态分布的定量资料,频数和百分比(%)描述定性资料。
2 结 果
2.1 LC-MS/MS检测Hcrt-1有更宽的定量范围和良好的重复性和回收率
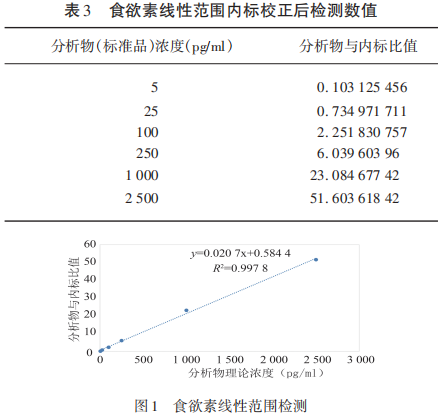
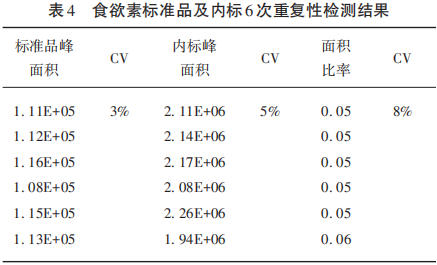
为了确认文献中质谱法检测Hcrt-1是否可行,本研究先就质谱检测的条件进行了探索和优化,包括萃取和高压液相分离的条件和Hcrt-1离子化及质谱检测相关的指标等。因为无论是NT1还是非NT1的CSF都含有一定量的食欲素,本研究首先实施了无基质影响下的Hcrt-1质谱检测,将含有非放射性同位素的Hcrt-1内标作为绝对定量的标准与没有同位素标记的Hcrt-1标准品混合在一起并用流动相A(0.1%FA)稀释成不同的浓度进行固相萃取和质谱检测。实验结果发现质谱方法比放免法有更宽的检测和定量范围,在5~2 500 pg/ml的范围内有良好的线性关系(R2=0.997 8),而放免法的检测范围据报道是在10~1 280 pg/ml(见表3、图1)。为了体现检测体系运转的稳定性,将一定量的内标(100 ng/ml)和标准品(10 ng/ml)混在一起共进行6次重复性实验,最终证实此方法也具有良好重复性(CV<10%)。此外,本研究还发现标准品与内标比的信号强度比例(理论上应该是0.1)与试剂供应商提供浓度差不同(实际上平均是0.05)(见表4)。
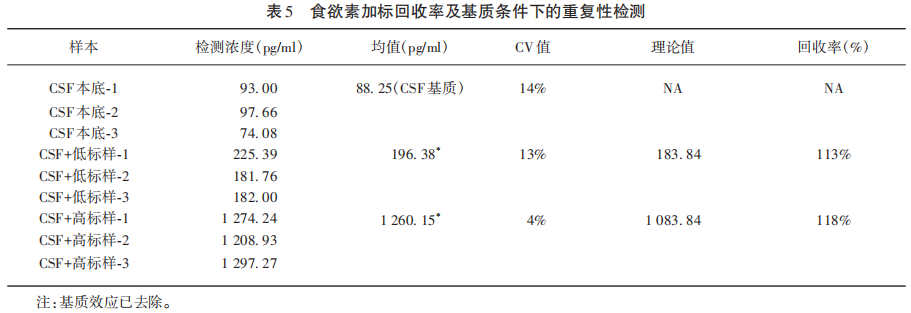
为了检测基质条件下(接近临床CSF样本检测条件)质谱法检测Hcrt-1的表现及重复性,本研究将12例NT1患者作为基质(CSF-01-CSF-12没有选择健康人的CSF,因为内含Hcrt-1背景会更高),加入内标和标准品(183.84 pg/ml和1 083.84 pg/ml两种浓度)进行重复性检测和加标回收实验,3次重复检测发现在此近乎真实场景检测的条件下,质谱检测法也具有良好的重复性(CV4%~14%)和回收率(113%~118%),而且CSF基质条件下质谱法有稳定的Hcrt-1被检出(浓度为88.25 pg/ml)(见表5)。
2.2 质谱法可有效区分NT1和非发作性睡病患者
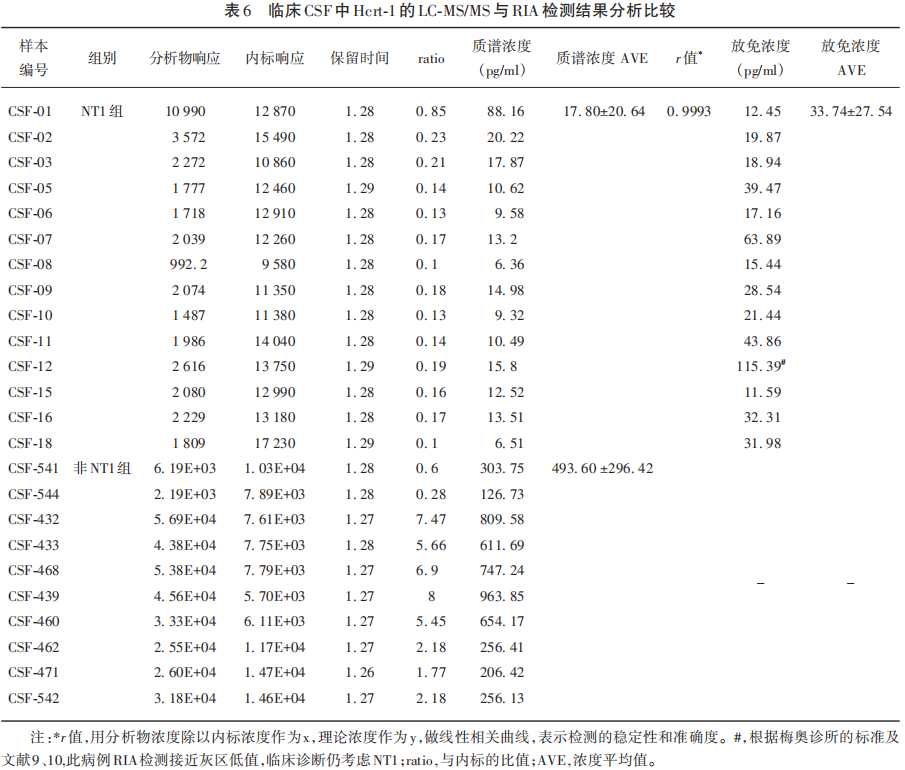
在上面基本方法学建立和优化的基础上,本研究又对14例NT1患者的CSF(上面提及的12例NT1患者样本的基础上又追加了例NT1患者的CSF)进行了LC-MS/MS盲测Hcrt-1水平。对10例非NT1患者的CSF 中Hcrt-1也进行了LC-MS/MS检测。结果显示LC-MS/MS很容易区分NT1组[Hcrt-1(17.80±20.64)pg/ml]和非NT1组[Hcrt-1(493.6±296.42)pg/ml],而且两组样本不像RIA那样存在或考虑灰区。与国外报道类似,LC-MS/MS检测的平均读值也低于放免法(平均低1.896倍),两组结果(NT1患者的RIA与LC-MS/MS检测)统计学分析无读值相关性(见表6)。
3 讨 论
本研究初步证实了利用液相层析串联质谱法(即LC-MS/MS)测定CSF中Hcrt-1水平是一个可行的方法,特别是使用合成的含有非放射性同位素的稳定内标,可以达到绝对定量,比放免法等依赖抗体的检测方法在定量检测上具有绝对优势。此外,本研究偶然发现同一厂家的内标和标准品定量有不一致的现象,可能与2种试剂合成的不同步骤和工艺有关,即其中一个要用带非放射性同位素(如13C而不是12C)的氨基酸合成内标,而合成标准品用正常的氨基酸即可。就Hcrt-1而言,它本身是一个约3 600道尔顿的小蛋白,体外直接合成要比用动物或细胞生产并筛选出它相应的抗体工艺上会更加容易,可以无限量生产和分装保存,质量控制理论上更加简单,使用起来也更安全。不同于目前常用的RIA试剂(美国Phoenix Pharmaceuticals公司生产的125I标记的Hcrt-1抗体及相关试剂)需要考虑同位素的半衰期和同位素放射性的安全防护问题。
利用LC-MS/MS检测到的CSF中的Hcrt-1水平的范围平均比RIA的范围要低,而且2种方法读值间没有相关性,究其原因可能与两种方法本质上有较大区别,以及RIA检测的繁琐步骤有关,与文献报道基本一致。RIA检测步骤多,流程长,反应时间长 (抗原抗体要过夜孵育结合,整个检测需要大约48 h),难免有一些非特异性的结合,可能会给出一些非特异性或背景读值,特别是NT1患者的CSF中Hcrt-1水平较低,受背景的影响会相对更大。而LC-MS/MS检测步骤相对简单,CSF样本加入内标后固相萃取物直接测定Hcrt-1,检测的信号是与内标并行的待测样本中质谱图的峰值或面积,是绝对定量,不存在背景值的问题,使得检测更容易和准确。当然,文献中及本研究是不同的实验室使用的不同供应商提供的不同的LC-MS/MS检测试剂,难免有生产工艺等一些不一样的地方。与文献中的报道类似,本研究中也发现使用LC-MS/MS检测的CSF中的Hcrt-1读值与RIA结果的读值比例不一样,尽管是两种不同的检测方法,但这也提示各实验室使用标准化的试剂和方法的重要性。此外本研究发现LC-MS/MS有更宽的定量范围,体现出此方法更能耐受临床样本的不同状态,有更大的实用性。
NT1的诊断需依靠CSF中的Hcrt-1水平下降辅助诊断,考虑到腰穿的有创性,有学者曾试图利用血液检测Hcrt-1水平用于疾病诊断,最终发现血液中的Hcrt-1与NT1并没有关系。主要是由于CSF中的Hcrt-1很难通过血脑屏障,且CSF中的Hcrt-1与外周血中Hcrt-1可能来自身体不同的部位,所以检测与NT1相关的Hcrt-1目前还要利用CSF。本研究与既往文献报道类似(研究者使用了NT1患者样本9~20例不等),利用LC-MS/MS检测了14例NT1患者Hcrt-1水平,并与10例非NT1患者的CSF的Hcrt-1的水平进行了LC-MS/MS检测比较(均为疑似神经感染病例,因为临床不怀疑NT1所以没有做相应的RIA检测),虽然检测样本量不大,但此研究已足以看出LC-MS/MS检测Hcrt-1的优势,特别是绝对定量和本土化开展。此外,本研究中纳入了1例Hcrt-1(CSF-12)RIA检测在灰区低值的NT1组样本(RIA读值为115.39 pg/ml),质谱检测Hcrt-1却很低,且低于平均均值水平,尽管仅此1例,它提示在RIA读值在灰区时诊断NT1需要综合考虑。有学者也提议同时提高RIA的阈值。
综上所述,使用LC-MS/MS能够较好地区分NT1和非发作性睡患者群且不存在灰区,用于疾病辅助诊断。未来的研究目标是多中心联合并扩大样本量,建立健康人群CSF中Hcrt-1的标准范围和NT1患者CSF中Hcrt-1的诊断阈值。
参考文献
[1]中华医学会神经病学分会睡眠障碍学组. 中国发作性睡病诊断与治疗指南(2022版)[J]. 中华神经科杂志,2022,55(5):406-420.
[2]Krahn LE,Zee PC,Thorpy MJ. Current understanding of narcolepsy 1 and its comorbidities:what clinicians need to know[J]. Adv Ther,2022,39(1):221-243.
[3]Zhan Q,Deng L,Ding Y,et al. The value of using ELISA to detect orexin-a in cerebrospinal fluid in the diagnosis of narcolepsy[J]. Medicine,2024,103(24):e38539.
[4]Birhanu AG. Mass spectrometry-based proteomics as an emerging tool in clinical laboratories[J]. Clin Proteomics,2023,20(1):32.
[5]Hirtz C,Vialaret J,Gabelle A,et al. From radioimmunoassay to mass spectrometry:a new method to quantify orexin-A (hypocretin-1) in cerebrospinal fluid[J]. Sci Rep,2016,6:25162.
[6]Bårdsen K,Gjerstad MD,Partinen M,et al. Considerably lower levels of hypocretin-1 in cerebrospinal fluid is revealed by a novel mass spectrometry method compared with standard radioimmunoassay[J]. Anal Chem,2019,91(14):9323-9329.
[7]Lindström M,Schinkelshoek M,Tienari PJ,et al. Orexin-a measurement in narcolepsy:a stability study and a comparison of LC-MS/MS and immunoassays[J]. Clin Biochem,2021,90:34-39.
[8]Phoenix Pharmaceuticals[EB/oh].(2023-01-01) (2025-03-01) http://www.phoenixbiotech.net/catalog/repository/QCdata_RIK/RK-003-30.pdf.
[9]Orexin-A/Hypocretin-1,Spinal Fluid:(2023-01-01) (2025-03-01) https://test.mayocliniclabs.com/test-catalog/overview/604230.
[10]Mignot E,Lammers GJ,Ripley B,et al. The role of cerebrospinal fluid hypocretin measurement in the diagnosis of narcolepsy and other hypersomnias[J]. Arch Neurol,2002,59(10):1553-1562.
[11]Mäkelä KA,Karhu T,Jurado Acosta A,et al. Plasma orexin-a levels do not undergo circadian rhythm in young healthy male subjects[J]. Front Endocrinol,2018,9:710.
[12]Ægidius HM,Kruse L,Christensen GL,et al. Pre-treatment of blood samples reveal normal blood hypocretin/orexin signal in narcolepsy type 1[J]. Brain Commun,2021,3(2):fcab050.
[13]Mignot EJM. History of narcolepsy at stanford university[J]. Immunol Res,2014,58(2-3):315-339.
[14]Choi MR,Cho H,Chun JW,et al. Increase of orexin A in the peripheral blood of adolescents with internet gaming disorder[J]. J Behav Addict,2020,9(1):93-104.
[15]van der Hoeven AE,Fronczek R,Schinkelshoek MS,et al. Intermediate hypocretin-1 cerebrospinal fluid levels and typical cataplexy:their significance in the diagnosis of narcolepsy type 1[J]. Sleep,2022,45(5):zsac052.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)