首页 > 医疗资讯/ 正文
免疫检查点阻断(ICB)疗法为改善肺癌治疗结果提供了希望,但其有效性受到免疫抑制性肿瘤微环境(TME)的限制,导致反应率有限(<20%)。
2025 年 4 月 15 日,同济大学张鹏和杨洋、华东理工大学/石河子大学李永生、华东理工大学张大朋共同通讯在Small在线发表题为“Copper-Doped Polydopamine Nanoparticles-Mediated GSH/GPX4-Depleted Ferroptosis and Cuproptosis Sensitizes Lung Tumor to Checkpoint Blockade Immunotherapy”的研究论文。该研究报道了一种肿瘤部位谷胱甘肽(GSH)/谷胱甘肽过氧化物酶(GPX4)双重耗竭策略,通过GSH响应性聚多巴胺基杂交纳米粒(CACuPDA)诱导肿瘤铁死亡并放大铜死亡。
这种方法触发细胞溶解以逆转免疫抑制性TME,并进一步增强与抗PD-L1的ICB疗法协同的肺肿瘤治疗效果。释放的肉桂醛(CA)可以刺激活性氧产生,而Cu2+可以直接消耗GSH并抑制GPX4。有趣的是,Cu2+通过下调铁氧还蛋白(FDX1)的表达诱导铜死亡,而还原的铜可以催化肿瘤部位过表达的H2O2产生羟基自由基(·OH)。氧化还原失衡放大了肺肿瘤细胞中的铁死亡和铜死亡,将大量细胞内容物释放到免疫抑制性TME中,促使细胞毒性T细胞数量增加和免疫抑制性Treg细胞数量减少。体内实验结果显示,CACuPDA将抗PD-L1治疗肺部肿瘤的疗效提高了5倍,为改善ICB肺肿瘤治疗效果提供了一种有效策略。

肺癌是全球最常诊断和致命的三大癌症之一。大多数肺癌患者在晚期被诊断出来,只能接受化疗和放疗,并伴有严重的副作用。虽然化疗和放疗最初可能有效,但α2δ1阳性肺癌细胞表现出癌症干细胞(CSC)耐药特性,而Polζ和Rev1等特殊DNA聚合酶的过表达可诱导肺肿瘤化疗/放疗耐药,从而影响相应的治疗效果。近年来,已成功开发出针对基因突变的靶向治疗药物,显著提高了肺癌患者的生存率。然而,患者的肿瘤耐药性的问题仍未得到解决。
医疗技术和免疫疗法的发展,尤其是免疫检查点阻断(ICB)疗法,为肿瘤患者提供了新的治疗方法。2018年,相关学者首次通过临床试验数据证明,非小细胞肺癌(NSCLC)患者的免疫检查点阻断剂(ICB)改善了患者的预后,并增加了CD8+/PD-1+免疫细胞向肿瘤的浸润,当前ICB已整合到NSCLC的诊断和治疗指南中。然而,最近的统计数据表明,由于宿主免疫反应有限,从ICB中受益的患者仅占为约20%。具体来说,细胞毒性T细胞的肿瘤浸润减少和调节性T细胞(即免疫抑制性肿瘤微环境(TME))的增加限制了肺肿瘤中抗肿瘤免疫反应的激活。肺肿瘤TME与常规化疗/放疗治疗无法激活免疫系统从被杀死的肺癌细胞中释放足够的抗原强相关,从而限制了有效的下游反应。近期,已经开发出一些纳米材料来诱导免疫原性死亡以触发抗肿瘤免疫反应,但T细胞相关的免疫反应受到限制。大多数纳米药物通常会导致肿瘤细胞凋亡,使得肿瘤抗原释放不足,难以刺激树突状细胞成熟及向T细胞的呈递。
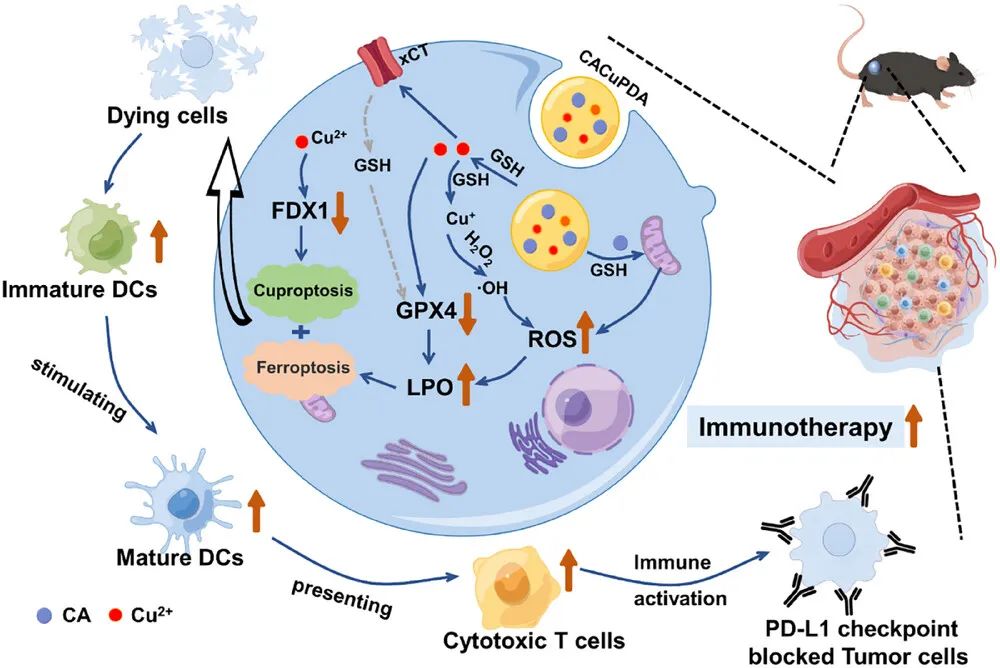
图1 铜掺杂聚多巴胺纳米颗粒介导的GSH/GPX4耗竭增强肺肿瘤对免疫疗法的敏感性(摘自Small)
铁死亡和铜死亡是两种通过大量活性氧(ROS)诱导细胞死亡的新方法,会破坏细胞膜并促进细胞裂解,有望相应地逆转免疫抑制性TME。然而,ROS和ROS相关的脂质过氧化物很容易被TME中过表达的还原性谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GPX4)清除,从而抑制铁死亡和铜死亡的发生。因此,同时诱导反应性ROS并消耗GSH以及GPX4的纳米药物引起了广泛关注,需要增强铁死亡和铜死亡以调节免疫抑制性TME,并提高ICB治疗效果。
该研究报道了一种GSH响应性聚多巴胺的杂交纳米颗粒(CACuPDA),诱导GSH/GPX4耗尽的铁死亡和铜死亡,引发广泛的细胞裂解以逆转免疫抑制TME。这种方法进一步增强了ICB治疗效果,增加了肺肿瘤对程序性细胞死亡配体1抗体(抗PD-L1)的敏感性。具体来说,GSH和Cu2+的结合能力强于DA和Cu2+,肿瘤细胞中过表达的GSH刺激CACuPDA释放Cu2+和肉桂醛(CA),释放的CA导致线粒体功能障碍并产生更多的ROS。另一方面,Cu2+消耗GSH生成Cu,Cu与H2O2反应生成·OH,导致肺癌细胞中ROS水平显著增加。此外,Cu2+通过调节胱氨酸转运受体(xCT)抑制GSH合成,并直接降解GPX4,导致细胞内GSH和GPX4的急剧降低和ROS的显著增加,从而加速铁死亡和细胞膜损伤。有趣的是,作者发现Cu2+通过减少铁氧还蛋白(FDX1)诱导铜死亡,促进细胞裂解和铁死亡,增强下游适应性免疫的激活,增加肺肿瘤对抗PD-L1治疗的敏感性。体内实验结果表明,CACuPDA诱导的正反馈增强肺肿瘤对ICB治疗的敏感性,比单一抗PD-L1治疗更有效地抑制肿瘤生长。总体而言,这种通过诱导铁死亡和铜死亡来调节免疫抑制性肿瘤微环境的策略,有望增强针对肺部恶性肿瘤的免疫治疗效果。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202503208
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)