首页 > 医疗资讯/ 正文
心肌梗死(MI)后梗死区过度纤维化是诱发心力衰竭并最终导致患者死亡的重要原因,其核心病理表现为心脏成纤维细胞(CFs)的异常增殖与活化,并过量分泌细胞外基质(ECM),导致心肌组织纤维化僵硬及功能丧失。尽管嵌合抗原受体巨噬细胞(CAR‑MΦ)疗法通过特异性清除活化的CFs展现出巨大的抗纤维化潜力,但梗死区大量凋亡细胞引发的胞葬作用超载,严重削弱其吞噬效能与治疗持续性,限制了其临床转化。
2025年4月14日,山东大学齐鲁医院徐峰教授与药学院姜新义教授团队在Advanced Materials上发表了题为“Legumain in Situ Engineering Promotes Efferocytosis of CAR Macrophage to Treat Cardiac Fibrosis”的研究成果。该研究创新性地构建了一种脂质纳米粒(LNPs)递送系统,将编码调控吞噬溶酶体形成的溶酶体半胱氨酸蛋白酶Legumain (Lgmn)和抗成纤维细胞活化蛋白(FAP) CAR的双mRNA递送至梗死区,原位重编程巨噬细胞,生成“胞葬增强、靶向FAP的CAR-MΦ”,显著提升了MI后纤维化的治疗效果。

在这项研究中,研究团队首先完成了巨噬细胞靶向LNPs递送系统的构建和体外生物学评价。结果显示,该系统显著提升了mRNA在巨噬细胞内的摄取和表达效率。LNPs关键组分可电离脂质D-2在酸性环境下被质子化,与溶酶体膜脂发生静电作用,破坏膜结构,促进mRNA释放至胞浆,实现高效基因编辑。功能验证显示,Lgmn/CAR-LNP处理组对FAP+靶细胞的吞噬率较常规CAR-LNP组提高2.1倍,较裸mRNA组提升7.2倍。Lgmn过表达通过促进LC3-II依赖性吞噬溶酶体形成和钙离子富集,提升了吞噬溶酶体的降解效能,有效增强了CAR-MΦ的胞葬功能,为后续体内抗纤维化治疗奠定了坚实的基础(图1)。
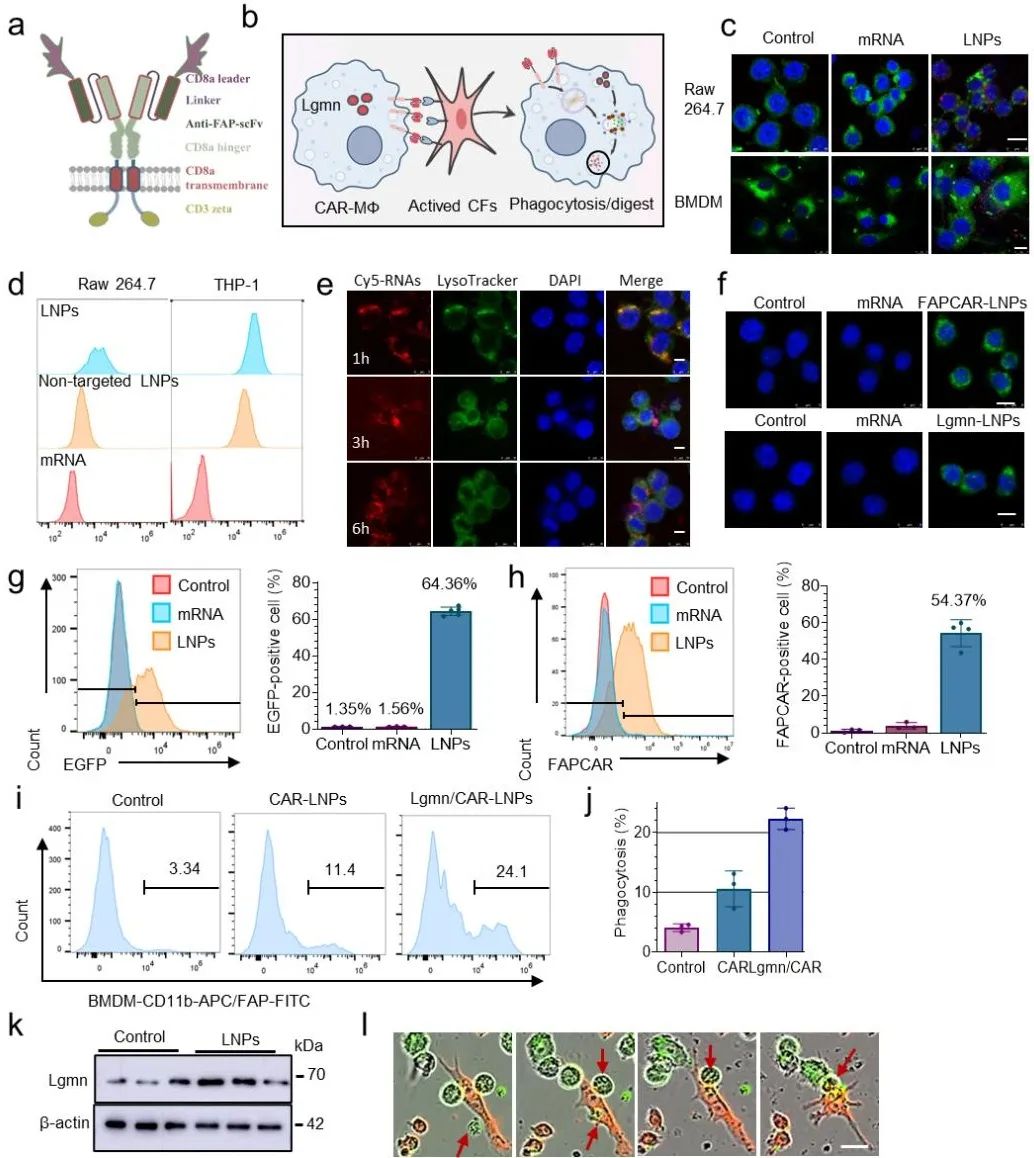
图1. LNPs介导的Lgmn工程化CAR-MΦ的产生
研究团队随后在小鼠MI模型中,进一步验证了LNPs的靶向递送和体内安全性。小动物活体成像系统(IVIS)显示,LNPs能高效穿越受损心脏血管屏障,精准地将治疗性mRNA递送至梗死区巨噬细胞中;同时,基于基质金属蛋白酶‑2/9 (MMP‑2/9)响应设计的LNPs,在MMP‑2/9高表达的梗死组织中释药率显著提升,而在正常心肌中的释放则极为有限,实现病灶特异性递送。Luci mRNA示踪转染信号于给药后第3天达到峰值,第5天仍可检测,据此确立了每3天一次的优化给药方案。此外,未观察到主要器官的毒性反应或血液生化指标的异常,充分证明了LNPs的良好体内相容性与安全性(图2)。
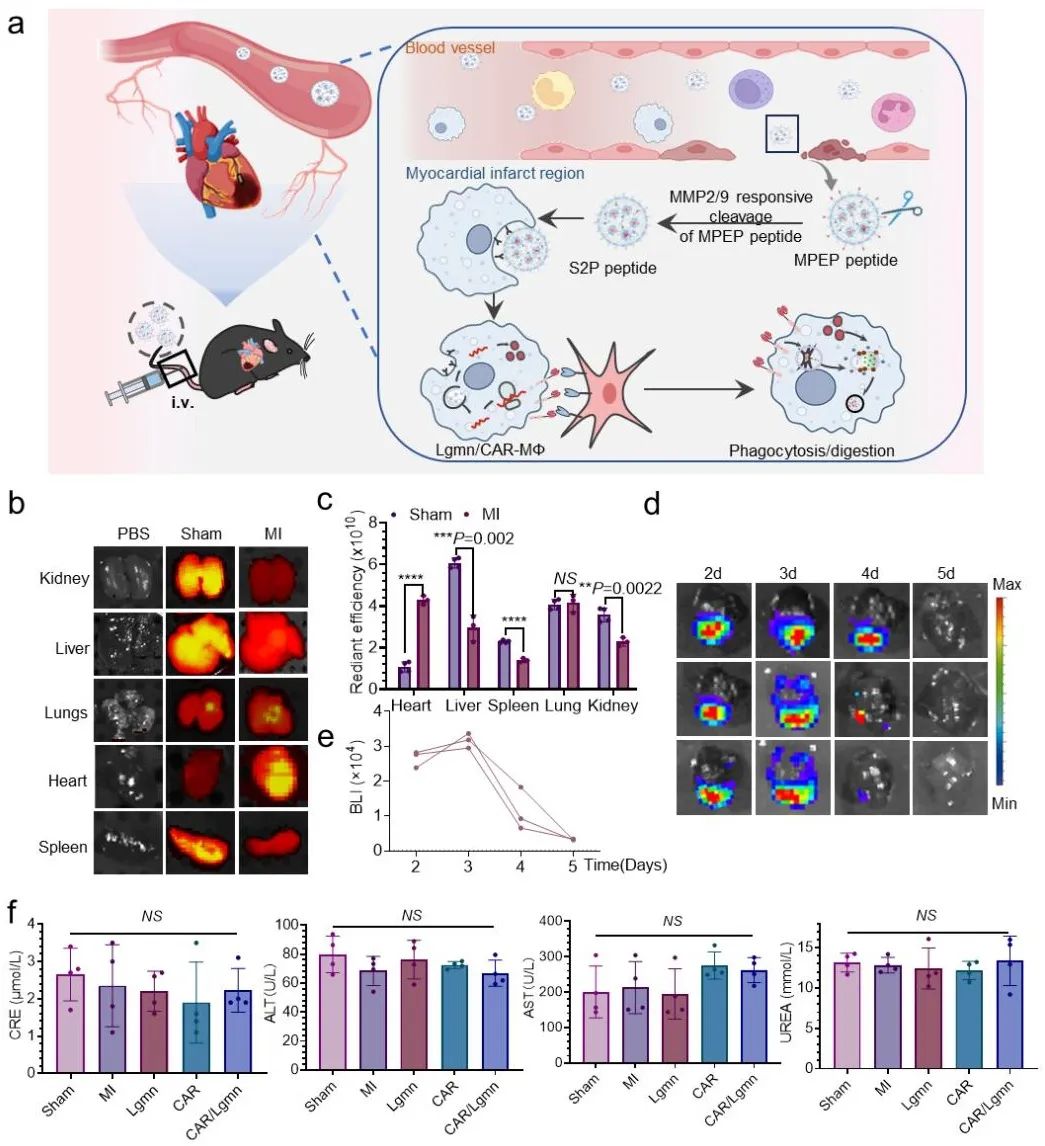
图2. LNPs的心脏靶向性与安全性评价
最后,研究团队在小鼠MI模型中评估了Lgmn工程化CAR-MΦ的治疗潜力。通过尾静脉注射不同配方的LNPs,每3天一次,连续给药2周。结果显示,LNPs可特异性地被梗死区CD45+ F4/80+巨噬细胞摄取,并在体生成胞葬增强、FAP特异性CAR-MΦ。与对照组相比,接受Lgmn、CAR和Lgmn/CAR LNPs治疗的MI小鼠在心脏功能和生存率方面均有显著改善,其中Lgmn/CAR组的疗效最佳。组织学分析进一步证实,Lgmn/CAR组小鼠心肌纤维化面积显著减少,心肌重构程度明显改善,充分验证了该策略在减轻MI后的心肌纤维化、促进心脏修复中的潜力(图3)。
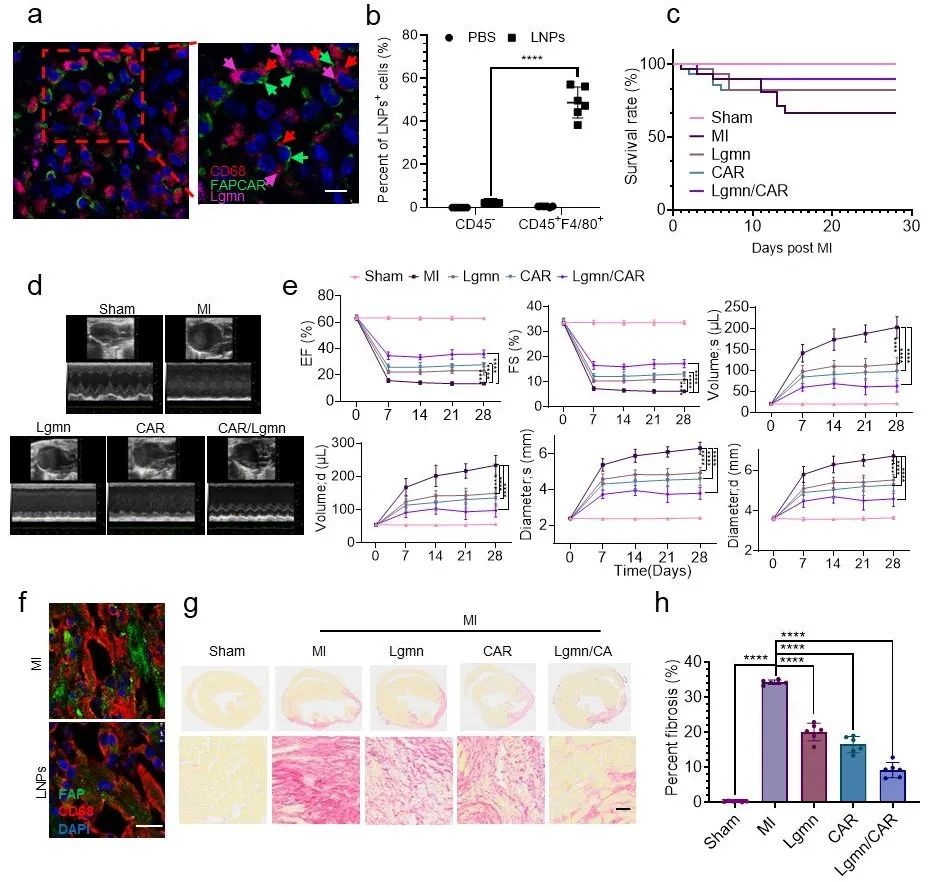
图3. LNPs显著改善MI后心功能并逆转纤维化进程
综上,该研究首次阐释了Lgmn能显著增强CAR-MΦ细胞治疗的胞葬功能,从而提升其抗纤维化效能,为原位生成CAR‐MΦ治疗心肌梗死后等的纤维化提供了崭新策略。该策略有望推广应用于肝纤维化、肺纤维化等其他纤维化疾病的免疫治疗,为解决纤维化相关疾病提供了全新的解决思路。
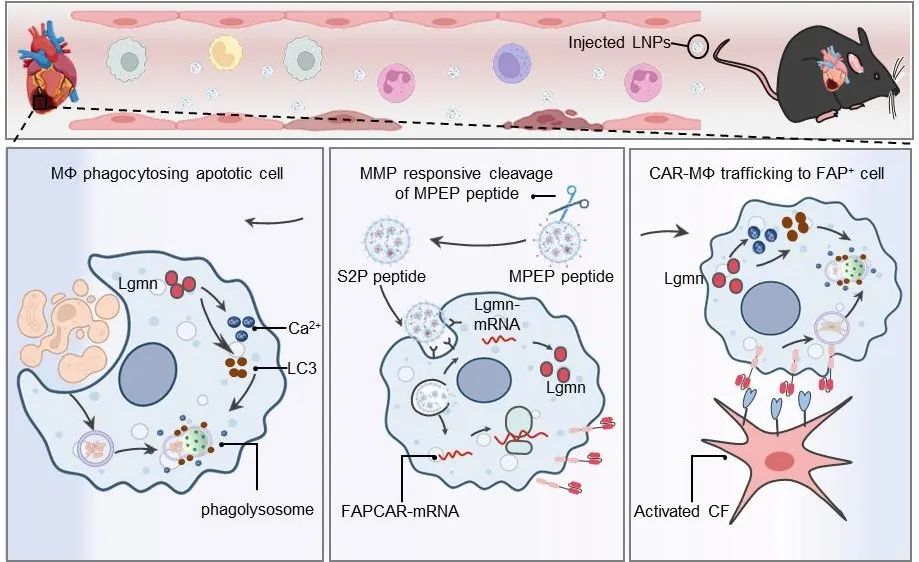
图4. LNPs在体生成胞葬增强型CAR‑MΦ的递送策略及作用机制示意图
徐峰教授、药学院姜新义教授与齐鲁医院急诊科陈玉国教授共同担任通讯作者,博士后刘泽娟、陈晨和张玉霖为共同第一作者,山东大学为第一作者和独立通讯作者单位。该研究得到了国家自然科学基金、博士后基金、山东省自然科学基金等项目的资助,并已申请发明专利1项,正积极推进临床转化研究。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202417831
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)