首页 > 医疗资讯/ 正文
急性缺血性卒中(Acute Ischemic Stroke, AIS)为我国致死致残首位病因,血管再通治疗是当前最有效手段,但目前血管再通治疗后出血转化(Hemorrhagic Transformation, HT)的发生率仍高达10-48%,严重影响了有效再通的成功率,精准识别HT的潜在风险并及早干预,将有利于提高再通成功率,保障患者性命安全。AIS后脑部缺血区域的神经元和血管因缺氧受损,血脑屏障(Blood-brain Barrier, BBB)随之破坏,因此血管再通治疗后可能导致HT发生。尽管此前已知神经与血管之间存在相互作用,但神经元和血管如何合作实现BBB修复具体机制尚不明确。
暨南大学附属第一医院徐安定/逯丹教授团队前期报道了缺氧特异性CircOGDH是AIS诊断和缺血半暗带预测的生物标志物,主要表达在缺血半暗带神经元中。在此基础上,2025年4月2日,该团队联合中山大学孙逸仙纪念医院麦鸿成副研究员于国际期刊Stroke在线发表题目为“Small extracellular vesicles from hypoxia-neuron maintain blood-brain barrier integrity”的研究论文,针对AIS并发出血转化病理机制,探究了急性缺血性卒中后血脑屏障修复的分子机制,通过小规模临床病例对照研究、脑组织样本和动物细胞实验验证,详细阐述了AIS生物标志物CircOGDH在缺血半暗带神经元中通过小细胞外囊泡(Small Extracellular Vesicles, sEVs)传递至内皮细胞保护BBB并进入循环的分子机制。

1. 脑卒中患者血CircOGDH水平与HT呈负相关
本研究纳入AIS再通治疗后18对有或无HT患者,发现有HT患者血浆CircOGDH表达水平较非HT患者显著降低,进一步检测15例HT患者CircOGDH水平与血肿体积呈显著负相关(r=−0.629, P=0.014)。对脑组织样本进行免疫荧光分析发现自发性脑出血患者神经元CircOGDH信号强度仅为AIS合并HT患者的约1/4,表明缺氧神经元CircOGDH的缺失与BBB破坏相关,该结果首次在临床层面证实CircOGDH可作为预测HT风险的潜在生物标志物。
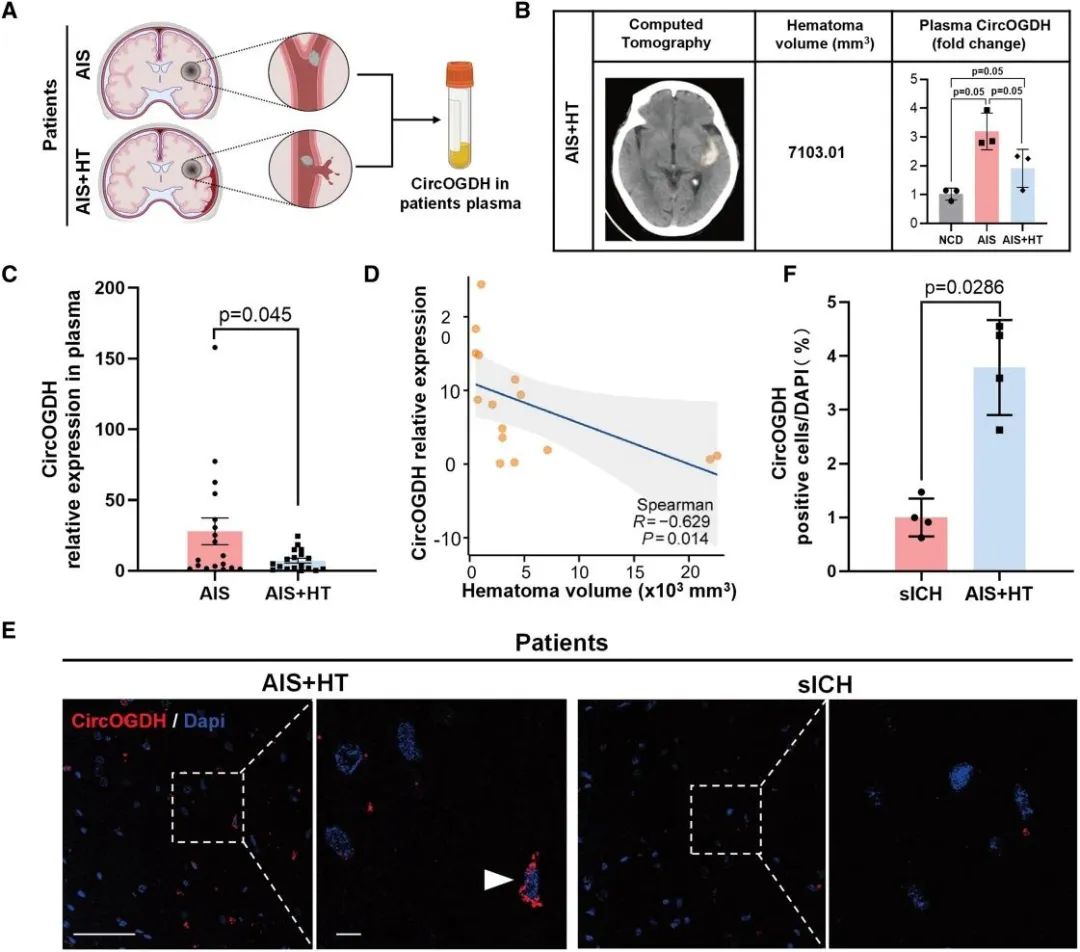
图1. 急性缺血性卒中后有出血转化患者CircOGDH水平较无出血转化患者低
2. 缺血性卒中模型小鼠缺氧神经元CircOGDH水平降低导致BBB通透性升高
接下来,为了探究缺氧神经元CircOGDH对血管稳态的调控作用,研究者通过向小鼠侧脑室注射AAV-hSyn-shRNA特异性敲除神经元CircOGDH,并于21天后构建大脑中动脉闭塞/再灌注(MCAO/R)模型,术后24小时与注射空载病毒组相比,神经元敲低CircOGDH组伊文思蓝渗漏增加3.74倍,NHS-biotin渗透增加3.25倍,普鲁士蓝染色显示铁沉积面积扩大1.62倍,提示CircOGDH缺失通过破坏内皮结构完整性加剧BBB渗漏。
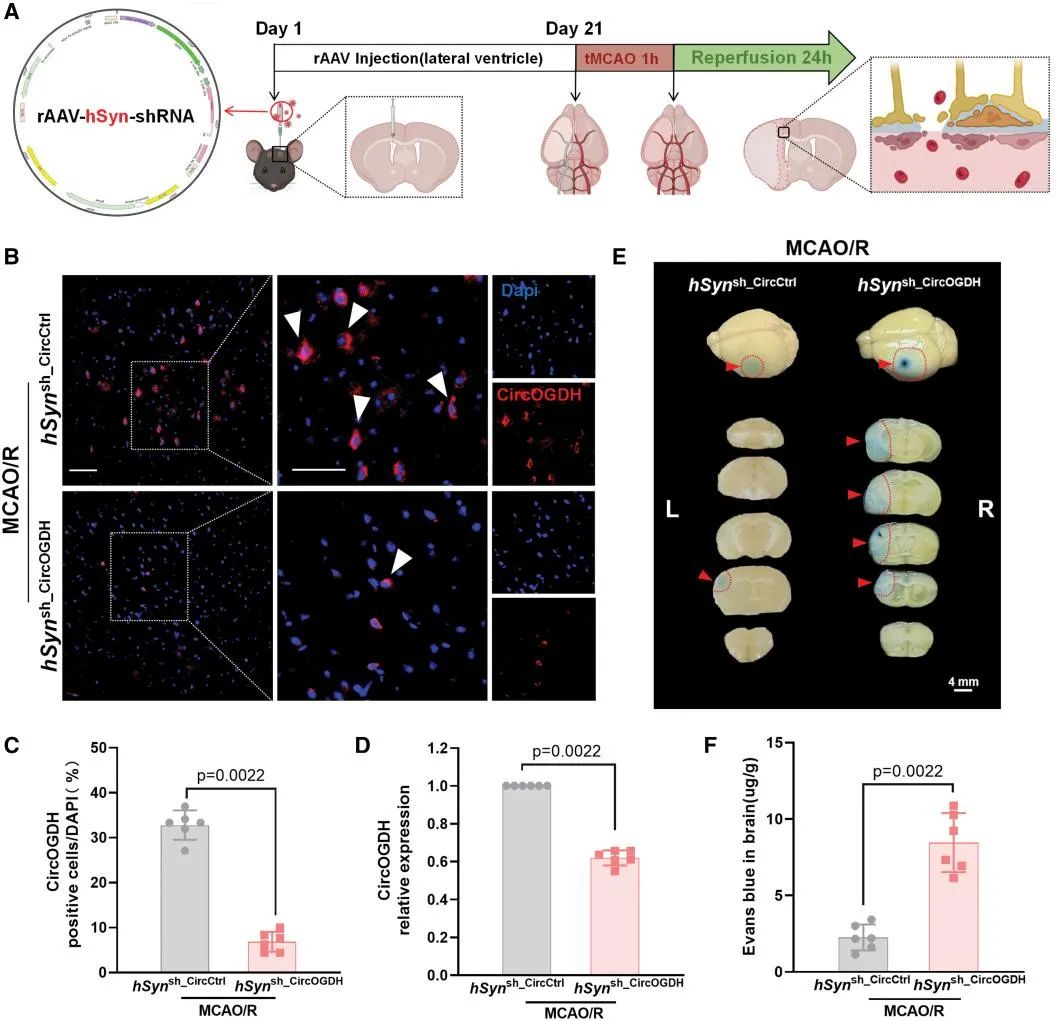
图2. MCAO/R模型小鼠神经元CircOGDH的敲低会加剧血脑屏障(BBB)的通透性
3. 抑制神经元CircOGDH后MCAO/R小鼠紧密连接蛋白表达降低和血脑屏障结构改变
从观察到CircOGDH影响BBB通透性的现象,研究者进一步解析CircOGDH对BBB完整性的分子结构基础,深入分析了紧密连接蛋白的表达变化。小鼠在缺血再灌注模型下神经元CircOGDH敲低导致ZO-1和occludin免疫荧光信号降低,进一步蛋白质印迹法检测缺血半暗带区紧密连接蛋白ZO-1、occludin及claudin-5表达分别下降31%、15%和12%。透射电镜超微结构观察发现,敲低组21%的紧密连接存在超过10个连续性断裂(空载病毒组仅5%),且基底膜胶原结构松散。这些数据表明,CircOGDH通过维持紧密连接蛋白表达和基底膜完整性保护BBB。
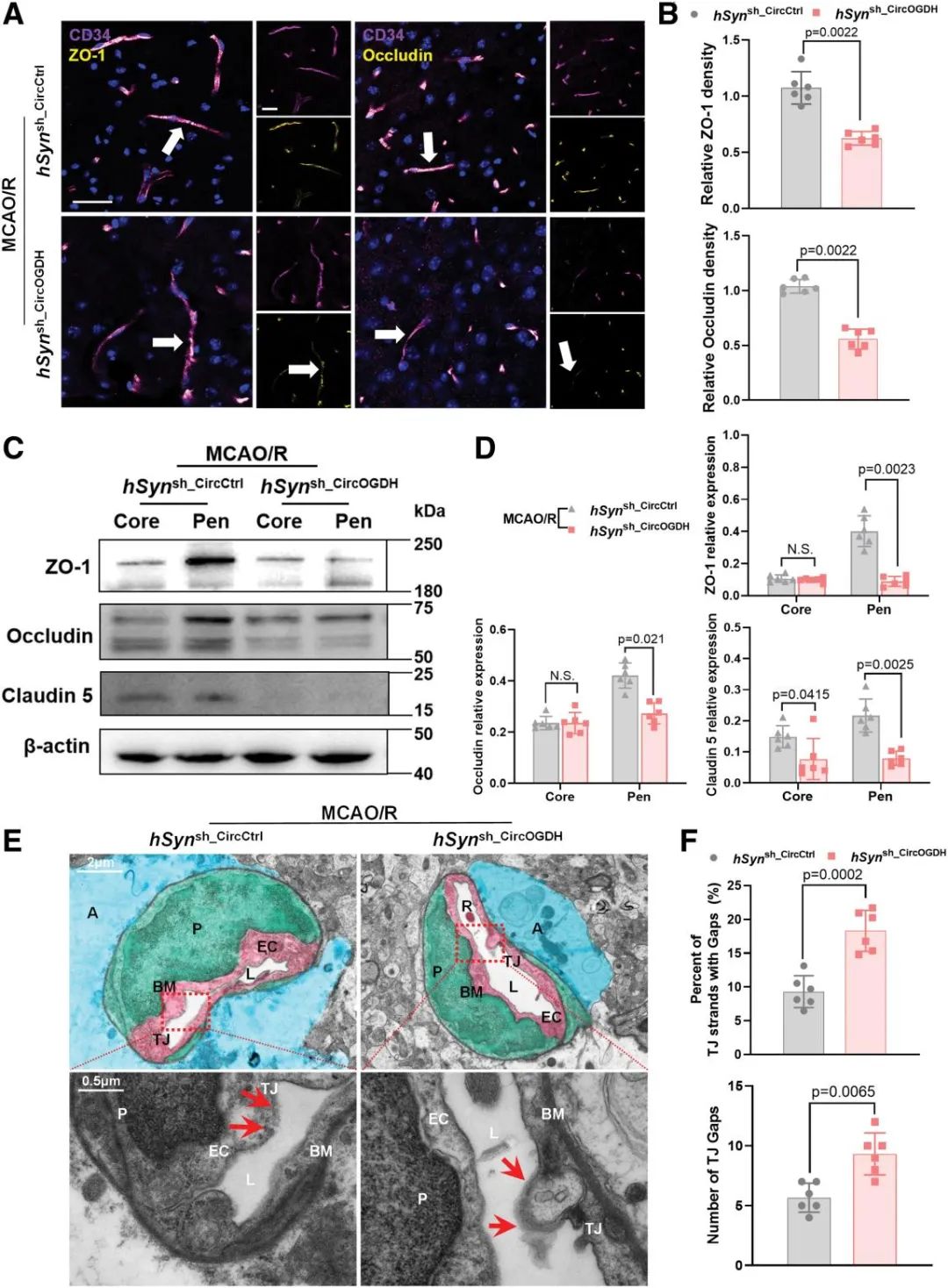
图3. CircOGDH调控MCAO/R模型小鼠BBB中紧密连接蛋白的表达
4. 抑制神经元CircOGDH导致MCAO/R后小鼠脑血脑屏障内皮细胞(ECs)的胞吞和内吞作用增加
除BBB结构破坏外,CircOGDH缺失还通过调控内皮细胞运输途径加剧BBB损伤,通过检测小窝蛋白Cav-1(调控胞吞作用的关键分子),发现CircOGDH敲低组内皮细胞Cav-1蛋白水平较对照组升高2.66倍。Alb-Alexa594内吞实验显示,敲低组阳性内皮细胞比例从对照组的9.5%增至18%,表明缺氧神经元CircOGDH的减少通过上调内皮细胞内吞和胞吞作用破坏BBB选择性通透性,这可能是再灌注过程中血脑屏障功能受损的原因之一。
5. 神经元CircOGDH通过sEVs向HBMEC传递提高HBMEC缺氧/复氧损伤后的CircOGDH水平并增加存活率
研究者进一步解析从体内实验转向体外sEVs介导的传递机制,体外Transwell共培养实验显示,缺氧SH-SY5Y神经元释放的sEVs可将CircOGDH转运至人脑微血管内皮细胞(HBMECs),使其CircOGDH水平提升1.7倍。当使用sEVs分泌抑制剂GW4869处理后,HBMECs的CircOGDH水平无显著变化。功能实验表明,糖氧剥夺模型下富含CircOGDH的sEVs处理使HBMECs凋亡率降低,跨内皮电阻(TEER)实验验证了富含CircOGDH的sEVs可以显著减轻内皮缺氧损伤后内皮屏障的完整性和通透性的破坏,此结果明确了sEVs作为CircOGDH传递载体的关键作用。
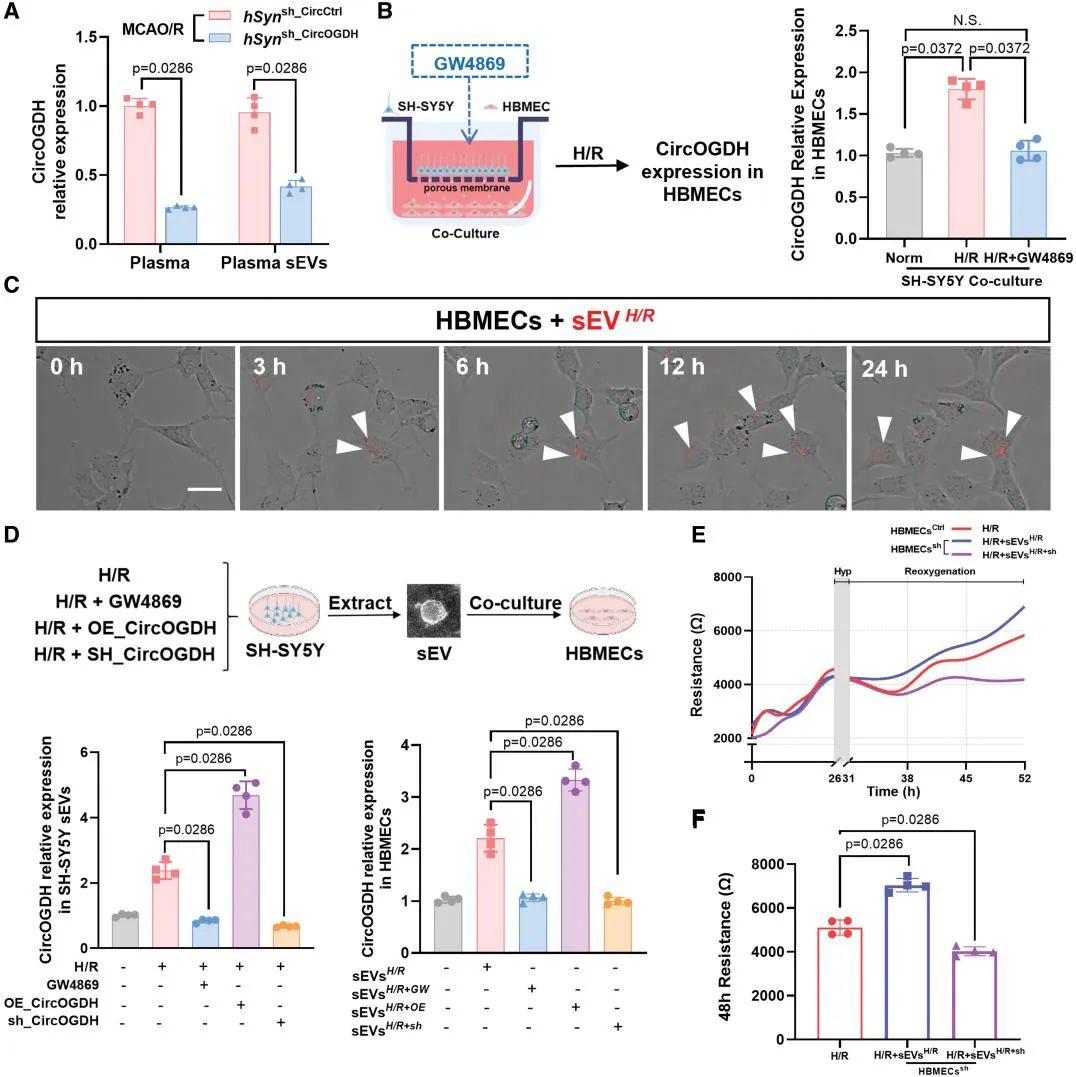
图4. 缺氧再灌注后神经元CircOGDH通过sEVs影响HBMEC CircOGDH水平调节HBMEC功能
6. 缺氧/复氧后CircOGDH调节其下游蛋白COL4A4在神经元和ECs中的表达
进一步研究发现,sEVs传递的CircOGDH通过调控特定靶基因发挥保护作用。RNA测序分析发现,CircOGDH过表达的HBMECs中328个基因显著上调(log2FC>2),其中IV型胶原蛋白α4链(COL4A4)表达提升6.9倍。蛋白印迹法证实,缺氧下过表达CircOGDH的HBMECs上调COL4A4蛋白水平。动物模型缺血半暗带中,免疫荧光显示神经元特异性敲低CircOGDH与CD34(内皮标记物)共定位率显著减少,COL4A4表达水平也显著下降,表明CircOGDH通过调控COL4A4维持血管基底膜稳定性。
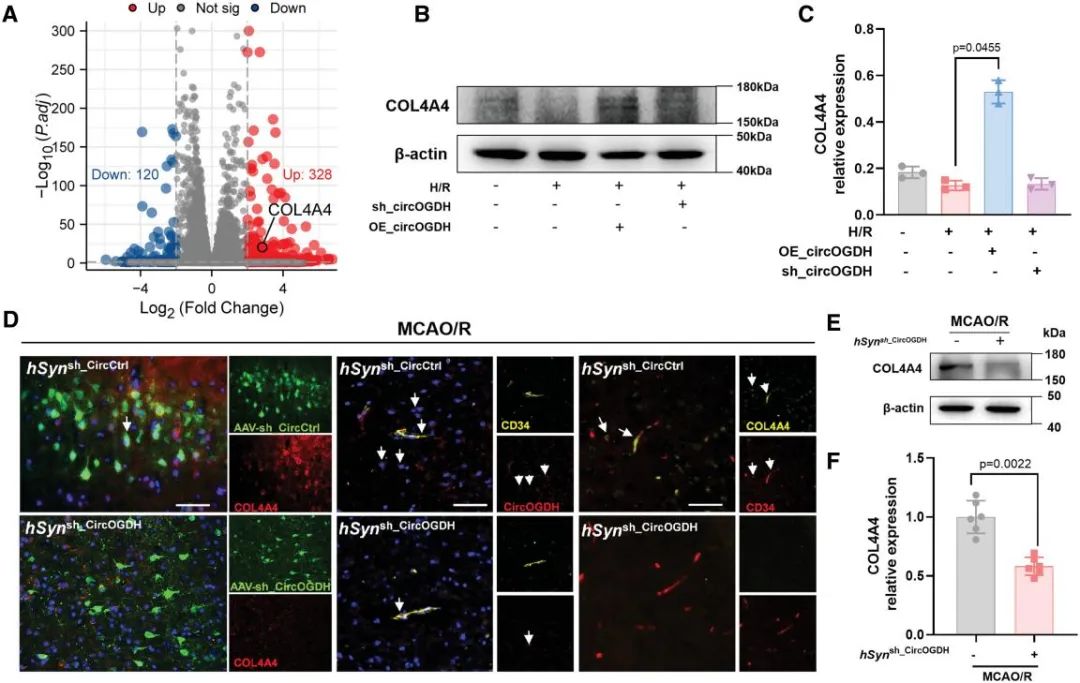
图5. CircOGDH调节神经元和ECs中COL4A4 的表达
7. CircOGDH通过COL4A4介导HBMEC功能调控
最后,研究者通过基因干预验证CircOGDH-COL4A4轴的分子机制,在缺氧条件下HBMECs中敲低COL4A4后,即使CircOGDH过表达,ZO-1和occludin水平仍较对照组降低;反之,COL4A4过表达可使缺氧下HBMECs紧密连接蛋白丢失减少,也可显著促进敲低CircOGDH的HBMECs的迁移。此证实COL4A4是CircOGDH下游的核心效应分子,此发现为靶向COL4A4的卒中治疗策略提供了依据。
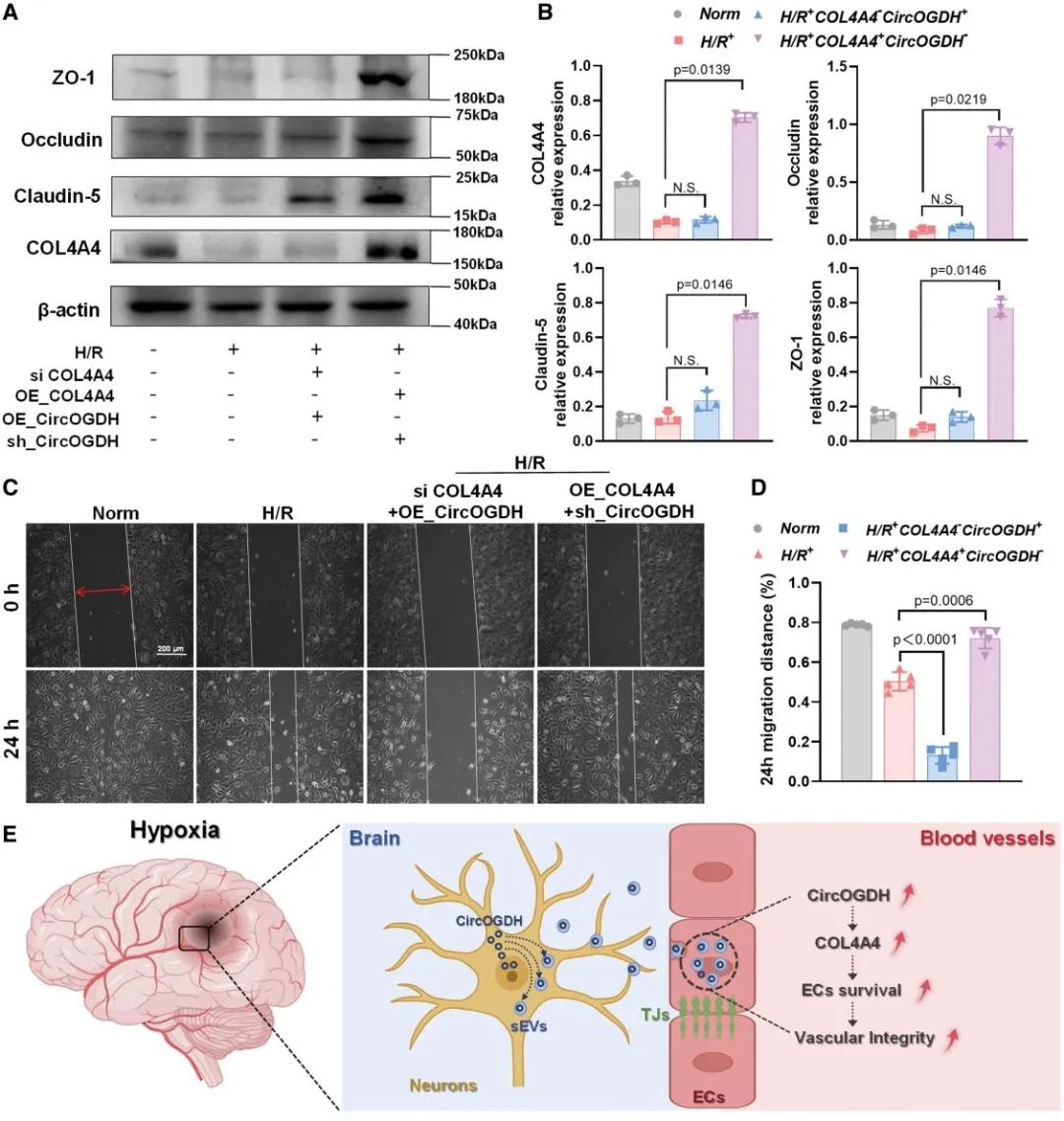
图6. CircOGDH通过COL4A4介导HBMEC功能调控
综上,该研究的相关成果系统地论证了神经元CircOGDH通过sEVs传递至内皮细胞保护血脑屏障并进入循环的分子机制。通过将临床数据与基础研究相结合,本研究不仅验证生物标志物CircOGDH在AIS并发出血转化的临床价值,还揭示其背后的生物学机制,推动AIS诊疗的精准化和个体化发展。
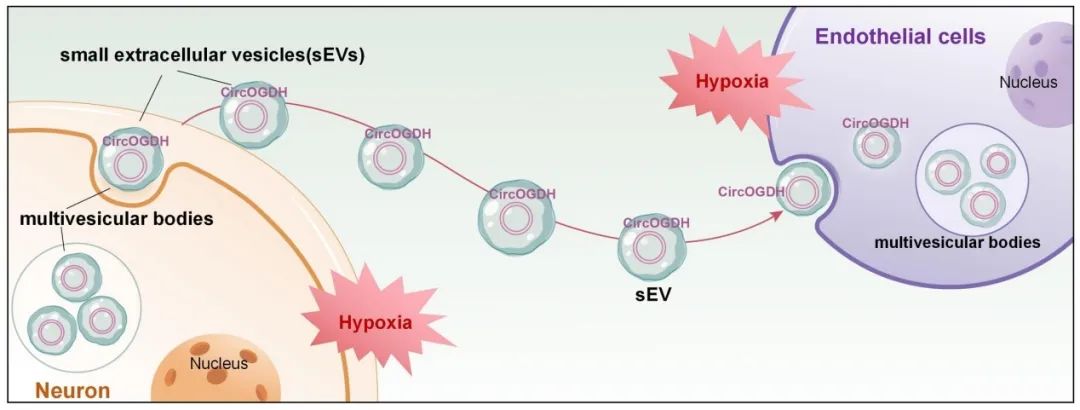
图注:本研究揭示了缺氧状态下神经元通过sEVs传递CircOGDH的关键作用,其通过上调ECs中COL4A4的表达,维持BBB完整性。这一发现阐明了缺氧环境下神经与血管的交互机制,并凸显神经元sEVs在调控脑血管疾病中的核心价值。
本研究暨南大学附属第一医院为第一完成单位,逯丹研究员、徐安定教授、麦鸿成副研究员(合作单位:中山大学孙逸仙纪念医院)为本论文通讯作者,陈慰博士后、吴有盛博士后、梁颖硕士、苏璇琳博士后为本论文共同第一作者。
原文链接:
https://www.ahajournals.org/doi/10.1161/STROKEAHA.124.048446
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)