首页 > 医疗资讯/ 正文
编者按:肺癌是全世界发病率和死亡率均居前列的恶性肿瘤。临床实践中,大部分晚期肺癌患者的疼痛症状能够通过WHO三阶梯镇痛治疗原则和NCCN成人癌痛指南推荐的规范化药物治疗得以缓解,相应的药物治疗包括阿片类药物如羟考酮、吗啡、羟吗啡酮、芬太尼等;辅助镇痛药如抗抑郁药物包括阿米替林、文拉法辛、度洛西汀等和抗惊厥药物包括加巴喷丁和普瑞巴林以及非甾体类药物或类固醇激素;骨转移癌性疼痛药物如双膦酸盐药物包括唑来膦酸、伊班膦酸等和核因子κB受体活化因子配体(RNAKL)抑制剂包括地舒单抗等。但仍有部分终末期晚期肺癌患者的疼痛仅通过常规的药物治疗难以得到控制和(或)出现不能耐受的副反应,属于难治性癌痛。
本期「专家组稿」由曲靖市第二人民医院丁伟星教授担任执行主编,与曲靖市第二人民医院罗详冲医生共同分享《晚期肺癌伴难治性癌痛的微创介入治疗策略最全总结》,为医者和患者提供更多参考。
难治性癌痛定义为由肿瘤本身或肿瘤治疗相关因素导致的中、重度疼痛,经过规范化药物治疗1-2周患者疼痛缓解仍不满意和(或)不良反应不可耐受。目前难治性癌痛是临床医生亟待解决的棘手问题。近年来,随着微创介入治疗技术包括患者自控镇痛泵技术(PCA);经皮椎体强化如经皮椎体成形术(PVP)和球囊扩张椎体后凸成形术(PKP);经皮射频消融如射频消融(RFA)、微波消融(MWA)、冷冻消融(CA)和高强度聚焦超声(HIFU)等;脊髓电刺激(SCS);经皮神经毁损如躯体神经毁损和内脏神经毁损包括腹腔神经丛毁损(CPN)、上腹下神经丛毁损(SHP-N)、星状神经节毁损(SGN)和奇神经节毁损(GIN)等;鞘内药物输注系统植入术(IDDS);放射性粒子植入术等的迅猛发展,极大的改善终末期肺癌患者的生活质量,成为了难治性癌痛的利器。本文全面总结晚期肺癌伴难治性癌痛的微创介入治疗策略,以期为临床提供指导与参考。
患者自控镇痛泵技术(PCA)
PCA是医护人员根据患者疼痛程度和自己的身体状况,采用PCA设备预先设置的镇痛药物如吗啡、氢吗啡酮、芬太尼、舒芬太尼和羟考酮注射剂等的剂量,再交由患者实现疼痛自我管理的治疗技术。
目前临床使用的PCA设备分为一次性机械泵和电子泵两类,电子泵因可根据患者疼痛情况灵活调整给药参数而更适合用于癌痛的临床治疗。PCA泵的参数设置包括负荷剂量、背景剂量、Bolus剂量、锁定时间和最大剂量五类,其给药模式包括单纯PCA和持续输注PCA两大类,单纯PCA没有背景输注剂量,仅设置Bolus给药剂量,患者可通过自控按钮完成单次注射,而持续输注PCA同时设置了背景输注和Bolus给药剂量,在背景输注剂量的同时,患者可通过自控按钮完成单次注射以控制爆发痛[1]。
根据给药途径的不同PCA可分为静脉PCA(PCIA)、皮下PCA(PCSA)、硬膜外腔PCA、鞘内PCA以及区域阻滞PCA等,其中,PCIA和PCSA是目前临床癌痛治疗中最常用的两种PCA给药途径。随着第三代PCA泵和人工智能的结合,未来可通过实时监测患者疼痛评分自动调整背景输注速率,减少人工干预,提高PCA居家普及率,显著改善患者生存质量。
经皮椎体强化技术
晚期肺癌伴脊柱转移所产生的溶骨性破坏可导致椎体压缩性骨折(VCF),进而使患者出现持续性的腰背部疼痛,严重时可影响肢体神经功能。经皮椎体成形术(PVP)和球囊扩张椎体后凸成形术(PKP)是椎体强化的标准微创技术,PVP通过经皮穿刺向病变椎体内直接注入骨水泥如聚甲基丙烯酸甲酯(PMMA),无需提前扩张椎体,操作时间较短[2];而PKP则是在注入骨水泥之前,先经皮植入球囊或扩张器撑开压缩的椎体并形成空腔,再分次注入骨水泥[3]。PVP和PKP都能有效缓解因肺癌伴脊柱转移或者椎体压缩性骨折导致的疼痛,同时可改善患者脊柱的稳定性和生活质量。PVP与PKP用于晚期肺癌伴骨转移治疗中存在区别见(表1)。
表1 PVP 与PKP 在晚期肺癌伴骨转移治疗中的区别
比较项目
PVP
PKP
适应症
晚期肺癌椎体转移引起的顽固性癌痛,且 CT提示溶骨性病变且椎体高度无明显变小,椎体后壁相对完整,需快速缓解疼痛的晚期癌痛患者,尤其是全身状况较差、无法耐受复杂手术者。
晚期肺癌椎体转移伴明显椎体压缩性骨折(椎体塌陷≤原高度 2/3),需恢复椎体高度以改善脊柱稳定性,需矫正后凸畸形以缓解神经根压迫癌痛患者。
禁忌症
椎体后壁或侧壁骨皮质严重破坏,椎体压缩性骨折高度>70%,肿瘤侵犯椎管或合并脊髓压迫。
椎体完全塌陷呈扁平椎,成骨性转移瘤或
椎管内有软组织肿块。
手术方式
直接经皮穿刺向病变椎体注入骨水泥,无需球囊扩张,手术时间较短,约30-45分钟左右。
先通过球囊扩张恢复椎体高度并形成空腔,再分次低压注入骨水泥,操作时间延长,约60-90分钟左右。
镇痛效果
术后24小时内疼痛缓解率可80%-90%,适合需快速镇痛的晚期癌痛患者。
癌痛缓解效果与PVP相当,但通过恢复椎体高度改善因脊柱后凸导致的神经根性疼痛。
脊柱稳定性
脊柱稳定性较PKP差
通过球囊扩张部分恢复椎体高度,矫正率可达 50%,降低邻近椎体再骨折风险,更适合预期生存期较长的患者。
并发症
骨水泥渗漏率较高,约 5%-10%左右,癌性溶骨性破坏患者风险更高。
球囊空腔形成使骨水泥渗漏率降至1%-5%左右。
费用和适用性
适合经济条件差或需多椎体治疗的广泛转移癌患者。
因需球囊等耗材,费用较PVP高30%-50%左右,推荐用于单发转移灶且预期生存期>6个月的患者,以改善长期生活质量。
优选建议
癌痛剧烈需立即缓解,且椎体结构破坏较轻,多发椎体转移需分次治疗以控制成本的患者优选PVP。
椎体塌陷导致脊柱后凸畸形或神经压迫症状,溶骨性破坏范围较大但未累及椎管,需降低骨水泥渗漏风险的患者优选PKP。
_
_
_
经皮消融技术
经皮消融技术根据消融原理的不同可分为热消融和低温消融,热消融主要包括射频消融(RFA)、微波消融(MWA)、高强度聚焦超声消融(HIFU)、激光消融等;低温消融主要指冷冻消融(CA)包括氩氦刀冷冻治疗、液氮冷冻治疗、脉冲冷冻治疗、低温半导体冷冻治疗等,目前临床上常用的消融治疗主要为射频消融、微波消融、冷冻消融以及高强度聚焦超声消融。
经皮射频消融技术 是指通过影像学的引导将消融电极装置植入肿瘤中心并通过射频电流(频率为460~500kHz)产生的热效应使肿瘤细胞发生凝固性坏死而达到消灭肿瘤细胞的目的。研究已表明,肿瘤细胞在温度处于50℃时,4~6分钟即可发生不可逆的变性坏死,RFA产生的持续高温(>100℃)可彻底灭活肿瘤组织,同时消融区域边界温度控制在 45℃以下可最大程度保护周围组织如减少对神经和脊髓的损伤[4]。
此外,RFA后肿瘤组织发生凝固性坏死周围会形成反应带可阻断肿瘤血供防止肿瘤细胞发生远处转移和扩散[5];肿瘤细胞产生的细胞因子如肿瘤坏死因子-β(TNF-β)和白细胞介素(IL)能刺激人体感觉神经而造成疼痛感觉,RFA可通过破坏肿瘤细胞而减少肿瘤细胞因子的产生同时高温会破坏局部感觉神经进一步阻断疼痛的传递而降低疼痛的发生。
经皮微波消融 是指在影像学引导下利用高频电磁波(频率为300~30000MHZ,波长为1~1000mm),使水分子发生高速旋转运动并相互摩擦产生高温(60-150℃)可使蛋白质发生变性进而使肿瘤组织发生凝固性坏死。因肿瘤组织含有丰富的血供且含水量高,微波对肿瘤组织的加热效应强于正常组织,肿瘤细胞受热后DNA、RNA和蛋白质合成减少,细胞膜通透性下降,胞内溶酶体活性升高,继而促进肿瘤细胞发生凋亡和坏死。RFA依赖肿瘤组织导的电性,血流丰富的区域容易受热沉效应的影响而降低了消融效果,与RFA相比,MWA微波穿透性强,受血流影响小,能够实现对更大的瘤体(≤5cm病灶)、更快速的升温(3-5 分钟/次),消融范围更均匀且边界清晰,并且对热传导的依赖较小[6]。因此,MWA能在更短的时间内进行更均匀的消融,同时不易受到热沉效应的影响。
冷冻消融 是应用特制的冷冻探针置入肿瘤组织内,将制冷剂如液氮和加压氦气等注入冷冻探针中使肿瘤组织温度迅速降至-40℃到-100℃,从而使肿瘤组织坏死达到肿瘤治疗目的[7]。其作用机理为极低温可快速冷冻肿瘤组织,使肿瘤细胞内外形成冰晶导致细胞膜破裂以及蛋白质变性造成细胞渗透性损伤,最终导致肿瘤细胞坏死或凋亡;同时,肿瘤组织微血管内皮受损诱发血栓形成进一步阻断肿瘤血液供应最终造成肿瘤组织缺血性坏死;此外,肿瘤细胞坏死崩解后释放的肿瘤抗原可激活机体自身免疫系统而增强机体的抗肿瘤免疫应答(如图1)[8]。通过术前精准的MRI、CT以及超声成像可将探针准确的插入肿瘤组织内,以便在团块的范围内形成冰球,控制冷冻范围,降低对血管和神经等重要结构损伤。冷冻消融对晚期肺癌引起的难治性癌痛具有显著的缓解效果,可破坏肿瘤周围痛觉神经末梢而阻断疼痛信号的传导达到快速缓解癌痛的目的。
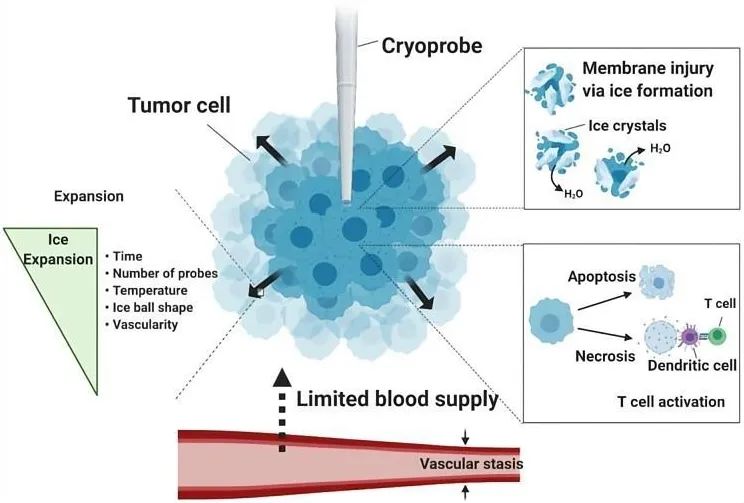
图1:冷冻消融的作用机制
高强度聚焦超声消融 又称“海扶刀”或聚焦超声消融手术(FUAS),是一种通过超声波能量实现完全无创的介入技术,由产生超声波能量的装置和能将体外发射的低能量超声波穿透人体组织后精准聚焦于明确目标靶点的换能器组成,HIFU的换能器包括可以在幅度和相位上具有单独调节能力的元件可以将焦点电子移向不同位置,进而可以在不移动患者的情况下靶向聚焦到更宽的区域[9]。在MRI或超声引导下,将超声波精准聚焦于毫米级范围内,通过产生的主要效应如热效应、空化效应以及机械效应等导致焦点处的组织发生凝固性坏死,而不损伤焦点外的正常组织和结构,其焦点处的温度可达到60~100℃,最终实现精确局部消融的目的(图2)。同时HIFU操作位于体外,通过水介质传递能量,避免皮肤或深层组织损伤,具备无切口、不流血、不留疤痕的无创性。当HIFU用于晚期肺癌的患者中,可致肿瘤细胞发生凝固性坏死,减少肿瘤对神经的压迫,同时消融后肿瘤组织释放的炎性因子减少,降低神经末梢的敏感性,最终达到缓解疼痛的目的。
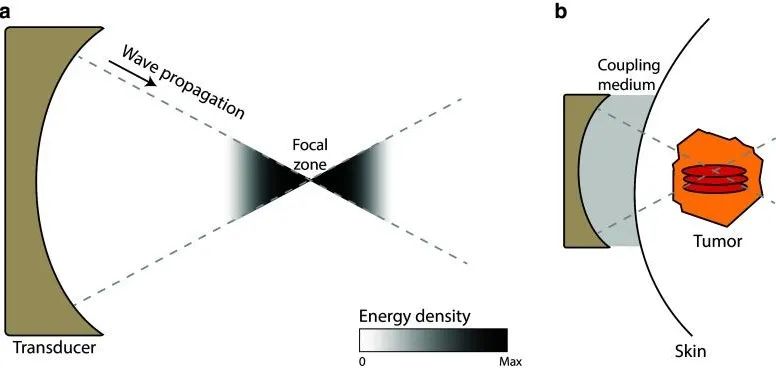
图2:高强度聚焦超声消融的作用示意图
目前临床上,如何选择射频消融、微波消融、冷冻消融以及高强度聚焦超声消融需结合患者全身状况、肿瘤病灶大小及位置。
射频消融以精准控温和对周围组织如神经和脊髓的损伤较小,适合于肿瘤病灶较小或病灶处于敏感区域的患者;微波消融以穿透性强,消融范围更均匀、边界清晰且升温快的高消融见长,但需警惕对周围正常组织和结构的损伤,适合于肿瘤病灶较大的患者;冷冻消融则通过精准的低温可控性在复杂解剖区域发挥重要价值;高强度聚焦超声凭借无创性、精准性和安全性在深部肿瘤病灶中凸显优势。射频消融、微波消融、冷冻消融以及高强度聚焦超声消融治疗晚期肺癌伴疼痛的比较如(表2)。
表2 射频消融、微波消融、冷冻消融以及高强度聚焦超声消融的比较
比较
项目
射频
消融
微波
消融
冷冻
消融
强度聚焦超声消融
作用机理
通过影像学的引导将消融电极植入肿瘤中心并通过射频电流产生的热效应使肿瘤细 胞发生凝固性坏死而达到消 灭肿瘤细胞的目的
在影像学引导下利用高频电磁波使水分子发生高速旋转运动并相互摩擦产生高温可使蛋白质发生变性进而使肿瘤组织发生凝固性坏死
应用液氮和加压氦气等注入冷冻探针中使肿瘤组织温度迅速至-40℃ 到-100℃,从而使肿瘤
组织坏死达到肿瘤治疗目的
利用超声波聚焦产生的热效应、空化效应以及机械效应等导致焦点处的组织发生凝固性坏死
适合肿瘤病灶特征
直径<3cm的肿瘤病灶,远离隔肌或大血管
直径较大(5-8cm)肿瘤病灶,血供丰富的病灶,不易受热沉效应的影响
邻近神经或重要器官的肿瘤病灶
深部的肿瘤病灶
创伤性
微创,需经皮穿刺
微创,需经皮穿刺
微创,需经皮穿刺
完全性无创
优势
能快速减轻肿瘤病灶对神经的压迫性疼痛,但对神经热损伤可能会短期加
重疼痛
升温较RFA更快能减少术中疼痛且消融范围更均匀降低周围组织损伤风险
可破坏肿瘤周围痛觉神经末梢而阻断疼痛
信号的传导达到快速缓解癌痛,术后急性
疼痛较轻
完全性无创操作避免穿刺相关性疼痛,精准消融减少神经及周围组织损伤,术后恢复快
缺点
射频消融范围有限导致可能需要多次操作
因高温影响肿瘤病灶周围神经可能会出现短暂的灼痛
冷冻-复温循环可能会引起短暂的胀痛
对骨骼遮挡或含气的肿瘤病灶效果较差
脊髓电刺激
脊髓电刺激(SCS)是通过微创手术将刺激电极植入脊髓节段的硬脊膜外隙,利用脉冲电流刺激脊髓A-β粗神经纤维进一步阻断疼痛信号(C 纤维和A-δ纤维)上传至大脑而达到缓解疼痛的目的。目前SCS作用机制包括γ-氨基丁酸能机制即SCS通过促进GABA神经递质(γ-氨基丁酸)的释放,激活GABA-B受体,抑制神经元的痛觉传递;5-羟色胺机制即SCS激活脊髓5-羟色胺(5-HT)受体,增加5-HT的释放而抑制疼痛信号的传导;胆碱能和肾上腺素能机制即SCS可使脊髓中乙酰胆碱和去甲肾上腺素的水平升高并抑制去甲肾上腺素能脊髓下行疼痛信号通路;阿片能系统及内源性大麻素系统机制即SCS通过阿片受体如μ、δ或κ受体介导,低频率刺激能增加脑脊液中的内啡肽,高频率刺激提升脊髓内强啡肽水平而发挥内源性镇痛作用(图3)[10]。
目前常用的SCS系统包括植入式脉冲发生器(IPG)、电极、延伸导线、病人程控仪、病人程控充电器和体外程控仪(图4)[11],其调控参数主要包括电压、脉宽和频率,可根据不同的刺激参数进行调节使病人获得个体化的治疗效果。
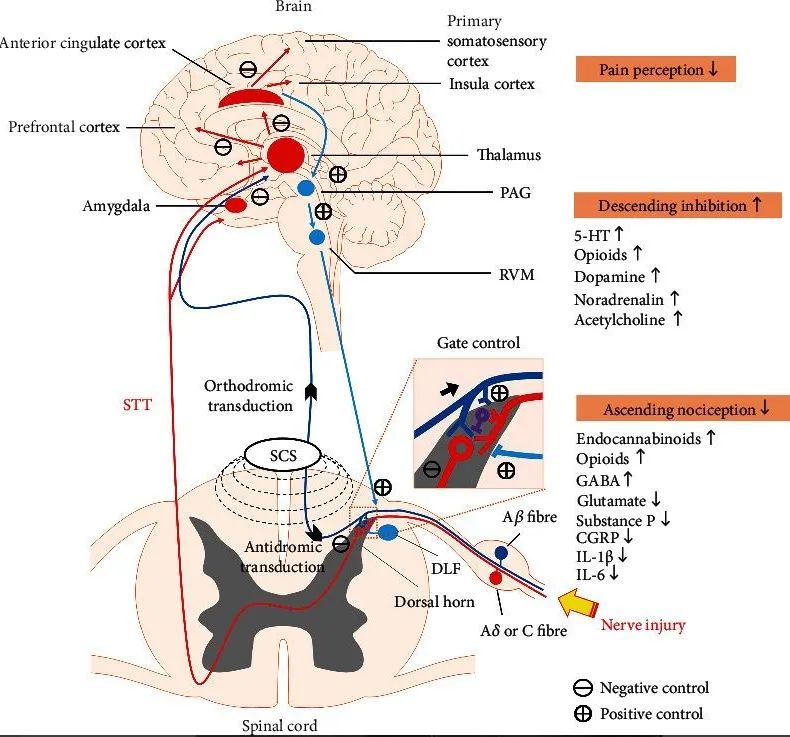
图3:脊髓电刺激作用机制示意图
图4:脊髓电刺激系统电极导线示意图
SCS是一种新兴的神经调控微侵袭技术,其已被美国食品药品监督管理局(FDA)批准用于治疗躯干和/或四肢的多种慢性顽固性疼痛如复杂区域疼痛综合征(CRPS)、持续性脊柱疼痛综合征(PSPS)、脑卒中后疼痛、缺血性下肢疼痛、痛性糖尿病神经病变(PDN)和难治性非手术性背痛。
SCS具有较多优势,如①微创性:无需开放脊柱骨性结构,创伤小且可逆;②有效性和安全性:对约50%-70%的慢性疼痛患者如CRPS术后疼痛缓解明显,尤其对常规止痛效果不佳的患者疗效更为显著,且安全性高其并发感染、出血或血肿的发生率低于5%;③无药物副作用:SCS不依赖阿片类药物,避免了长期使用止痛药物带来的副作用;④可调节性:可以根据患者的疼痛程度,随时调整SCS刺激参数,以达到最佳的个体化治疗效果;⑤生活质量明显提升:多数患者经SCS治疗后睡眠质量、活动能力和心理状态明显改善,整体生活质量显著提升。
基于上述诸多优势使SCS成为癌痛患者的重要利器,尤其对于常规治疗无效的顽固性疼痛病人。SCS按时间分为短时程SCS和永久性SCS,按类型分为传统的SCS、高频脊髓电刺激(HF-SCS)、爆发式SCS、闭环 SCS、无线SCS、背根神经节刺激(DRGS)及高密度脊髓电刺激(HD-SCS)等,临床选择中可根据患者的综合情况选择合适的SCS。针对晚期肺癌的患者,预计预期生存期>3个月,且阿片类止痛药物或放疗、化疗等常规疗法效果不佳的患者,可考虑SCS治疗,同时SCS联合其它镇痛方式的多模式镇痛治疗可显著缓解晚期肺癌患者的疼痛和提高患者生活质量。
经皮神经毁损术
经皮神经毁损术根据毁损的方法不同分为物理性神经毁损和化学性神经毁损,按照毁损的部位不同分为躯体神经毁损和内脏神经毁损。
物理性神经毁损是指通过物理手段如射频热凝术、冷冻神经阻滞以及外科手术切断或切除等直接破坏神经组织或信号传导通路,以达到阻断疼痛或改变神经传导进而缓解疼痛的目的,临床上常用的物理毁损技术是射频热凝治疗技术。
化学性神经毁损是指通过注射特定化学制剂如无水乙醇、苯酚和亚甲蓝等选择性破坏神经纤维,导致神经蛋白变性或传导功能丧失,阻断痛觉信号传递而达到镇痛的目的。
躯体神经毁损通常指肋间神经毁损术利用物理或化学手段破坏肋间神经传导功能,用于恶性肿瘤浸润肋间神经引起的难治性病理性疼痛。
内脏神经毁损包括腹腔神经丛毁损(CPN)、上腹下神经丛毁损(SHP-N)、星状神经节毁损(SGN)和奇神经节毁损(GIN)等。需要注意的是,癌痛患者通常采用神经毁损技术因其具备长期的镇痛效果,神经阻滞术只适用于诊断性治疗,因其镇痛时间短,需反复操作,增加创伤风险和药物不良反应,临床不建议长期、反复使用。
鞘内药物输注系统植入术
鞘内药物输注系统植入术(IDDS)是一种通过微创手术将镇痛泵植入硬膜外腔或鞘内,通过导管将镇痛药物如吗啡、氢吗啡酮、芬太尼、齐考诺肽等直接输注至脊髓蛛网膜下腔的脑脊液中,直接作用于中枢神经系统(CNS),阻断疼痛信号的传导而实现快速、长效、稳定的镇痛治疗[12]。临床常用的IDDS装置分为全植入式输注系统和半植入式输注系统两种。
全植入式具有病人感染风险低、舒适度高、后期管理维护便捷等优点,但其费用较高,药物储存量较小,联合用药受限等缺点,因此更适用于预计总生存期>3个月的难治性癌痛患者。
半植入式具有费用较低、药物储存量大、创伤较小等优点,但其感染风险较高,后期管理维护较麻烦等缺点,因此更适宜于预计总生存期较短的癌痛患者。全植入式鞘内输注系统和半植入式鞘内输注系统的比较如(表3)。
表3 全植入式鞘内输注系统和半植入式鞘内输注系统的比较
比较项目
全植入式鞘内输注系统
半植入式鞘内输注系统
植入部位
导管和药泵完全植入体内
导管植入体内,药泵则外置于体外
创伤性
导管和药泵完全植入体内,因此创伤性较
半植入术大
创伤性较小,仅需植入导管
调控方式
便捷性好,通过体外无线设备远程调控药
物输注参数
便捷性差,需手动调整体外泵参数或更换输注装置
费用和维护
费用较高,但维护频率低
费用较低,但维护频率高
对日常生活的影响
不影响日常活动
需随身携带体外药泵,日常活动受限
感染风险
因其装置完全植入体内,感染风险低
体外输注装置长期暴露易引发感染,感染风险较高
适合人群
预期总生存期较长(>3个月),需长期镇痛的癌症患者
预期总生存期较短(<3个月),经济受限或短期镇痛的患者
临床上常用鞘内药物包括阿片类药物如吗啡、芬太尼、舒芬太尼、氢吗啡酮;局麻药如布比卡因、罗哌卡因、丁卡因;α2受体激动剂如可乐定;钙通道阻滞剂如齐考诺肽;γ-氨基丁酸激动剂如巴氯芬等[13],鞘内药物的选择、联合用药、药物耐受性以及镇痛模式的设置是IDDS镇痛治疗的关键,是目前研究的重点和难点。
IDDS药物选择应以单一阿片类药物为主导,根据药物推荐表选择阶梯性用药,联合用药时应该根据临床评估结果和伦理学要求来综合判断。相比其他镇痛手段,IDDS具备以下优点:①镇痛药物直接作用于中枢神经,镇痛效果高效且稳定;②镇痛药物用量小,与口服药物相比,只需口服药量的1/300就能达到相同的疗效,同时减少了药物不良反应;③便捷性好,可调节性强,医师或患者可根据需要调整药物输注参数。
放射性粒子植入术
放射性粒子植入是将放射性粒子125I或103Pd通过影像学引导植入肿瘤病灶内,持续释放低剂量γ或X射线,对肿瘤细胞进行持续性杀伤,依据肿瘤的大小和形态调整剂量分布,使放射范围尽可能局限在肿瘤病灶内,粒子辐射杀伤范围为1.7cm,剂量随着距离的增加而衰减,能降低对周围正常组织的放射性损伤而最大限度保护周围组织或器官。粒子持续释放射线长达数周至数月,对局部癌痛控制率可达70-90%,当晚期肺癌伴骨转移时,放射性粒子植入术可持续杀伤转移性肿瘤病灶,缓解肿瘤压迫神经或组织引发的顽固性疼痛。
总结
综上所述,随着微创介入PCA、经皮椎体强化技术、经皮消融技术、脊髓电刺激、经皮神经毁损术、鞘内药物输注系统植入术以及放射性粒子植入术等技术的迅猛发展为晚期肺癌伴难治性疼痛患者提供了更多微创化止痛疗效显著的治疗手段,延长了患者总生存期,显著改善了患者的生活质量,但需要严格掌握各项技术的适应症、禁忌症和不良反应。与此同时,也面临诸多挑战,首先,如何个体化、精准化选择镇痛手段需临床医生根据患者的疼痛程度、肿瘤部位、经济情况以及自身意愿等来综合评估;其次,多模式镇痛模式或联合化疗、放疗、靶向治疗、免疫治疗等如何排兵布阵需多学科协作(MDT)制定;最后,如何克服或延缓镇痛药物耐药是临床研究和探索的难点。
参考文献:
[1] Papa L, Maguire L, Bender M, et al. Patient controlled analgesia for themanagement of acute pain in the emergency department: A systematic review[J]. Am J Emerg Med, 2022, 51: 228-238.
[2] Filippiadis DK, Tselikas L, Bazzocchi A, et al. Percutaneous Management of Cancer Pain[J]. Curr Oncol Rep, 2020, 22(5): 43.
[3] Cao DH, Gu WB, Zhao HY, et al. Advantages of unilateral percutaneous kyphoplasty for osteoporotic vertebral compression fractures-a systematic review and meta-analysis[J]. Arch Osteoporos, 2024, 19(1): 38.
[4] Zhao Q, Wang J, Fu YL, et al. Radiofrequency ablation for stage<iib non-small <="" div="">cell lung cancer: Opportunities, challenges, and the road ahead[J]. Thorac Cancer, 2023, 14(32): 3181-3190.
[5] Liu X, Zhan Y, Wang H, et al. Radiofrequency ablation versus microwave ablation for lung cancer/lung metastases: a meta-analysis[J]. ANZ J Surg, 2025, 95(1-2): 56-65.
[6] Cazzato RL, de Rubeis G, de Marini P, et al. Percutaneous microwave ablation of bone tumors: a systematic review[J]. Eur Radiol, 2021, 31(5): 3530-3541.
[7] Velez A, DeMaio A, Sterman D. Cryoablation and immunity in non-small cell lung cancer: a new era of cryo-immunotherapy[J]. Front Immunol, 2023, 14: 1203539.
[8] Kwak K, Yu B, Lewandowski RJ, Kim DH. Recent progress in cryoablation cancer therapy and nanoparticles mediated cryoablation[J]. Theranostics, 2022, 12(5): 2175-2204.
[9] Bachu VS, Kedda J, Suk I, Green JJ, Tyler B. High-Intensity Focused Ultrasound: A Review of Mechanisms and Clinical Applications[J]. Ann Biomed Eng, 2021, 49(9): 1975-1991.
[10] Hagedorn JM, Pittelkow TP, Hunt CL, et al. Current Perspectives on Spinal Cord Stimulation for the Treatment of Cancer Pain[J]. J Pain Res, 2020, 13: 3295-3305.
[11] Sheldon BL, Bao J, Khazen O, et al. Spinal Cord Stimulation as Treatment for Cancer and Chemotherapy-Induced Pain[J]. Front Pain Res (Lausanne), 2021, 2: 699993.
[12] Ontario Health. Intrathecal Drug Delivery Systems for Cancer Pain: A Health Technology Assessment
猜你喜欢
- 潮州市中心医院无影灯吊桥吊塔更正公告(第一次)
- 春季养生吃什么好 七种食物不可少
- 震撼!医院开始严管西医中成药处方!骨科医生吐槽:没培训2年,不给处方权!连膏药都不能开!降低中成药不合理处方率对医患都好
- 中年男性如何维持自己的性能力
- 山东师范大学唐波/李平JACS:开发了一种双色/双可逆荧光探针成像揭示超氧阴离子和ATP在肝脏缺血再灌注损伤中的关键作用
- 影像诊断 | 肩部疼痛勿忘——冈盂切迹囊肿继发肩胛上神经卡压
- 鸡肉不适合和哪些食物同时一起吃
- Shoulder Elbow:锁骨“中轴”骨折的精确位置研究
- Chin Med:泽泻饮方通过FXR/FGF15途径调节SBAs水平,恢复肠屏障完整性,缓解动脉粥样硬化
- 卸妆后如何护肤 卸妆后应该如何保养皮肤
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)