首页 > 医疗资讯/ 正文
如今在健康圈红得发紫的“顶流”,非各类益生菌莫属。从调节肠道菌群、增强免疫力,到辅助减肥,几乎个个都自带“光辉履历”,被誉为人体微生态的“幕后英雄”。特别是在“吃点益生菌”逐渐成为养生新日常的当下,它们的风头更是一时无两。
不过,真相往往比宣传更复杂。“菌无完菌”,别看它们平时一副“乖顺听话”的模样,在特定条件下,它们也可能“翻脸不认人”,甚至走上“叛变”的不归路。
最近,一项由清华大学研究团队主导、发表在Nature Microbiology上的研究[1],就对其中一位“明星菌”Akkermansia muciniphila(嗜黏蛋白阿克曼菌,简称Akk)来了个“人设大反转”。素以“益生菌”美名著称的Akk菌竟也有“黑化”潜质:在特定情况下,暗中帮肠道里的病原体“进化升级”。

Akk菌,何方菌也?
顾名思义,这位“嗜黏蛋白阿克曼菌”最拿手的,就是“啃”肠道黏液层里的黏蛋白谋生,因此得名。别看它吃得奇特,它可不是来“拆家”的,反而是个勤勤恳恳的“肠道维修工”——一边啃着黏液维持生计,一边刺激肠道自我修复,促进黏液分泌,产出丁酸等短链脂肪酸,为肠道细胞“充电打气”。
更妙的是,Akk菌还能筑起一道坚固的“肠道防线”,防止内毒素入血,守住身体的第一道屏障。不仅如此,它还能“插手”能量代谢,帮助身体更高效地燃烧热量。而在免疫系统这块,Akk菌同样身怀绝技。它能与免疫细胞“对话”,调节炎症反应,维持免疫系统的平衡。
然而,谁能想到,这样一位“吃黏液、修肠道、调免疫、管代谢”的多面手,在某些特定条件下竟也可能反水助攻病原体,让肠道感染雪上加霜。
线索起点:
免疫系统的一个“漏洞”
在探索肠道免疫防御机制时,研究团队将目光锁定在一类“驻守前线”的免疫卫士——第三型先天淋巴样细胞(ILC3s)。这类细胞常年驻扎在肠道黏膜里,被认为能调节肠道菌群、维持微生态平衡,同时也在抵抗外来入侵者方面发挥关键作用。
其实,既往已有研究发现,ILC3s可以通过依赖微生物群的方式,控制啮齿类柠檬酸杆菌(Citrobacter rodentium)在肠道中的定植,而这种细菌,恰好是人类两种致病性大肠杆菌(EPEC和EHEC)的“近亲”。不过,ILC3s是如何具体调控菌群和代谢物的?其中有没有关键“桥梁”?这些问题一直没有明确答案。
我们知道,健康状态下的肠道,是免疫系统与共生菌群紧密协作的产物。它们如同一对默契搭档,一方面维持日常秩序,另一方面也具备“定植抗性”——能有效防范有害细菌的入侵和扩张。但这一合作到底如何落地执行,一直是个谜。

这说明,ILC3s在正常情况下确实扮演着“免疫防线指挥官”的角色。
那问题来了——ILC3s一缺失,会不会有“原住民”趁虚而入、搅局添乱?

这个结论一出,不少人都懵了。要知道,Akk菌素有“好菌”的美名,怎么可能会在关键时刻反水、帮着致病菌作乱?
于是,研究者决定深挖到底。

这下,Akk菌“助纣为虐”的嫌疑更大了。但研究者并未止步于此。他们进一步推测:会不会是原本小鼠肠道里的复杂菌群影响了实验结果?
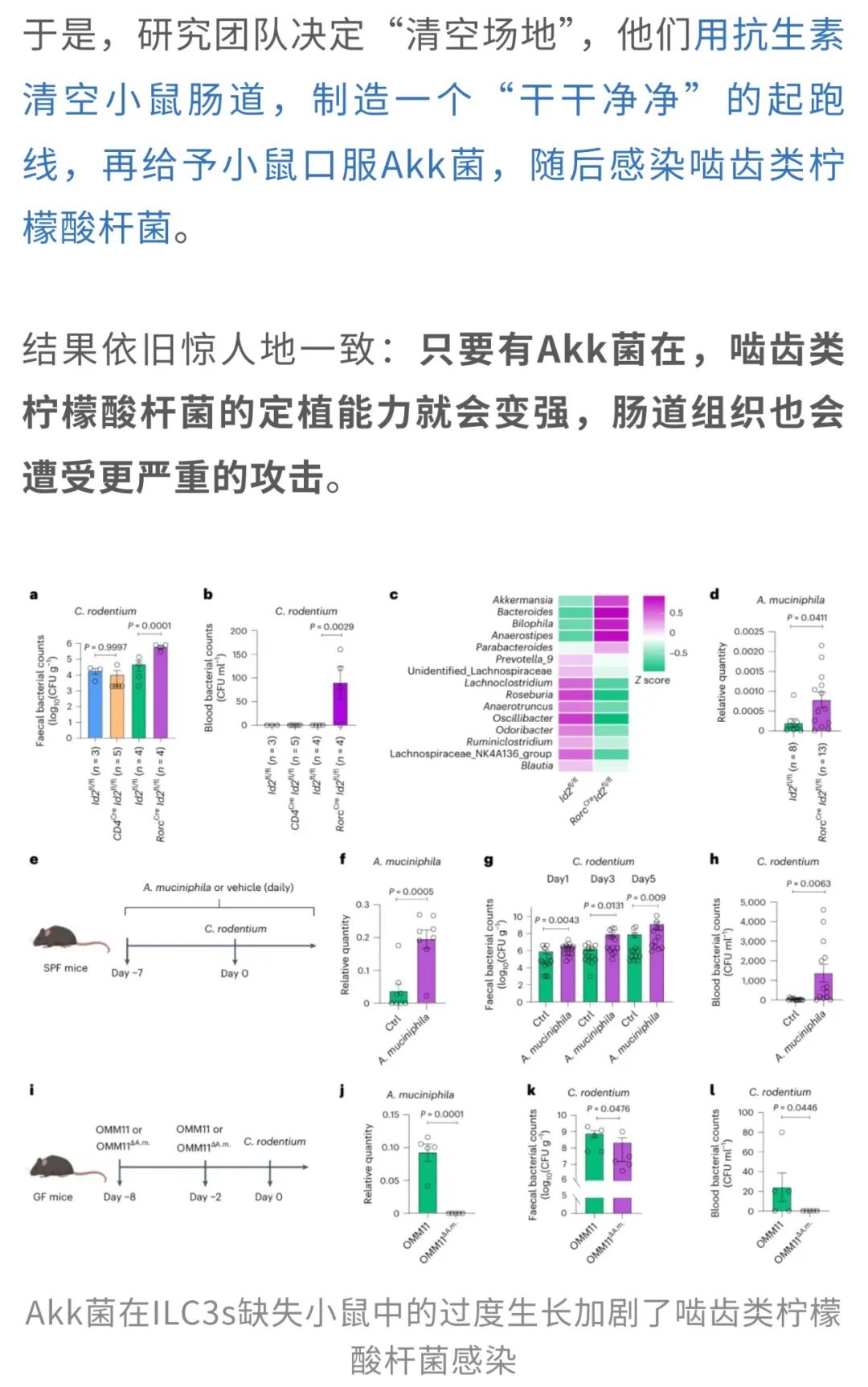
这也意味着,Akk菌确实能从“益生明星”变身为“幕后推手”,为致病菌的扩张大开绿灯。
危险反转:
Akk菌如何“助纣为虐”
令人意外的是,Akk菌的过度增殖不仅让它自己变多了,还“偷偷”给肠道中的病原体提供了“助力”。
为了更形象地理解这一过程,不妨把肠道比作一座城市,而ILC3s则是这座城市的24小时巡逻特种兵。它们没有枪炮,但却能分泌强大的武器——白细胞介素22(IL-22)。这种细胞因子能指挥肠道上皮细胞在黏液层上“镀上一层膜”,通过增加岩藻糖基化,构建起一道光滑的屏障,把“坏菌”拒之门外,保护肠道的健康。
然而,ILC3s的能力并不止于此,它们还掌握着调控半乳糖基化的特殊技能。从机制上来说,ILC3s通过分泌IL-22,减少了肠道细胞的半乳糖基化水平,从而限制了Akk菌的增殖,因为这种糖基化减少了它们赖以生存的碳源和能量来源。
在ILC3s缺失的情况下,肠道上皮细胞表面异常升高的半乳糖基化水平成了Akk菌“肆意生长”的关键。这时,Akk菌就像拿到了“万能饭卡”,它开始疯狂吞噬黏液中的半乳糖,进而开始大量分泌琥珀酸。琥珀酸也是一种短链脂肪酸,正常情况下对肠道菌群有调节作用,但一旦过量,它就会改变肠道的微环境,给本应保持低调的“坏菌”——比如啮齿类柠檬酸杆菌创造有利条件,提升其致病性。
琥珀酸还能促进啮齿类柠檬酸杆菌的致病基因表达,特别是两个重要的毒力因子——Tir和Ler。Tir帮助细菌黏附到肠道上,而Ler则是调控致病岛基因表达的“指挥官”。这两个因子的上调使得病原体更容易在肠道定植,从而提高了感染的风险。
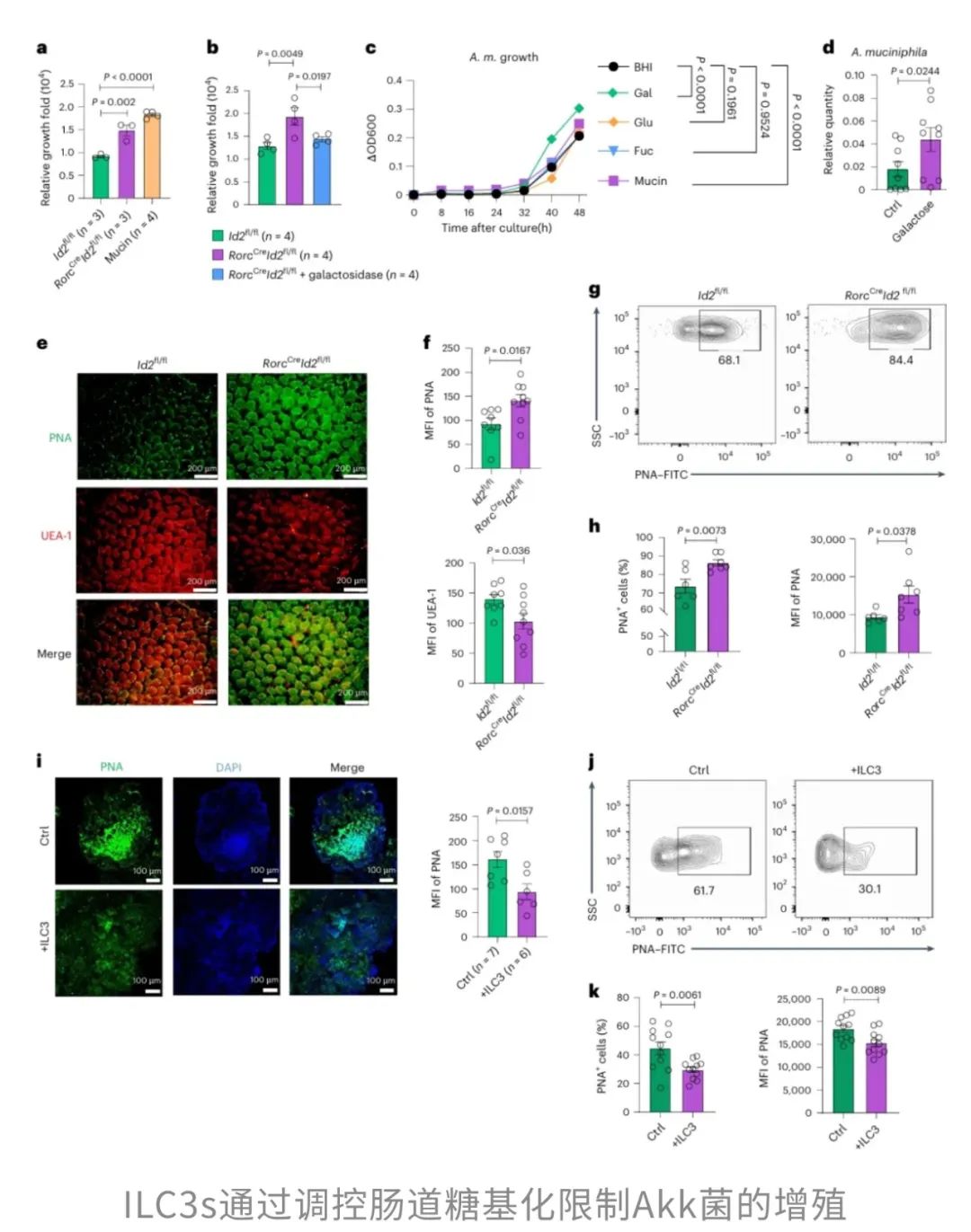
也就是说,在ILC3s缺失的情况下,原本该“守护”肠道健康的Akk菌,反而成了“帮凶”,在“无意间”的协助下让病原体的毒性增强,导致感染更容易发生,甚至更加严重。
总的来说,这项研究首次明确揭示了宿主免疫细胞(ILC3s)通过调节肠道上皮细胞的糖基化水平,维持肠道内有益菌群的平衡。在ILC3s缺失的情况下,Akk菌这种通常被认为是肠道健康守护者的菌群,反而成为了病原体的“帮凶”,间接帮助它们增加毒性和致病性。
乳杆菌成肿瘤“帮凶”
如果说Akk菌的“叛变”揭示了益生菌在宿主免疫失衡时的潜在风险,那么另一种在日常生活中被广泛推崇的益生菌——乳杆菌的“黑化”则更令人深思。作为酸奶等发酵食品中频繁添加的“明星菌种”,乳杆菌长期以“肠道健康卫士”的形象深入人心。
然而,一项由加拿大多伦多大学团队领衔,发表于Immunity的研究[2]却撕开了这层光鲜的面纱——这类益生菌竟会通过代谢膳食中的色氨酸产生“黑化物质”(吲哚),激活肿瘤相关巨噬细胞(TAM)中的芳香烃受体(AhR),让免疫系统在胰腺导管腺癌(PDAC)面前“集体躺平”。
这一发现不仅颠覆了传统认知,更提醒我们——即便是酸奶瓶身上那些熟悉的“益生菌”标签,也可能在特定条件下隐藏着令人意想不到的生物学“双刃剑”效应。

在PDAC这个出了名的“硬茬”面前,研究人员换了个角度,从肿瘤“周边势力”——TAM身上下手。他们通过RNA测序联合多组学的基因富集分析发现,TAM并不是“无辜路人”,反而呈现出显著的促肿瘤特性。
其中,AhR活性的明显增强尤为引人关注。作为一种关键的免疫调节因子,AhR能够通过调控下游基因表达,让本该“上阵杀敌”的免疫系统“自废武功”, 进而为肿瘤的生长和免疫逃逸提供有利环境。

这也意味着,AhR是肿瘤的“保护伞”,特异性敲除后,肿瘤“原形毕露”。
不过话说回来,AhR本身并不是肿瘤细胞的“自带装备”,那它是怎么被激活的呢?这时,研究的焦点转向了肠道里的“另一个势力”——乳杆菌。这些平时看起来挺“乖”的菌,在某些情况下,居然也会“黑化”。
原来,乳杆菌能把膳食中色氨酸这种营养成分代谢成一类叫吲哚类化合物的物质,比如吲哚乙酸、吲哚乳酸。而这些物质恰恰是AhR最喜欢的“激活剂”。于是,乳杆菌间接给了AhR一把钥匙,让它在TAM里兴风作浪,进一步抑制免疫、推动肿瘤生长。
那要是把乳杆菌“噤声”会怎样?

至此,这条“乳杆菌—吲哚—AhR”的传话链条,终于被揪了出来。
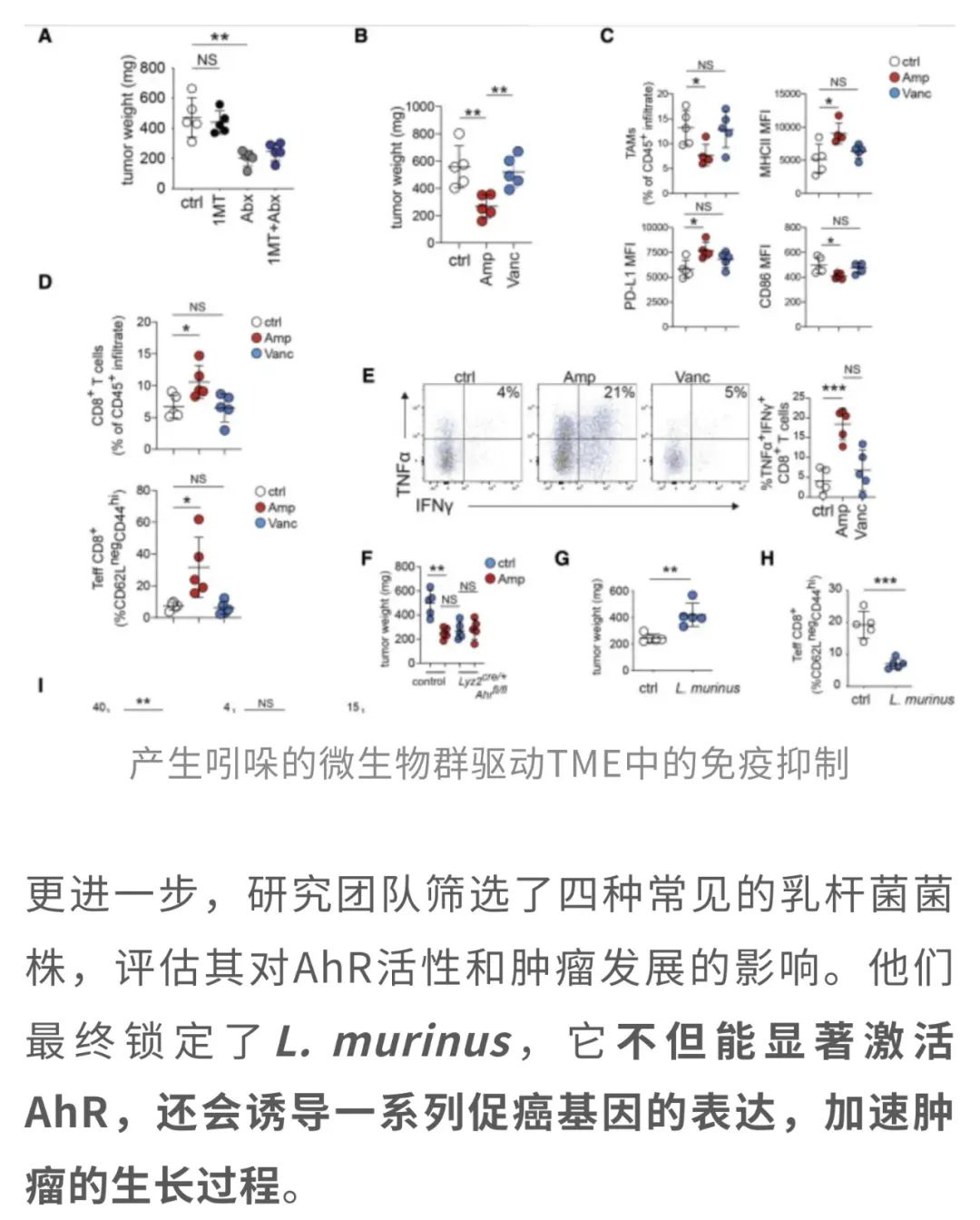
总的来说,这项研究表明,TAM的AhR活性主要依赖于吲哚,而乳杆菌能将膳食中的色氨酸代谢为吲哚。比如,常见的乳杆菌L. murinus不仅会促进肿瘤生长和抑制肿瘤免疫,甚至还会增加一系列促癌基因的表达。
看来,益生菌只是肠道这个复杂生态系统中的小角色,而不是“救世主”。千万别被广告里的“神奇功效”冲昏了头,盲目跟风补充。它们的作用从来不是万能的,也许能在特定场景下帮上忙,但指望它们长期“扛把子”就有点不现实了。
仍需指出的是,研究[1]主要集中在单一病原体和单一菌种的相互作用,未能全面揭示肠道微生物群复杂生态中其他菌种的潜在作用;研究[2]未能充分解释微生物组与色氨酸代谢在不同个体中的多样性如何影响AhR功能。且两项研究主要依赖小鼠模型,其结果在人类疾病中的普适性仍需进一步验证。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)