首页 > 医疗资讯/ 正文
在肿瘤免疫治疗领域,如何有效激活细胞免疫应答始终是科学家们攻坚的关键难题。肿瘤疫苗因其独特的优势备受瞩目——它不仅能精准识别癌细胞,产生持久的免疫记忆,还能最大程度减少对正常细胞的伤害。然而,肿瘤疫苗的开发却面临三座大山:抗原本身免疫原性不足、递送效率低下以及免疫抑制的肿瘤微环境。传统铝佐剂(Alum)虽能诱导抗体反应,却对T细胞应答无能为力,还常引发局部疼痛;而新一代的佐剂因配方复杂、成本高昂及潜在毒性等不足,临床应用受限。肿瘤疫苗面临的这些挑战亟需破局之道。
沈阳药科大学王永军教授团队发表于《Biomaterials》的最新研究,通过创新设计锰掺杂层状双氢氧化物(MLDHs)纳米平台,为这一困境提供了突破性解决方案。OVA/MLDHs能够精确靶向淋巴结,被树突状细胞高效摄取和交叉呈递,激活细胞免疫响应,同时中和肿瘤微环境酸性并促进巨噬细胞M1极化。

【文章要点】
通过水热法合成出两种锰掺杂的自佐剂纳米材料—Mn-MgAl-LDH(MLMA)和Mn-MgFe-LDH(MLMF),其粒径控制在100 nm左右,表面显正电性。纳米颗粒在皮下注射后能高效富集于淋巴结,被树突细胞摄取,在胞内通过“质子海绵效应”爆破内涵体,将Mn²⁺和抗原释放到胞浆,激活STING通路并通过MHC I类交叉呈递抗原。实验数据显示,MLMF处理组的H-2Kb-SIINFEKL复合物表达量达到游离抗原的2.5倍,共刺激因子C80和CD86的表达也显著上调。
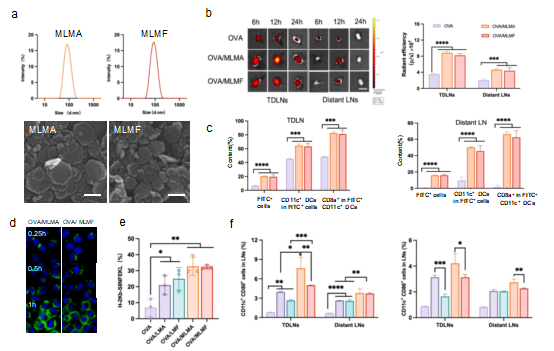
图1 自佐剂纳米系统靶向淋巴结
金属离子的精准配伍赋予了这一平台独特的免疫调控能力。研究发现,含铁的MLMF能强力驱动Th1型免疫应答,使肿瘤中CD8⁺T细胞浸润增加2.5倍,并促进M1型巨噬细胞极化;而含铝的MLMA则更倾向于诱导Th2反应,产生高滴度IgG1抗体。这种"金属离子精准编程"特性为个性化肿瘤疫苗设计提供了全新思路。在B16F10-OVA黑色素瘤模型中,显著抑制肿瘤生长并延长小鼠生存期。
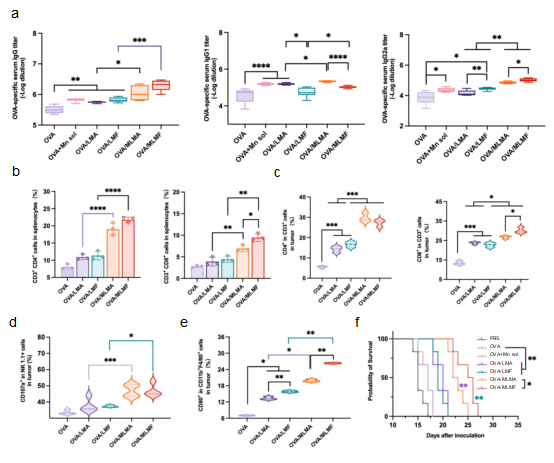
图2OVA/MLDHs激活抗肿瘤免疫响应
研究进一步将MLMF与血管破坏剂DMXAA联用,展现出惊人的协同效应。装载DMXAA的纳米颗粒在肿瘤核心区引发"血管风暴",通过上调TNF-α和IL-6等炎性因子,导致肿瘤血管网络崩溃。病理切片显示,联合治疗组肿瘤细胞凋亡面积达到单药组的3倍,最终实现97%的原位肿瘤抑制率。这种"免疫激活+血管破坏"的双轨策略,为肿瘤疫苗联合疗法提供了新范式,临床转化前景令人期待。
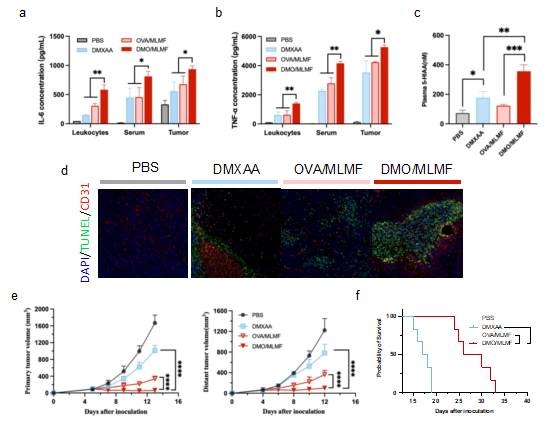
图3 OVA/MLDHs平台联合DMXAA用于肿瘤治疗
MLDHs采用绿色水热法制备,每克成本不足百元,且动物实验显示其安全性良好——主要脏器无蓄积,肝功能指标完全正常。
【展望】
随着对金属离子免疫调控机制的深入理解,科学家们正开启纳米材料"智能"激活免疫系统的新篇章。该项研究不仅为肿瘤疫苗开发面临的“三座大山”提供解决方案,更开创了通过无机材料化学组成精确调控免疫反应的新方向。这种模块化设计的纳米平台不仅适用于肿瘤疫苗,还可拓展至传染病防控领域,有望成为下一代疫苗的通用平台。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)