首页 > 医疗资讯/ 正文
1 目前针对EGFR罕见突变的治疗选择有限,且耐药问题突出。
2 第三代TKI(如奥希替尼、阿美替尼、贝福替尼等)的出现为EGFR罕见突变治疗带来了新的希望。
1 赛美纳的研发充分考虑了EGFR罕见突变的异质性,能够根据不同的突变类型提供精准的治疗方案。
编者按:近年来,非小细胞肺癌(NSCLC)的治疗取得了显著进展,尤其是针对EGFR突变的酪氨酸激酶抑制剂(TKI)的广泛应用。然而,EGFR罕见突变(如G719X、L861Q、S7681、E709K等)的治疗仍然是一个未被完全攻克的难题。尽管第三代TKI的出现为罕见突变患者带来了新的希望,但这些药物是否能真正突破罕见突变的治疗瓶颈?它们是否能克服耐药性,为患者带来持久的疗效?这些问题亟待解答。
非小细胞肺癌(NSCLC)患者存在表皮生长因子受体(EGFR)突变,最常见的EGFR突变是Exon19 del和Exon21的L858R点突变。2022年3月,德国国家基因组医学网络(nNGM)发表了一项多中心回顾性研究,依据酪氨酸激酶抑制剂(TKI)、化疗和免疫检查点抑制剂(ICI)的治疗效果对非典型EGFR突变进行分类,其中G719X、S7681、L861Q及其复合突变被归类为非典型EGFR罕见突变。众所周知,EGFR的激活突变是TKIs的治疗靶点,目前TKIs是激活EGFR突变的局部晚期或转移性NSCLC患者的标准一线治疗。对于EGFR罕见突变,治疗选择上却十分有限。
EGFR罕见突变治疗现状与挑战
相关肺腺癌研究表明,约四分之一以上的NSCLC中存在复合突变,且复合突变与患者不良预后相关。EGFR罕见突变在肺腺癌患者中的发生率约为15%,虽然占比相对较低,但由于患者群体庞大,罕见突变患者的绝对数量仍不可忽视。
在2024年世界肺癌大会(WCLC)上,一项关于新型第三代酪氨酸激酶抑制剂(TKI)对EGFR罕见突变疗效的体外研究引起了广泛关注,为携带EGFR罕见突变的非小细胞肺癌(NSCLC)患者的治疗提供了新的思路和希望,也指出了这些罕见突变的治疗现状所面临的诸多挑战。

治疗选择有限
目前的临床指南推荐阿法替尼或奥希替尼用于EGFR罕见突变患者,但这些药物的疗效有限。例如,阿法替尼虽然对多种罕见突变表现出一定的抑制能力,但对某些突变(如S768I、E709K)的敏感性较低。奥希替尼虽然对L861Q突变有效,但对S768I和E709K突变的效果不佳。
耐药问题突出
罕见突变患者在治疗过程中容易出现继发性耐药突变(如T790M、T725M等),进一步限制了治疗选择。Hana Oiki团队的研究发现,在G719A突变的Ba/F3细胞中,阿法替尼治疗后可能出现T790M或T725M突变,这些耐药突变对现有药物的敏感性较差。

IC50值(半数抑制浓度)汇总
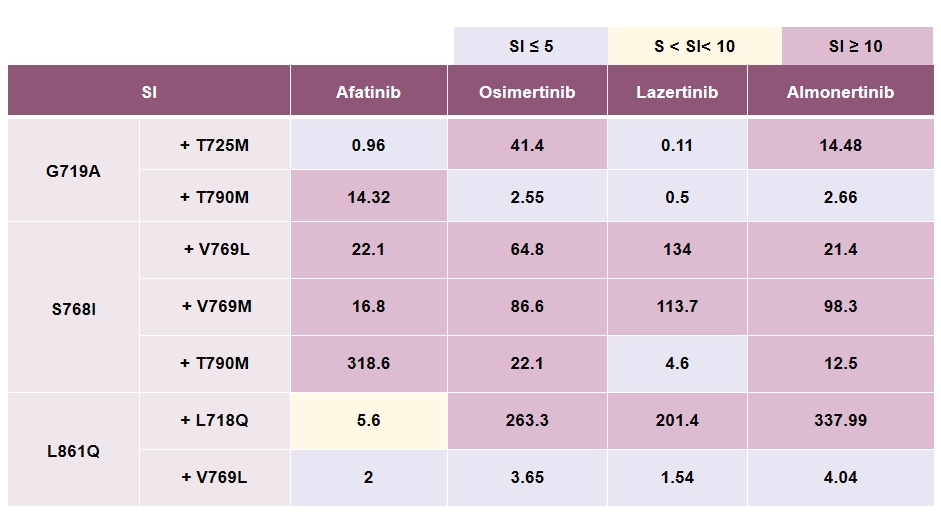
敏感性指数(SI)
个体化治疗需求高
罕见突变的异质性较高,不同突变对药物的敏感性差异较大,需要更精准的个体化治疗方案。然而,目前的治疗策略仍难以满足这一需求。
缺乏针对性药物
目前大多数EGFR-TKI的研发集中在常见突变(如L858R、19号外显子缺失)上,罕见突变的药物研发相对滞后。这导致罕见突变患者在治疗选择上面临更多限制。
第三代TKI的突破与局限
尽管罕见靶点的治疗现状面临诸多挑战,但随着精准医疗的发展和新型药物的不断涌现,罕见靶点治疗领域正迎来新的突破。第三代TKI(如奥希替尼、阿美替尼、贝福替尼等)的出现为罕见突变治疗带来了新的希望。这些药物不仅对常见突变(如L858R、19号外显子缺失)表现出高效抑制能力,还在一些罕见突变中展现出良好的活性。
在Hana Oiki团队的研究中,通过测量IC50值(半数抑制浓度)和敏感性指数(SI)来评估不同TKI的抑制活性。结果显示,阿法替尼对所有测试的EGFR罕见突变的敏感性指数(SI)均较低(≤5),表现出较强的抑制作用。虽然三代TKIs对SI≤5的L861Q有活性,但对S768I和E709K突变效果不佳。
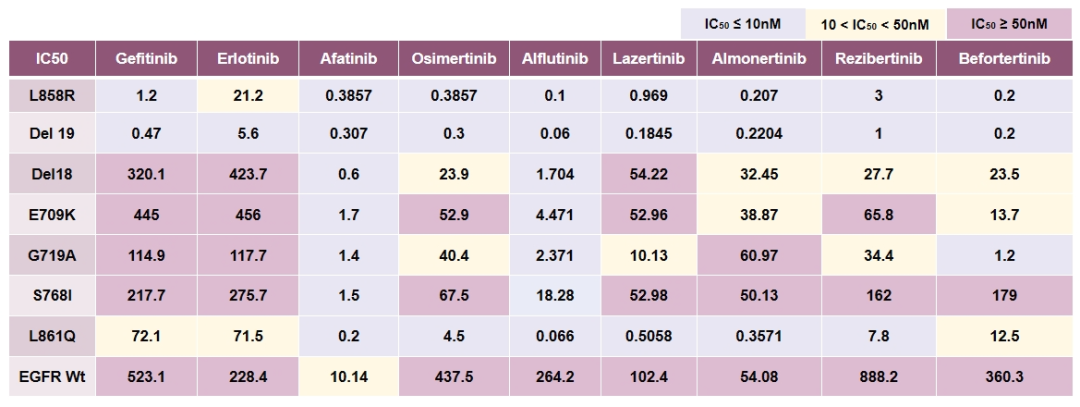
IC50值(半数抑制浓度)汇总

敏感性指数(SI)
然而,第三代TKI在罕见突变治疗中仍面临一些挑战。T790M是EGFR-TKI耐药的常见机制之一,Hana Oiki团队的研究中发现T725M是一种新发现的耐药突变。虽然奥希替尼对L861Q突变有效,但对S768I和E709K突变的效果不佳。此外,一些继发性耐药突变(如V769L/M)对所有现有EGFR-TKI均表现出耐药性,这进一步限制了第三代TKI的应用。
尽管如此,在研究中可看出,赛美纳显示出对G719A、L861Q等罕见突变的广泛活性,尤其是在耐药突变(如T790M)中的表现尤为突出。赛美纳在T790M突变的耐药细胞中表现出良好的活性,其对T790M的抑制能力与奥希替尼相当,但对继发性耐药突变(如T725M)的活性更为突出。
这一发现表明,赛美纳可能具有克服多种耐药机制的潜力。例如,在G719A突变的Ba/F3细胞中,研究发现继发性T725M突变会导致对奥希替尼的耐药,而赛美纳则显示出对该突变的显著抑制能力。这种特性可能与其独特的分子结构有关,使其能够更有效地结合到EGFR的活性位点,从而克服耐药突变带来的空间位阻。
此外,赛美纳在其他罕见突变(如E709K、S768I)的细胞模型中也表现出良好的活性,这进一步证明了其作为一种新型第三代TKI的潜在优势。与阿法替尼和奥希替尼相比,赛美纳不仅对罕见突变具有广泛的抑制作用,还能有效应对继发性耐药突变,这可能使其成为治疗EGFR罕见突变NSCLC患者的一个有前景的治疗选择。
第三代TKI在罕见突变治疗中的潜力与挑战
随着精准医疗的发展,EGFR罕见突变的治疗正迎来新的机遇。第三代TKI(包括赛美纳)的出现为罕见突变患者带来了新的希望,但这些药物是否能真正突破罕见突变的治疗瓶颈,仍需进一步验证。
当然,在EGFR罕见突变治疗领域,赛美纳(Seemila)作为一种新型第三代TKI,正在展现出独特的潜力。赛美纳凭借其优化的分子结构和广泛的活性谱,为罕见突变患者带来了新的希望。
高效抑制罕见突变
赛美纳在临床前研究中展现出对多种EGFR罕见突变(如G719A、L861Q、S768I等)的强大抑制能力。除了在Hana Oiki团队的研究里对对罕见突变展现的高抑制效率外,浙江大学医学院附属第二医院赵百亲教授携其团队曾报道过一例局部晚期、携带罕见复合EGFR p.G719X/p.S768I突变的不可切除NSCLC患者病例,赵教授选择赛美纳作为治疗药物,发现相比其他EGFR突变药物,赛美纳在治疗EGFR G719X联合S768I突变的NSCLC患者中取得了显著突破,且无严重不良事件。

克服耐药突变
赛美纳不仅对罕见突变有效,还能克服继发性耐药突变。研究发现,赛美纳对T790M和T725M等耐药突变表现出良好的活性,这为罕见突变患者在耐药后的治疗提供了新的选择。
广泛的活性谱与良好的安全性
赛美纳的活性谱较广,能够覆盖多种罕见突变类型。其敏感性指数(SI)较低,表明在治疗罕见突变时所需的药物浓度更低,副作用更小。此外,赛美纳在临床试验中显示出较低的副作用发生率,尤其是在心血管安全性和肝毒性方面,这使其更适合长期使用。
精准治疗的潜力
赛美纳的研发充分考虑了罕见突变的异质性,能够根据不同的突变类型提供精准的治疗方案。例如,赛美纳对G719A和L861Q突变的抑制能力显著优于其他TKI,这使得医生可以根据患者的基因检测结果,选择最适合的药物。
未来需要扩大临床研究范围,进一步验证其在罕见突变患者中的疗效和安全性。同时,探索联合治疗方案,以及积极拓展国际市场,为全球罕见突变患者提供新的治疗选择,也是赛美纳未来发展的重要方向。
总结
EGFR罕见突变的治疗仍然是肺癌精准医疗中的一个挑战。第三代TKI(包括赛美纳)的出现为罕见突变患者带来了新的希望,但这些药物是否能真正突破罕见突变的治疗瓶颈,仍需更多的临床数据支持。赛美纳凭借其高效抑制罕见突变、克服耐药突变以及良好的安全性,正在展现出巨大的潜力。未来,随着精准医疗的进一步发展和联合治疗方案的探索,第三代TKI有望为罕见突变患者带来更持久的疗效和更好的生活质量。
参考文献:
[1] 冯英,谭力铭.TKIs治疗非小细胞肺癌中罕见EGFR突变的研究进展[J].巴楚医学,2023,6(3):1 24 128.
[2] Oiki H, Suda K, Hamada A, et al. P3. 03I. 08 Efficacy of Novel Third-Generation Tyrosine Kinase Inhibitors for Uncommon EGFR Mutations-Anin Vitrostudy[J]. Journal of Thoracic Oncology, 2024, 19(10): S312.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)