首页 > 医疗资讯/ 正文
金属作为参与线粒体代谢重编程的许多金属酶的辅因子。金属体内平衡的改变与表观遗传机制有关。然而,金属影响心脏纤维化(CF)的表观遗传机制仍然知之甚少。
2025年3月6日,安徽医科大学第二附属医院/上海交通大学医学院附属新华医院的陶辉教授、赵健元教授、张野合作在European Heart Journal在线发表题为“SLC31A1 loss depletes mitochondrial copper and promotes cardiac fibrosis”的研究论文。该研究表明SLC31A1缺失耗尽线粒体铜并促进心脏纤维化。
较低的铜浓度伴随着CF中SLC31A1下调和线粒体铜耗竭。成纤维细胞特异性SLC31A1缺陷增强线粒体铜消耗,增强糖酵解,促进成纤维细胞增殖并触发CF。SLC31A1抑制是由于SLC31A1启动子区MeCP2识别的甲基化CpG岛增加,抑制其转录。相反,MeCP2敲除拯救了SLC31A1表达,产生了矛盾的效果。MeCP2上调与m6A mRNA水平升高相关。从机理上讲,YTHDF1识别靶MeCP2 mRNA并诱导其翻译。在房颤患者的人类心脏组织中,观察到铜浓度和SLC31A1表达降低,以及YTHDF1和MeCP2水平升高。这些变化与线粒体铜耗竭、糖酵解增强和CF相关。一种新的表观遗传机制被证实,通过这种机制,铜缺乏增加线粒体铜耗竭并损害CF。这一发现为CF预防措施的发展提供了新的见解。

心脏纤维化(CF)的特征是心脏成纤维细胞的增殖和迁移以及随后的胶原沉积,由许多心血管变化引起。例如,房颤、心力衰竭和心肌梗死伴随着肌细胞器的损伤,如线粒体、质膜、收缩装置和肌浆网,共同导致收缩和舒张功能受损,并经常发展为明显的终末期心脏病。然而,这些缺陷背后的分子机制仍然未知。尽管CF在全球的患病率不断增加,但6种经批准的可诱导CF持久缓解的疗法仍然很少,这强调了确定CF的关键驱动因素和治疗靶点的迫切需要。
铜是一种重要的膳食微量元素,可作为参与关键细胞过程(包括线粒体功能、氧化还原平衡和铁代谢)的蛋白质的结构和酶辅因子。细胞内铜稳态失调可能有害,并导致各种疾病,包括糖尿病性心肌病。重要的是,铜诱导的效应与呼吸酶复合物的破坏有关,这导致质子泄漏,损害线粒体呼吸链传输。有趣的是,铜匮乏的癌细胞可能依赖糖酵解产生能量。同样,铜缺乏的癌细胞依赖糖酵解进行增殖。线粒体中的铜缺乏将细胞代谢从细胞呼吸转变为糖酵解。与肿瘤细胞类似,成纤维细胞具有异常的糖酵解和增殖特征。因此,铜诱导的线粒体毒性影响糖酵解,并确定成纤维细胞增殖;然而,潜在的机制需要进一步研究。
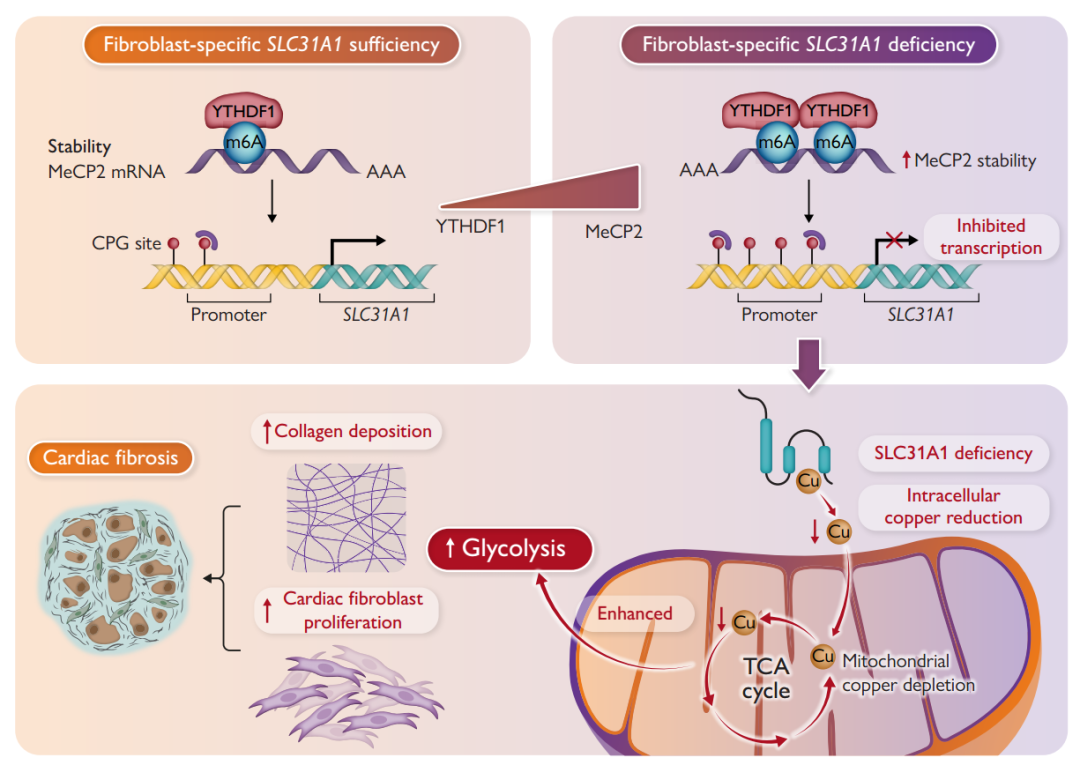
机理模式图(图源自European Heart Journal )
跨膜铜转运蛋白SLC31A1和SLC31A2是主要的铜转运蛋白。此外,细胞内铜离子可以通过抗氧化剂1伴侣蛋白(ATOX1)21转运到高尔基体进行排泄,或通过细胞色素c氧化酶铜伴侣(COX17)带入线粒体,参与细胞代谢、能量产生和氧转运。铜转运蛋白在线粒体铜代谢中非常重要。有趣的是,铜转运蛋白的失调与表观遗传机制有关,包括甲基化和组蛋白修饰。铜稳态失调与特定基因启动子甲基化和表观遗传修饰密切相关。这项研究调查了一个表观遗传机制是否参与铜稳态调节线粒体铜消耗和糖酵解。
该研究探索了在实验性CF和房颤患者中,细胞内铜缺乏伴随着SLC31A1下调和线粒体铜耗竭。该研究全面证明了限制细胞内铜缺乏通过SLC31A1表观遗传去抑制改善了实验性CF。因此,线粒体铜缺乏触发糖酵解、心脏成纤维细胞增殖和CF的增加。此外,该研究引入了YTHDF1和MeCP2作为SLC31A1表达负调节因子的新表观遗传机制,并确定细胞内铜缺乏促进线粒体铜缺乏并促进CF。这些发现明确了线粒体铜耗竭增强糖酵解在小鼠心脏成纤维细胞增殖和CF促进中的作用机制。这项研究首次表明,MeCP2识别YTHDF1通过增加SLC31A1启动子甲基化来促进线粒体铜耗竭和CF。总的来说,这项研究更好地理解了铜缺乏和CF的表观遗传调控在小鼠和人类中的作用。
参考消息:
https://doi.org/10.1093/eurheartj/ehaf130
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)