首页 > 医疗资讯/ 正文
如何防止癌细胞转移还有待探索
尽管原发性癌症治疗取得了进展,但由于弥漫性微转移的最终生长,许多早期癌症患者在数月至数年后发生转移性复发。转移是指癌细胞从原发肿瘤向远处器官的扩散,是全球90%的癌症死亡的原因。转移性癌细胞特别容易受到免疫攻击,因为它们最初丧失了在已形成的肿瘤中发现的免疫抑制微环境。在治疗上利用这种免疫脆弱性,有望防止复发的早期癌症患者的转移风险。
阿司匹林解除TXA2对T细胞的限制作用
在这项研究中,剑桥大学Rahul Roychoudhuri课题组发现环氧化酶1 (COX-1)抑制剂,包括阿司匹林,通过释放受血小板源性血栓素A2 (TXA2)抑制的T细胞,增强对癌症转移的免疫力。TXA2作用于T细胞,触发依赖于鸟嘌呤交换因子ARHGEF1的免疫抑制途径,抑制T细胞受体驱动的激酶信号传导、增殖和效应功能。在小鼠中,T细胞特异性条件缺失ARHGEF1会增加转移部位T细胞的激活,引发肺和肝转移的免疫介导排斥反应。因此,使用阿司匹林、选择性COX-1抑制剂或血小板特异性删除COX-1能够增强体内T细胞固有的ARHGEF1表达和TXA2信号传导并降低转移率。这些发现揭示了一种新的免疫抑制途径,限制了T细胞对癌症转移的免疫,为阿司匹林的抗转移活性提供了机制见解,并为更有效的抗转移免疫疗法铺平了道路。相关工作以“Aspirin prevents metastasis by limiting platelet TXA2 suppression of T cell immunity”为题发表在Nature。

【文章要点】
一、ARHGEF1抑制T细胞免疫转移
作者在之前的大规模体内遗传筛选中,鉴定到ARHGEF1基因敲除可以降低小鼠体内肺转移的发生。在小鼠模型中,ARHGEF1缺失可以降低多种肿瘤细胞(B16黑色素瘤、LL/2肺癌、B16肝转移)在体内形成转移灶的能力,但对原发肿瘤生长无显著影响。通过骨髓移植实验证实,ARHGEF1在造血细胞中的缺失足以导致上述抗转移表型。进一步分析发现,ARHGEF1缺失小鼠肺部转移灶中免疫相关基因(Ccl4、Nkg7、Gzma、Gzmb等)的表达上调,提示ARHGEF1可能在造血细胞中发挥免疫抑制作用。作者使用条件性基因敲除小鼠系统发现,ARHGEF1在T细胞中的缺失,而非NK细胞或巨噬细胞,足以重现全身ARHGEF1缺失导致的抗转移表型。综上所述,这部分研究发现ARHGEF1在T细胞中发挥免疫抑制作用,从而促进肿瘤的转移。进一步阐明ARHGEF1在T细胞功能调控的分子机制,可能为肿瘤免疫治疗提供新的靶点。
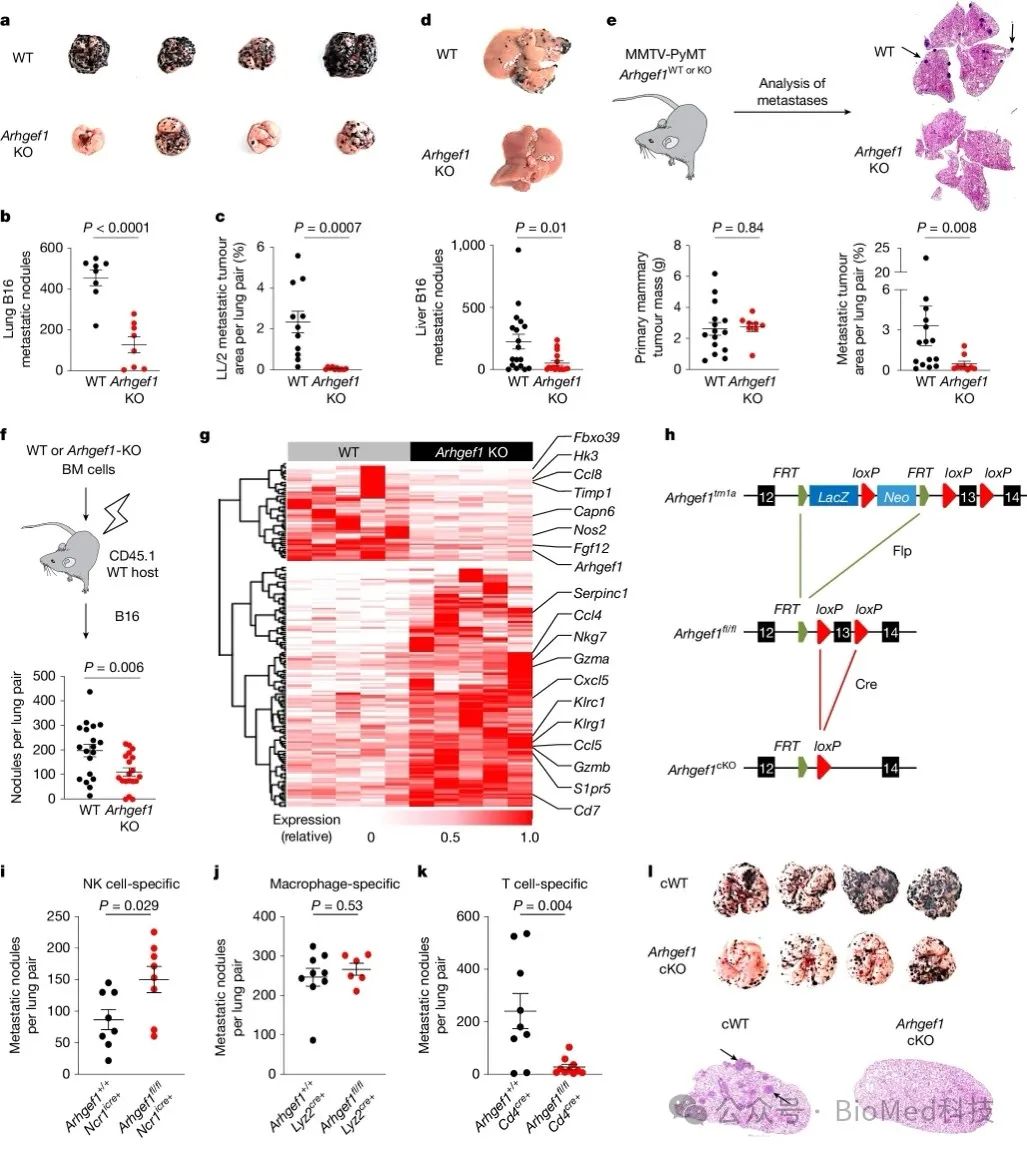
图1 ARHGEF1抑制T细胞免疫转移
二、ARHGEF1的缺失促进CD8+ T细胞增强细胞因子多功能性
与野生型小鼠相比,ARHGEF1缺失小鼠的肺部转移灶浸润T细胞中,能产生更多的多功能性细胞(同时分泌IFN-γ、IL-2和TNF)。高维流式细胞术分析发现,在肺部转移灶中,ARHGEF1缺失小鼠T细胞中,终末衰竭和前体衰竭亚群的频率均有所降低。对肿瘤抗原特异性CD8+ T细胞的分析显示,ARHGEF1缺失可提高其细胞因子分泌功能,并降低衰竭表型的表达。转移瘤生长的动力学分析发现,ARHGEF1缺失主要影响转移瘤在晚期(11天和17天)的生长,而不影响早期(1天和7天)的转移和生长。进一步实验证明,ARHGEF1在T细胞中的功能并非仅限于肿瘤特异性反应,在细菌感染模型中,ARHGEF1缺失也可增强中央记忆型CD8+ T细胞的分化。综上所述,ARHGEF1在T细胞中发挥免疫抑制作用,通过抑制效应T细胞功能,导致T细胞衰竭,从而促进肿瘤转移的发生。
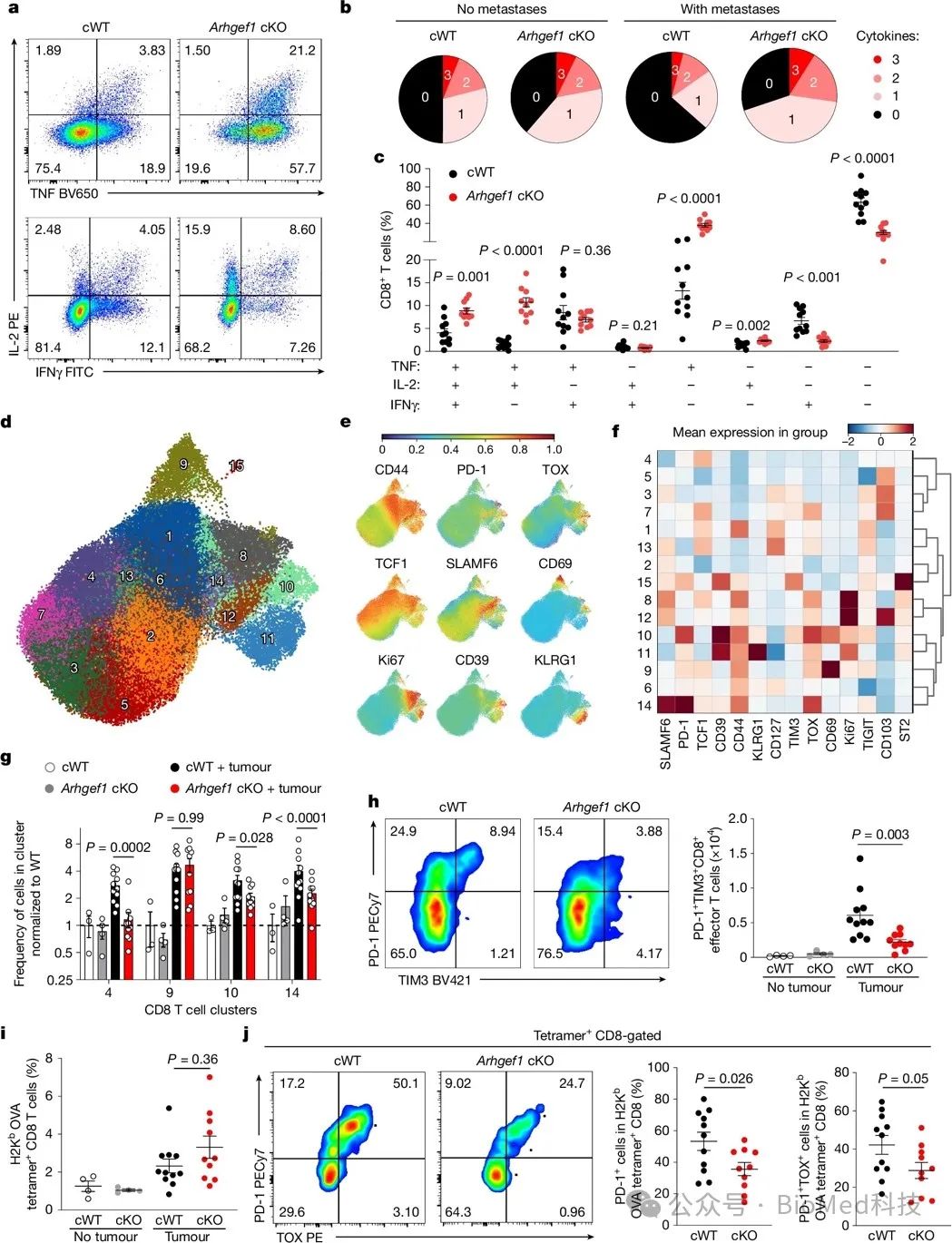
图2 ARHGEF1的缺失促进CD8+ T细胞增强细胞因子多功能性
三、TXA2通过ARHGEF1抑制T细胞的活化和增殖
作者通过生物信息学分析,从Gα12/13偶联的G蛋白偶联受体(GPCR)中,筛选出18个在静息和活化CD8+ T细胞中有显著表达的受体。对这些GPCR的配体进行体外T细胞激活实验筛选,作者发现其中TXA2受体(也称TP)的配体TXA2模拟物U46619,可以抑制T细胞活化,且这一效应高度依赖于ARHGEF1。通过纯化CD8+ T细胞的进一步实验确认,TXA2模拟物U46619能显著抑制野生型T细胞的活化和增殖,而对ARHGEF1缺失的T细胞几乎无影响。进一步实验证明,TXA2的抑制效应需要其受体TP,因为使用TP的特异性抑制剂或遗传方式敲除TP都可以逆转该效应。值得注意的是,TXA2模拟物在纯化的CD8+ T细胞中就能发挥抑制作用,不依赖于与其他细胞类型的相互作用。综上所述,这部分研究明确了ARHGEF1在T细胞中的免疫抑制作用依赖于TXA2-TP信号通路,即ARHGEF1作为TXA2信号下游的关键通路分子,抑制T细胞的活化和增殖。
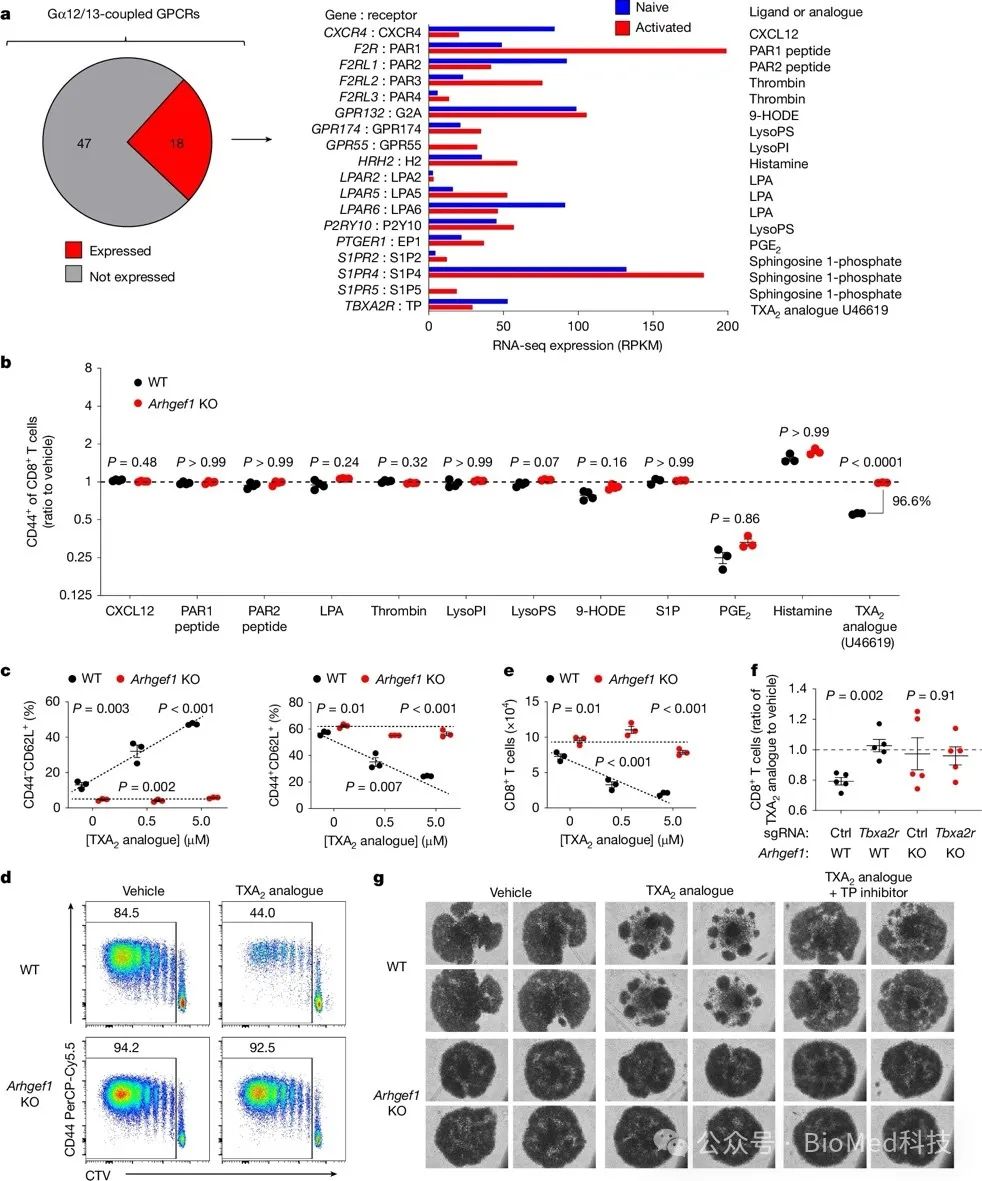
图3 TXA2通过ARHGEF1抑制T细胞的活化和增殖
四、阿司匹林通过释放受TXA2抑制的T细胞,从而促进抗转移免疫
在小鼠体内,补充TXA2模拟物U46619能增加肺转移的发生,而服用阿司匹林则能降低TXA2代谢物在血清中的含量。阿司匹林的抗转移作用依赖于免疫系统,在T细胞特异性缺失ARHGEF1的小鼠中,阿司匹林不能抑制转移的发生。阿司匹林处理使野生型小鼠肺部转移灶中的T细胞激活状态提高到ARHGEF1缺失小鼠的水平,而补充TXA2模拟物可逆转阿司匹林的抑制效应,但在ARHGEF1缺失小鼠中无影响。骨髓移植实验证实,阿司匹林的抗转移作用需要其在造血细胞中的受体TP(TXA2受体)表达。选择性COX-1抑制剂能复制阿司匹林的抑制转移作用,并降低TXA2代谢物在血清中的含量,而COX-2抑制剂没有这种效果。小鼠实验和体外实验均表明,血小板通过COX-1依赖性产生的TXA2,可以抑制T细胞的活化,ARHGEF1在这一过程中起关键作用。综上所述,这部分研究揭示了阿司匹林通过抑制血小板COX-1依赖性TXA2产生,从而解除其在ARHGEF1信号通路下对T细胞的抑制,从而发挥抗肿瘤转移的作用。
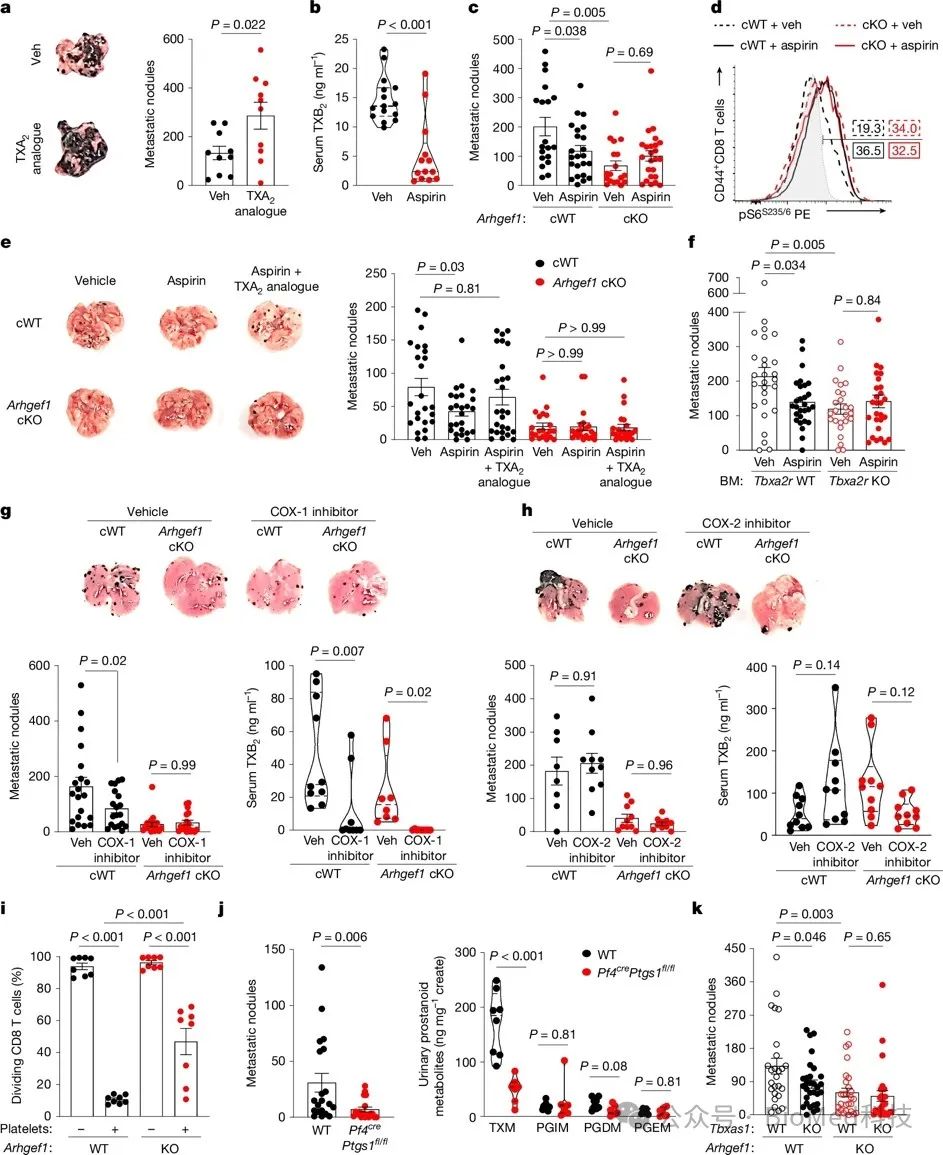
图4 阿司匹林通过释放受TXA2抑制的T细胞,从而促进抗转移免疫
【结论与展望】
总之,在这项研究中,作者发现血小板TXA2通过激活依赖于鸟嘌呤交换因子ARHGEF1的T细胞内在免疫抑制途径来抑制对癌症转移的免疫。因此,使用阿司匹林、选择性COX-1抑制剂或血小板特异性删除COX-1来限制TXA2,以一种依赖于T细胞内在ARHGEF1表达和体内TXA2信号传导的方式降低了癌症转移率。这些发现揭示了一种新的免疫抑制途径,限制了T细胞对癌症转移的免疫,为阿司匹林的抗转移活性提供了机制基础,并为开发更有效的抗转移免疫疗法铺平了道路。
原文链接:
https://www.nature.com/articles/s41586-025-08626-7- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)