首页 > 医疗资讯/ 正文
CAR-NK
髓系恶性肿瘤包括多种来源于骨髓内髓系细胞异常发育或增殖的癌症。虽然CAR-T细胞疗法在B细胞和浆细胞治疗中显示出巨大潜力,但在治疗髓系恶性肿瘤时仍面临重大挑战,包括:(i)体外基因转导效率低和扩增平台不完善;(ii)体内增殖和持久性有限;(iii)抗原异质性;(iv)免疫抑制性肿瘤微环境。尽管存在这些障碍,“现货型”CAR-NK治疗仍显示出令人鼓舞的结果,表现为增殖增强、持久性延长、肿瘤浸润能力提高以及适应性改善。
华中科技大学同济医学院附属同济医院隗佳教授及穆伟副研究员近日于《MOLECULAR CANCER THERAPEUTICS》发表综述,总结了NK细胞的生物学特征、细胞毒机制和细胞来源,讨论了当代CAR设计,不同NK细胞来源的优势和局限性,还探讨了CAR-NK细胞疗法在髓系治疗的临床前研究和临床研究的挑战及增强策略。

引言
近年来,嵌合抗原受体(CAR)技术已成为细胞免疫疗法的核心焦点。尽管CAR-T细胞疗法在B细胞白血病和淋巴瘤中显示出显著的疗效,但由于缺乏精确靶点以及存在严重副作用的风险(如移植物抗宿主病[GVHD]、细胞因子释放综合征[CRS]和免疫效应细胞相关神经毒性综合征[ICANS]),其在髓系癌症中的应用受到限制。相比之下,CAR-NK细胞具有多项优势,其固有特性使其成为一种更安全、更可靠的选项,几乎不会引发GVHD、CRS和ICANS等并发症。此外,CAR-NK细胞可以由非亲缘供者或人类多能干细胞(hPSC)来源的NK细胞制备。
目前大多数研究CAR-NK细胞治疗髓系治疗的临床研究主要集中在中国和美国(图1)。同时,作者团队也已开展了一系列针对血液肿瘤的细胞免疫疗法的开创性研究,包括开发一种新型CD123 CAR-NK及开展相关临床研究。
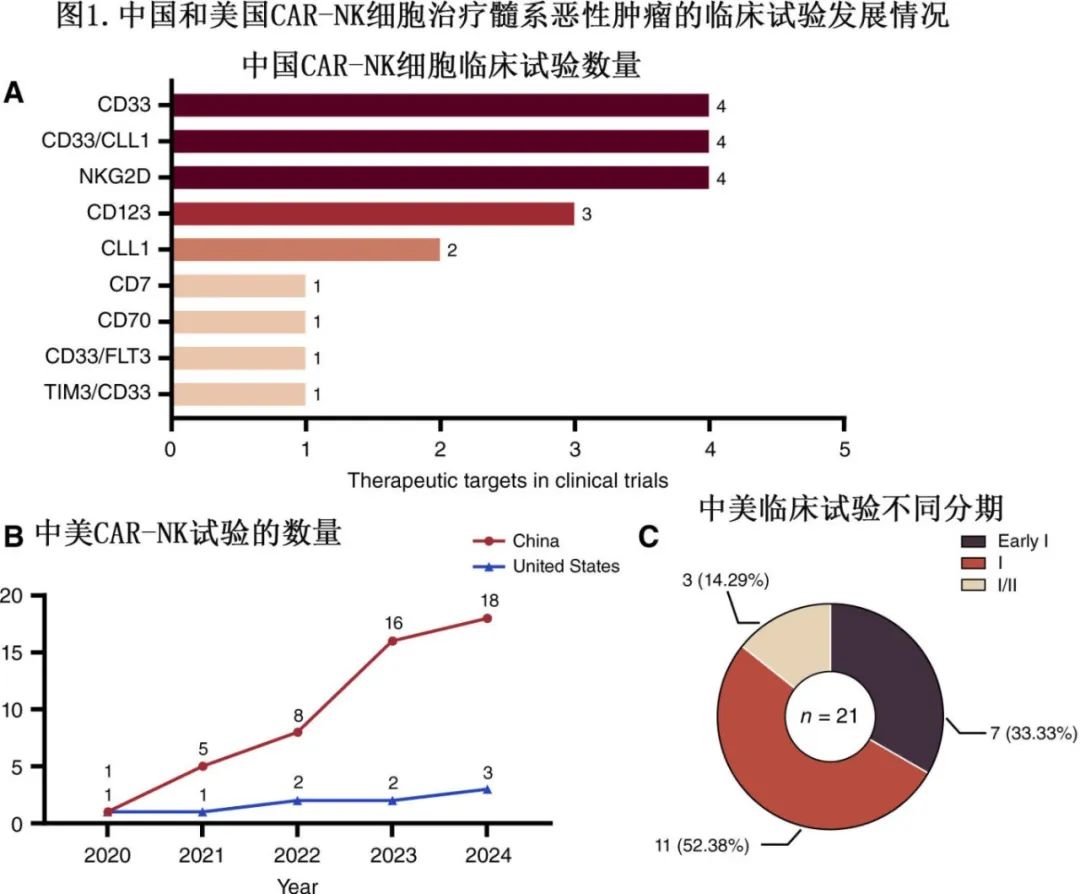
CAR-NK细胞的生物学特性
NK细胞是先天免疫系统的重要组成部分,占外周血淋巴细胞的5%–15%,可分为CD56dimCD16⁺(主要具细胞毒性)和CD56highCD16⁻/low(主要分泌细胞因子)两大亚群。NK细胞通过细胞因子分泌、ADCC和诱导凋亡直接清除癌细胞,其功能由激活性受体(如NCRs、NKG2D、DNAM-1)和抑制性受体(如KIR、CD94/NKG2A)的平衡调控。AML可通过降低激活受体表达、上调抑制受体以及减少配体水平来逃避免疫监视,抑制NK细胞的功能。
CAR由胞外域、跨膜域和胞内域组成。胞外域包括信号肽、单链片段变异体(scFv)、连接重链和轻链的连接子以及与跨膜域相连的铰链区。胞内域包含共刺激分子和信号传导结构域。CAR-NK细胞经历多代升级,第二、三代引入共刺激分子以增强疗效,第四代进一步整合细胞因子,提高细胞存活和抗肿瘤能力(图2A)。
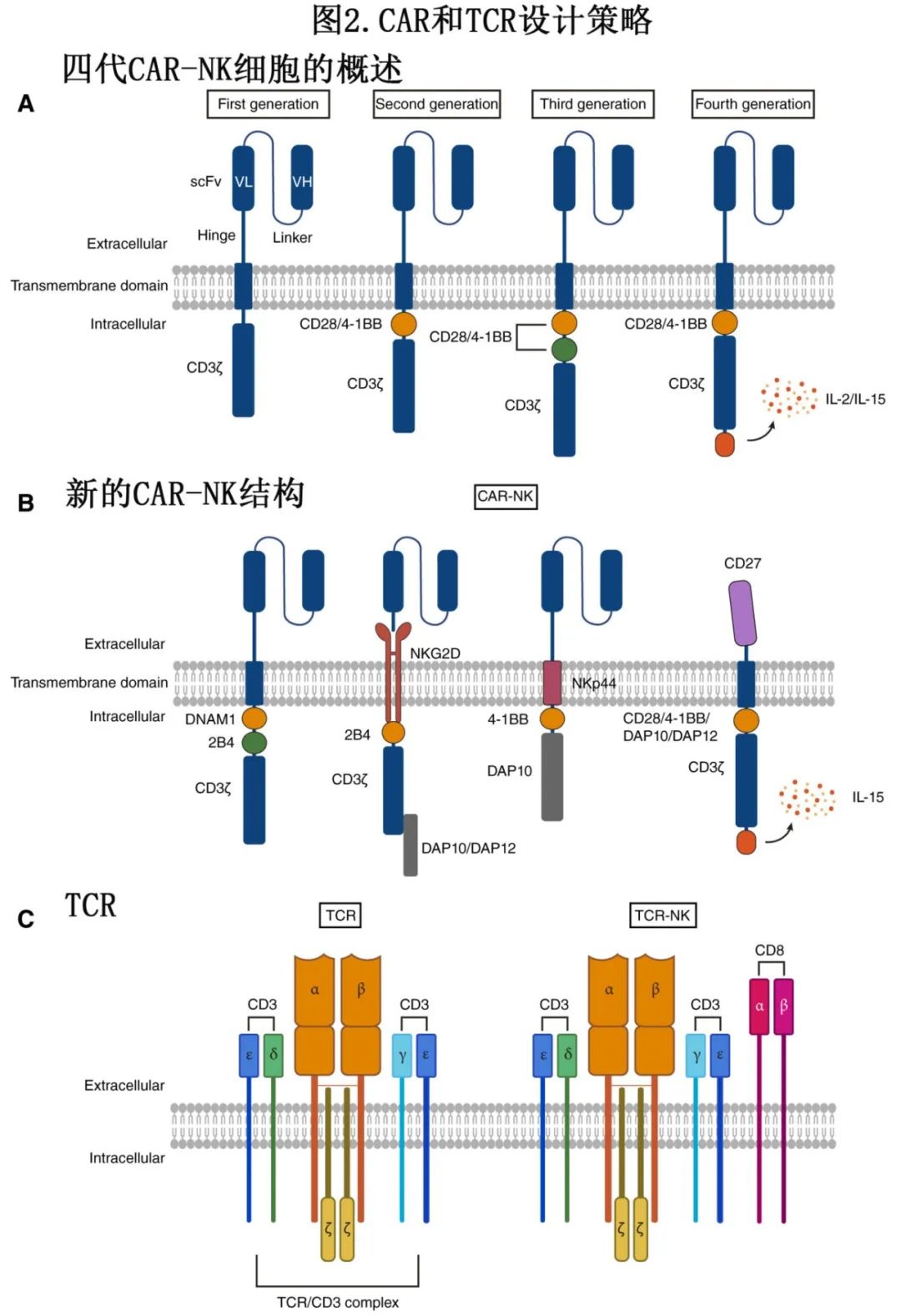
传统CAR设计主要基于T细胞,而NK细胞在信号传导和激活机制上存在显著差异,因此优化CAR结构以适应NK细胞特性至关重要。研究发现,整合NK细胞特异性信号元件(如NKG2D跨膜域、2B4共刺激信号、DAP10/12适配蛋白)可显著增强CAR-NK细胞的抗肿瘤活性、存活能力和增殖能力。例如,优化后的CAR-iPSC-NK细胞和CAR-NK-92细胞展现出更强的细胞毒性,并改善了持久性。多家公司已开发新型CAR结构,如重庆精准生物通过引入NKP44跨膜域和DAP10效应分子,提升了CAR-NK细胞的抗肿瘤效果。
基于天然受体的CAR设计是一种创新策略,利用NK细胞天然结合特性增强疗效,同时减少脱靶效应,提高细胞存续时间。例如,NKG2D-CAR利用NK细胞激活受体靶向应激配体,CD16-CAR通过Fc受体增强抗体依赖性细胞毒性(ADCC),CD27-CAR可特异性靶向CD70阳性肿瘤细胞。此外,TCR-NK细胞整合TCRα/β链、CD8共受体及完整CD3复合体,在临床前模型中表现出类似CD8 T细胞的抗原特异性杀伤能力。MD安德森癌症中心已启动I/II期临床试验(NCT06383572),探索TCR修饰NK细胞用于复发/难治性髓系恶性肿瘤,进一步验证其临床应用前景。
NK细胞的来源
NK细胞包括多种来源(图3),例如外周血(PB)、脐带血(UCB)、人胚胎干细胞(hESC)和诱导多能干细胞(iPSC)。其中,PB-NK细胞因其成熟表型和强大细胞毒性成为临床前CAR-NK研究的首选。然而,PB-NK细胞仅占外周血淋巴细胞的约10%,采集和体外扩增较为困难。此外,由于PB-NK细胞存在不同的成熟阶段,细胞产品的标准化和稳定性难以保证。
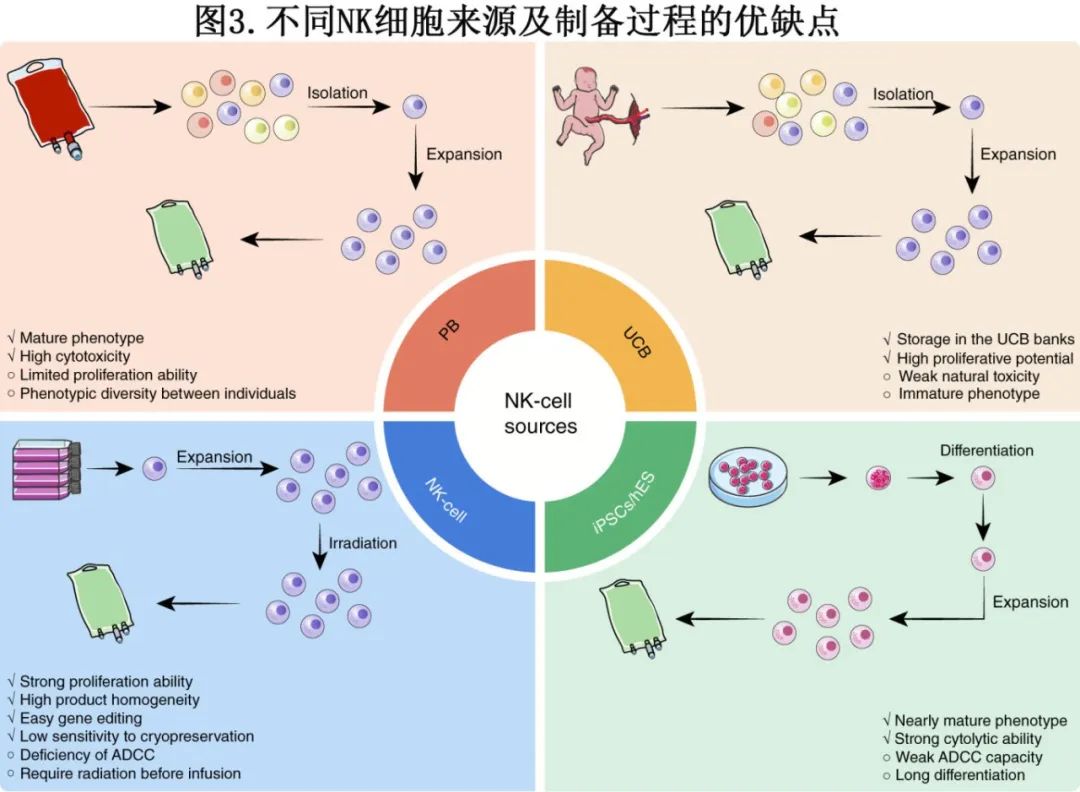
UCB-NK细胞占UCB淋巴细胞的约30%,可从国际脐带血库获取,具有较强的增殖能力。然而,其细胞毒性较低,表现出不成熟表型,CD16和CD2等激活受体水平较低,而NKG2A上调。为了增强功能,UCB-NK细胞需经体外刺激以促进成熟,提高其细胞毒性和持久性。
NK-92、KHYG-1和YT细胞系因生长潜力强、无抑制性KIR、生产一致性高、易基因修饰且耐冻存,在研究中广泛应用。NK-92细胞已被临床验证安全有效,但需输注前辐射处理,影响体内存活。此外,因缺乏CD16受体,NK-92细胞不具ADCC作用。
近年来,利用hPSCs(包括hESCs和iPSCs)生成NK细胞受到广泛关注。hPSCs具备无限扩增和自我更新能力,能够稳定供应标准化的CAR-NK细胞。CAR设计可整合至未分化的hPSCs中,建立稳定克隆化的hPSC-CAR细胞系,从而提供一致的细胞产品。 iPSCs和hESCs可分化为成熟的CD45⁺CD56⁺ NK细胞,其中hESCs来源的NK细胞表现出成熟表型,并具有更强的肿瘤杀伤能力。iPSCs来源的NK细胞表达CD56、NKG2A、NKG2C、 NKG2D和KIR,展现强大的自然细胞毒性,但CD16表达水平较低,影响ADCC功能。引入高亲和力CD16分子可增强ADCC能力,使其在联合单克隆抗体治疗中对血液系统恶性肿瘤和实体瘤表现出强效杀伤。 此外,Zhang等开发了hPSCs来源的诱导T-NK(iTNK)细胞,结合T细胞和NK细胞特征,表达多样化TCR库,具备显著的肿瘤杀伤能力。单细胞RNA测序和TCR分析显示,iTNK细胞具有适应性和先天免疫特性,为癌症免疫治疗提供新的前景。
潜在的治疗靶点
理想的CAR-NK治疗靶点应在髓系肿瘤细胞中高表达,而在健康造血细胞中低表达,以提高特异性并减少脱靶毒性。目前,CAR-NK细胞治疗AML的研究已进入临床阶段,主要靶点包括CD33、CD123、NKG2D、CD7和CLL1,同时CD38、CD4、FLT3、CD276和NPM1等靶点在临床前研究中展现出抗AML活性。然而,由于部分靶点在正常髓系细胞及其他细胞类型中也有表达,其临床应用受到一定限制。因此,进一步筛选和优化更精确的靶点对于提升CAR-NK细胞治疗AML的疗效与安全性至关重要。
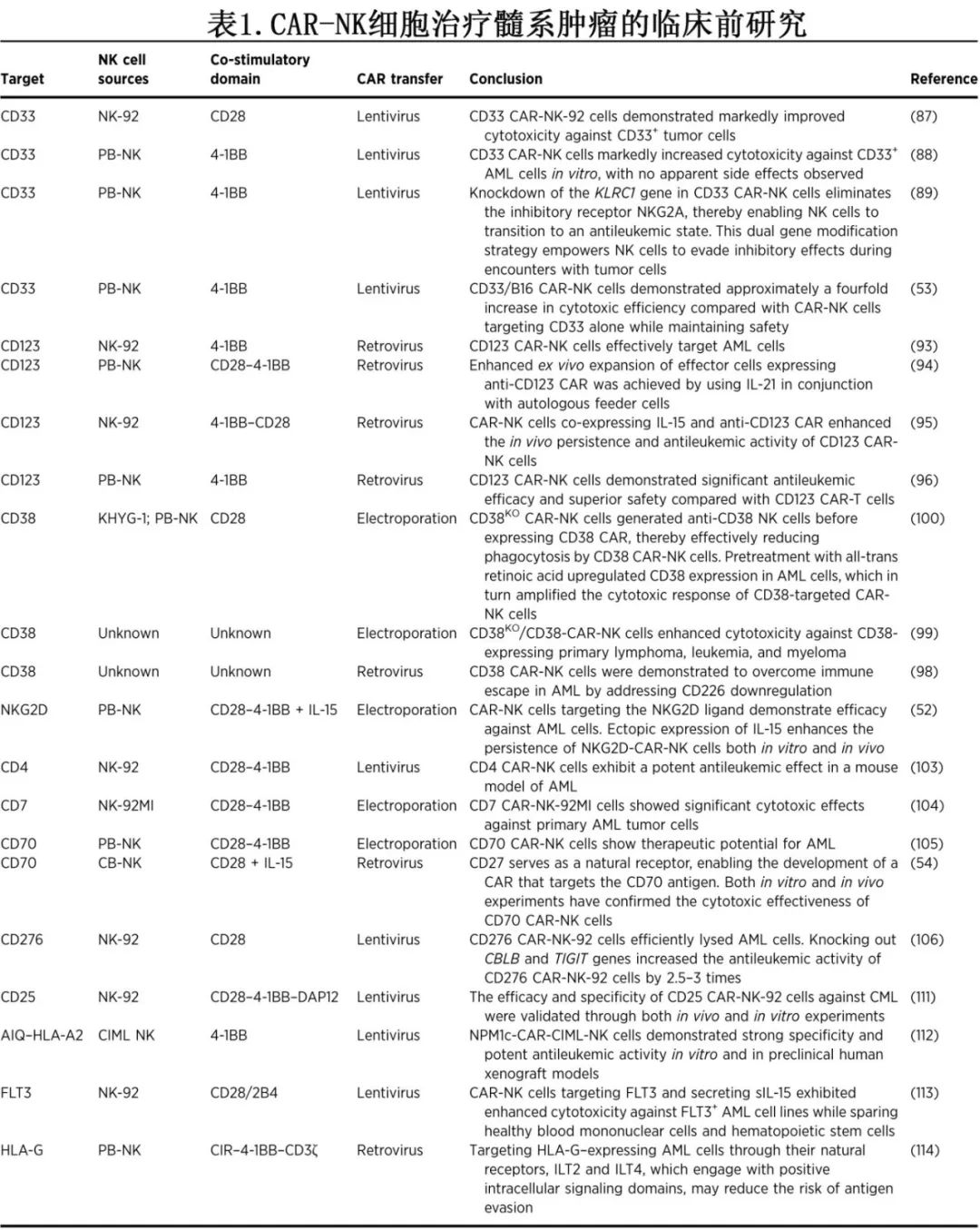
CD33
CD33是AML治疗的有前景靶点,在约90%的AML细胞中高表达,而在正常造血干细胞及成熟粒细胞中缺失。Albinger等使用BAEV-LVs转导血源性NK细胞生成CD33 CAR-NK,提高了对AML细胞的杀伤效率,并在体外实验中通过重复给药增强抗白血病效果,且异种移植小鼠模型中未观察到显著不良反应。此外,研究者利用CRISPR/Cas9技术删除CD33 CAR-NK细胞中的杀伤细胞凝集素样受体C1基因,敲除NKG2A抑制性受体,以绕过抑制信号,增强NK细胞对AML及其他恶性肿瘤的杀伤能力。Zhang等通过增强CD16信号通路,使CAR-NK细胞同时靶向CD33和B16,提高了细胞毒性四倍,同时保持良好的安全性。
CD123
CD123广泛表达于AML和BPDCN等血液系统恶性肿瘤中,且在髓系细胞和B细胞白血病祖细胞中过度表达。Morgan等通过基因工程改造NK细胞,使其持续产生IL-15并表达抗CD123 CAR,显著延长了NK细胞的存活时间并增强了抗白血病效果。Caruso等的研究表明,CD123 CAR-NK细胞相比CD123 CAR-T细胞展现出更强的抗白血病效果和更好的安全性。
CD38
CD38是MM免疫治疗的重要靶点,亦在AML中被广泛研究。CD38 CAR-NK细胞可克服AML细胞通过下调CD226实现的免疫逃逸。Troy等研究表明,CD38KO/CD38 CAR-NK细胞可增强对CD38⁺血液肿瘤的杀伤力。Gurney等利用CRISPR/Cas9敲除NK细胞中的CD38基因,避免CAR-NK细胞自相残杀,并通过全反式维甲酸上调AML细胞CD38表达以增强杀伤效果。然而,CD38在髓系细胞广泛表达,高亲和力CAR可能引发骨髓抑制,需谨慎优化。
NKG2D
NKG2D是NK细胞和T细胞的关键受体,在AML中,白血病细胞常通过下调NKG2D配体逃避免疫识别。Du等利用PiggyBac转座子技术构建NKG2D CAR-NK细胞,并验证其抗AML活性。进一步研究表明,共表达NKG2D CAR和IL-15可延长CAR-NK细胞存活时间,增强抗肿瘤效果,并在AML小鼠模型中显著延长生存期。
其他靶点
多种CAR-NK细胞策略正在探索AML治疗的新靶点,并展现出良好的前景。CD4 CAR-NK在AML模型中表现出强效的抗白血病活性,CD7 CAR-NK-92MI细胞也显示出对AML原代肿瘤细胞的杀伤能力。CD70 CAR-NK细胞在体内外实验中均验证了其治疗潜力,近期研究进一步优化了CAR结构,以增强其抗肿瘤能力。CD276 CAR-NK-92细胞可有效溶解AML细胞,且可通过敲除CBLB和TIGIT基因,显著增强细胞毒性。CD25 CAR-NK细胞在CML急变期及AML中的应用潜力逐步得到认可,有望为这一特殊群体提供新的免疫治疗选择。
NPM1c突变蛋白在约50%的人群中产生一个白血病特异性的新表位(AIQDLCLV),该表位存在于HLA-A0201等位基因上(AIQ-HLA-A2),为AML提供了一个精准靶向的免疫治疗策略,NPM1c-CAR-CIML NK细胞在体外和患者来源的异种移植模型中展现了高特异性和强效的抗白血病活性。FLT3 CAR_sIL-15 NK细胞不仅有效杀伤FLT3⁺ AML细胞,同时对健康造血细胞的影响较小,突出了其在临床应用中的安全性优势。HLA-G CAR-NK细胞通过靶向这一广泛表达于AML和实体瘤的免疫逃逸分子,有望克服CAR疗法中常见的抗原逃逸问题,为AML治疗提供更持久的免疫控制。
正在进行的临床试验
尽管许多临床前研究已经探索了CAR-NK细胞疗法,但在髓系恶性肿瘤(尤其是AML)中涉及CAR-NK细胞的临床试验仍较少(表2)。目前的临床研究初步验证了CAR-NK细胞在复发/难治性AML(R/R AML)治疗中的安全性和潜在疗效。

一项I期研究评估了CD33 CAR-NK-92细胞的安全性,三例患者接受了最高5×10⁹细胞的递增剂量治疗。研究未观察到严重不良反应,输注后患者外周血液中检测到CAR-NK-92细胞的存在。虽然未能显示显著的临床疗效,但该研究提示优化后的“现货型”CD33 CAR-NK-92细胞可能成为R/R AML的一种新的治疗策略。
另一项研究纳入10例18-65岁的R/R AML患者,患者在接受氟达拉滨(30 mg/m²)和环磷酰胺(300-500 mg/m²)预处理后,根据剂量和输注次数分为三组。其中,第一组3例患者接受三次CD33 CAR-NK细胞输注(6×10⁸、1.2×10⁹和1.8×10⁹细胞),第二组3例患者接受一次1.8×10⁹细胞输注,第三组4例患者接受三次1.8×10⁹细胞输注。治疗过程中,仅1例患者出现2级CRS,未观察到严重毒性。28天随访数据显示,6例患者达到微小残留病阴性完全缓解(CR),提示CD33 CAR-NK细胞在R/R AML中具有良好的安全性和早期疗效。但仍需进一步研究以优化治疗方案,并延长随访以评估长期疗效。
此外,针对NKG2D靶点的CAR-NK产品NKX101在I期研究中显示良好的安全性和抗白血病活性。该研究共纳入6例R/R AML患者,所有患者均接受过至少一种既往治疗,包括针对已识别基因突变的靶向治疗。患者在氟达拉滨(30 mg/m²)和阿糖胞苷(Ara-C;2 g/m²)预处理后,于第0、7和14天接受NKX101治疗,每次输注15亿CAR⁺细胞。在随访期间,所有患者均至少接受三剂治疗,疗效评估在第27天进行。研究显示,无患者发生CRS、ICANS或GVHD,毒性控制良好。疗效方面,6例患者中有4例达到CR或CR伴部分血液学恢复,其中3例为CR,提示该疗法在R/R AML患者中能引发较好的早期反应。尽管该方案的毒性可控,但扩大入组和延长随访对于全面评估仍然至关重要。
CAR-NK细胞疗法的进一步优化
多项研究都强调了CAR-NK细胞治疗髓系恶性肿瘤的良好前景,然而在临床前研究和临床试验中,仍然存在需要解决的重大障碍和挑战(图4)。

改进CAR-NK细胞制备技术
CAR-NK细胞的制造面临多项挑战,特别是在冻存和基因修饰方面。NK细胞对冻存的敏感性高于T细胞,冻存和解冻过程会显著降低其活性和细胞毒性。传统冻存保护剂DMSO可能削弱NK细胞的效能,因此研究人员探索了无DMSO冻存方案,如聚赖氨酸、葡聚糖、ectoin以及葡聚糖-40与羧化聚赖氨酸的组合,这些方法均能有效维持NK细胞活性。此外,壳聚糖-TPP纳米颗粒递送海藻糖可提高解冻后NK细胞的存活率和功能。Berjis等研究发现,冻存过程中颗粒酶B泄漏会诱导NK细胞凋亡,而预处理IL-15和IL-18可降低颗粒酶B水平,并提高BCL2L1表达,使冻存NK细胞的恢复率达90%-100%,保持与新鲜NK细胞相当的抗肿瘤能力。
传统病毒载体(如逆转录病毒)存在插入突变和致癌风险,限制了其在CAR-NK细胞制造中的应用。慢病毒和腺病毒被广泛用于优化转导效率,但仍可能诱导细胞凋亡。研究人员开发了新方法,如Kararoudi等利用CRISPR-Cas9结合腺相关病毒,实现CD33 CAR基因的稳定整合,并在扩增后保持有效靶向AML细胞。Soldierer等采用BaEV-LVs,提高了原代NK细胞的转导效率和稳定性。近年来,非病毒载体技术因其安全性和高效性成为重要替代方案。例如,Gurney等利用TcBuster DNA转座子系统结合EB病毒转化的淋巴祖细胞,成功生成适用于临床的CAR-NK细胞。
优化CAR-NK结构
CAR-NK细胞疗法与CAR-T细胞疗法在抗肿瘤过程中面临类似挑战,尤其是肿瘤免疫逃逸问题。抗原丢失和细胞质胞啃(cytosolic nibbling)是导致AML复发的重要因素,而优化CAR-NK细胞结构可作为克服这一障碍的策略。
癌细胞通过表达抑制性分子或免疫抑制信号逃避免疫识别。Fei等开发了一种基于PD-1的抑制性CAR,靶向HLA-DR,以应对血液肿瘤HLA-DR的丢失。研究显示,抗HLA-DR抑制性CAR与CD19 CAR的双CAR-NK细胞能精准攻击CD19⁺HLA-DR⁻细胞,同时避免对HLA-DR⁺细胞的误杀,提高了CAR-NK细胞在HLA-DR缺失肿瘤中的靶向准确性。
逻辑门控CAR-NK细胞设计可识别特定抗原组合,以减少脱靶效应并增强疗效。例如,SENTI-202可靶向AML细胞系中的CD33和/或FLT3,同时保留健康造血干细胞和祖细胞。然而,多CAR表达增加了工程化的复杂性,并可能提高毒性水平,因此仍需进一步研究优化其安全性和稳定性。
CAR-NK细胞激活可能导致抗原在CAR-NK表面的转移和呈递,从而引发抗原丢失和意外靶向。Li等开发了一种双CAR策略,使NK细胞同时表达激活性CAR和抑制性CAR,有效防止CAR介导的NKTROG⁺细胞自噬,同时保持抗肿瘤效力。
提高CAR-NK临床应用的疗效
CAR-NK细胞的短寿命和体内持久性有限是其治疗AML的主要挑战,多种策略正在探索以延长其存活时间并提高疗效。
最直接的方法是重复输注CAR-NK细胞以维持持续疗效。此外,使用来自UCB或多能干细胞的长寿NK细胞也是一种潜在方案,但可能带来长期毒性风险。Liu等通过逆转录病毒载体(iC9/CAR.19/IL-15)修饰UCB来源的NK细胞,引入诱导型caspase-9自杀基因,在延长NK细胞存活的同时提供可控的安全机制。
CAR-NK细胞疗法与放疗和化疗联合使用可提高AML患者的生存率。例如,阿扎胞苷可增加AML细胞中CD123的表达,而地西他滨可增强CD70的表达,从而提高相应CAR-NK细胞的靶向杀伤能力。此外,对于在CAR-NK治疗后达到缓解的AML患者,桥接异基因造血干细胞移植可作为降低复发风险的策略。 这些方法的结合有望克服CAR-NK细胞的短暂性,提高其在AML治疗中的临床效益。
总结与未来展望
CAR-NK细胞疗法仍处于早期阶段,但在治疗AML及其他血液系统恶性肿瘤方面展现出巨大潜力。由于AML患者NK细胞数量减少且活性降低,CAR-NK细胞增强免疫反应成为一项有前景的治疗策略。然而,CAR-NK疗法仍面临CAR结构优化、NK细胞扩增与激活、持久性增强等挑战,亟需进一步研究来解决这些问题。 展望未来,随着临床研究的深入和数据的积累,CAR-NK、TCR-NK以及iTNK等新兴NK细胞疗法有望成为高效、安全的“现货型”癌症免疫治疗,为髓系恶性肿瘤患者提供更多治疗选择。
参考文献
Anqi Zhang, Xingcheng Yang, Yicheng Zhang, Xiaoxuan Yu, Wei Mu, Jia Wei; Unlocking the Potential of CAR-NK Cell Therapy: Overcoming Barriers and Challenges in the Treatment of Myeloid Malignancies. Mol Cancer Ther 2025; https://doi.org/10.1158/1535-7163.MCT-24-0721
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)