首页 > 医疗资讯/ 正文
下一代测序(NGS)癌症基因检测在韩国的常规临床实践中已逐渐得到应用。在此,研究者评估了在真实世界临床实践中,针对晚期实体瘤患者的NGS检测及基因匹配疗法的应用情况。研究者分析了2019年6月至2020年6月期间所订购的NGS癌症基因panel检测(SNUBH泛癌种2.0版)的结果。该检测panel覆盖544个基因,同时会报告微卫星不稳定性(MSI)状态以及肿瘤突变负荷(TMB)。基因匹配治疗方案是依据从NGS检测中获取的新信息来确定的,同时排除了传统分子检测的结果。
共有990名患者纳入分析(中位年龄:62岁,IV期患者占82.5%)。使用分子病理学会基因变异分类系统,研究者发现257名(26.0%)患者携带I级变异,859名(86.8%)患者携带II级变异。在I级变异病例中,检测到的最常发生变异的基因是KRAS(106名患者,占10.7%),其次是EGFR(27名患者,占2.7%)和BRAF(17名患者,占1.7%)。在携带I级变异的患者中,13.7%的患者接受了基于NGS结果的治疗,具体如下:甲状腺癌(2/7,占28.6%)、皮肤癌(2/8,占25.0%)、妇科癌症(7/65,占10.8%)以及肺癌(12/112,占10.7%)。在接受基于NGS结果治疗且有可测量病灶的32名患者中,12名(37.5%)达到部分缓解,11名(34.4%)病情稳定。中位治疗持续时间为6.4个月(95%置信区间,4.4 - 8.4),中位总生存期(OS)尚未达到。总之,NGS肿瘤基因检测在真实世界临床实践中成功实施。这使得基于分子基因检测指导的治疗得以应用,改善了部分患者的生存结局。
研究背景
在过去十年中,借助NGS技术的临床应用,癌症患者的诊断与治疗方式发生了重大转变。利用NGS开展的大规模肿瘤分子图谱分析项目,推动了癌症精准医疗的发展。基于NGS的分子病理学不仅已成为诊断肿瘤、预测其预后的重要手段,还在指导治疗决策方面发挥着关键作用。事实上,已有多项临床试验运用深度测序技术,将癌症患者随机分组,给予新的基因匹配疗法。此外,可通过药物干预的肿瘤特异性分子变异的数量大幅增加,在多种癌症类型中,生物标志物匹配疗法显著延长了患者生存期。
韩国国民健康保险服务现已将NGS检测纳入医保覆盖范围,针对靶基因的NGS检测目前正在韩国的临床实践中推行。尽管NGS检测的费用变得更加亲民,但由于多种原因,将这些检测纳入日常临床应用仍颇具挑战。首先,建立和维护能够支持基因组检测与研究的生物信息学基础设施,需要大量资金投入。此外,运行复杂的软件以及管理NGS所需的科学计算工作,需要生物信息学专家和服务器工程师。另外,在日常临床实践中实施NGS检测,严格的质量控制机制和合理的周转时间至关重要。
基于NGS的肿瘤学的主要目标之一,是依据NGS检测结果确定能让患者直接受益的基因匹配疗法。然而,解读NGS检测结果并识别可干预的基因变异依然颇具挑战,这使得实施基因匹配疗法困难重重。在临床试验范畴之外,对匹配药物超说明书用药的限制,进一步加大了实施难度。此外,不同的分级系统之间存在显著差异,这取决于提出该系统的团队以及每个分级的标准。NGS在研究与临床应用之间的这种差距,可能会让NGS的临床应用变得更为艰难。
为应对在常规临床实践中实施基于NGS的肿瘤基因检测所面临的挑战,研究者在韩国一家三级医院评估了这项技术的临床应用价值。在此,研究者阐述了针对晚期实体瘤患者的NGS检测应用情况,并探究了基因匹配疗法的实际应用频率及效果。所有基因变异均按照分子病理学协会提供的癌症序列变异解读与报告标准化指南进行报告和分级:(1)I级,具有强烈临床意义的变异,例如美国食品药品监督管理局FDA批准的、专业指南推荐的或基于充分研究证据的治疗相关变异。(2)II级,具有潜在临床意义的变异,例如FD 批准用于其他不同肿瘤类型的治疗或处于研究阶段的疗法相关变异。(3)III级,临床意义未知的变异。(4)IV级,良性或可能为良性的变异。
研究结果
患者:
在研究过程中,主治医生共开出了1014份NGS检测申请。其中,有23份检测未得出合适结果,因此被取消,原因如下:组织标本不足(7例)、DNA提取失败(10例)、文库制备失败(4例)、测序质量不佳(1例)、组织标本脱钙(1例)。此外,还有1例应临床科室要求取消检测。这使得检测失败率为2.4%(24/1014)。最终,990例有NGS检测结果的患者被纳入本次分析。患者中位年龄为62岁(范围:2 - 92岁),男性患者占50.9%。82.5%的患者处于癌症IV期。最常见的癌症类型是结直肠癌(22.3%),其次是胆胰癌(18.1%)、肺癌(11.3%)、胃癌(9.2%)、乳腺癌(7.8%)和脑癌(7.7%)(表1)。
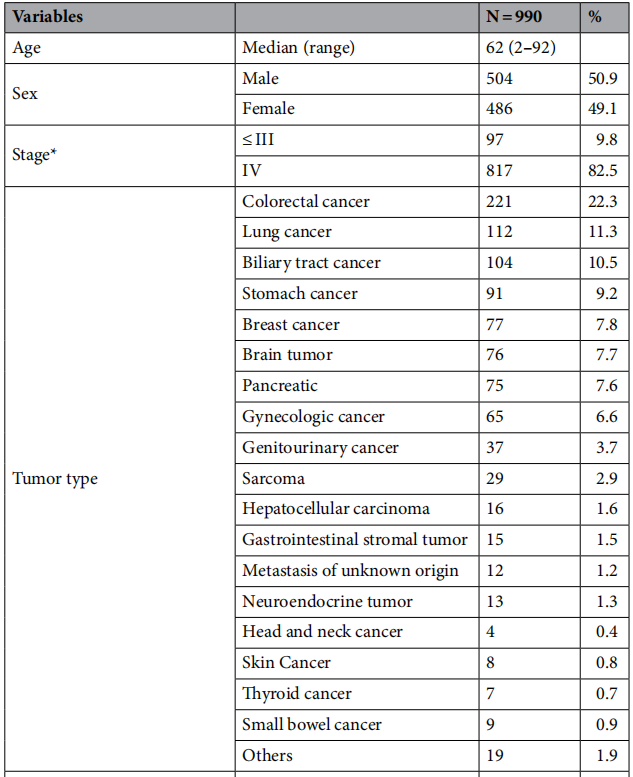
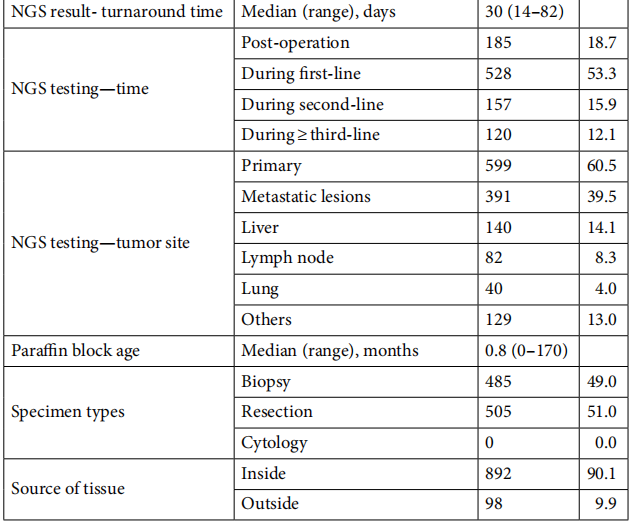
表1
NGS检测:
NGS检测出结果的时间为30天(范围:14 - 82天)。NGS检测最常在一线治疗期间进行(占53.3%),其次是术后阶段(占18.7%)、二线治疗期间(占15.9%)以及三线及以上治疗期间(占12.1%)。总体而言,用于NGS分析的研究样本中,有60.5%取自原发组织,其次是肝转移病灶(占14.1%)。所有NGS检测均针对保存的FFPE肿瘤标本进行,标本的中位保存时长为0.8个月(范围:0 - 170个月)。在研究样本中,49.0%通过活检获取。检测使用的标本来自首尔国立大学盆唐医院(Seoul National University Bundang Hospital)内部采集的占90.1%,来自其他医院送检的占9.9%。
NGS检测结果:
257名(26.0%)患者携带I级变异,859名(86.8%)患者携带II级变异。在I级单核苷酸变异(SNV)/小插入缺失(INDEL)变异中,最为常见的变异基因是KRAS(占10.7%),其次是EGFR(占2.7%)、BRAF(占1.7%)、IDH1(占1.6%)、KIT(占1.4%)、BRCA1/2(各占1.3%)以及NRAS(占1.2%)(图1A)。在II级SNV/INDEL变异中,在TP53(50.3%)、APC(19.2%)、KRAS(12.9%)、PIK3CA(10.4%)、SMAD4(5.1%)、CDKN2A(3.9%)和PTEN(3.9%)中发现了变异(图1B)。在I级拷贝数(CN)扩增方面,ERBB2基因出现变异(占1.2%);而在II级变异中,在FGFR1(4.3%)、CCNE1 (4.1%)、MYC(3.7%)、EGFR(3.1%)、ERBB2(2.7%)、KRAS(2.6%)、MDM2 (2.4%)、PIK3CA(1.1%)、MET(1.0%)、KIT(0.8%)和BRAF(0.5%)中发现了变异(图1C、D)。共有11例患者存在I级基因融合,9例患者出现II级基因融合(图1E、F)。
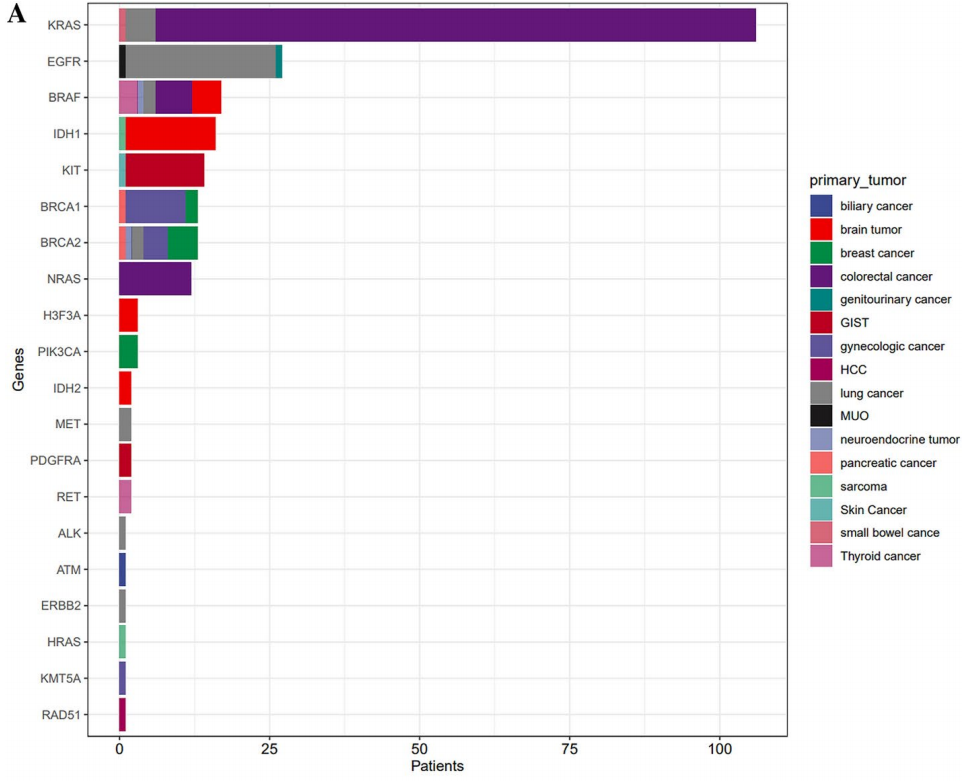
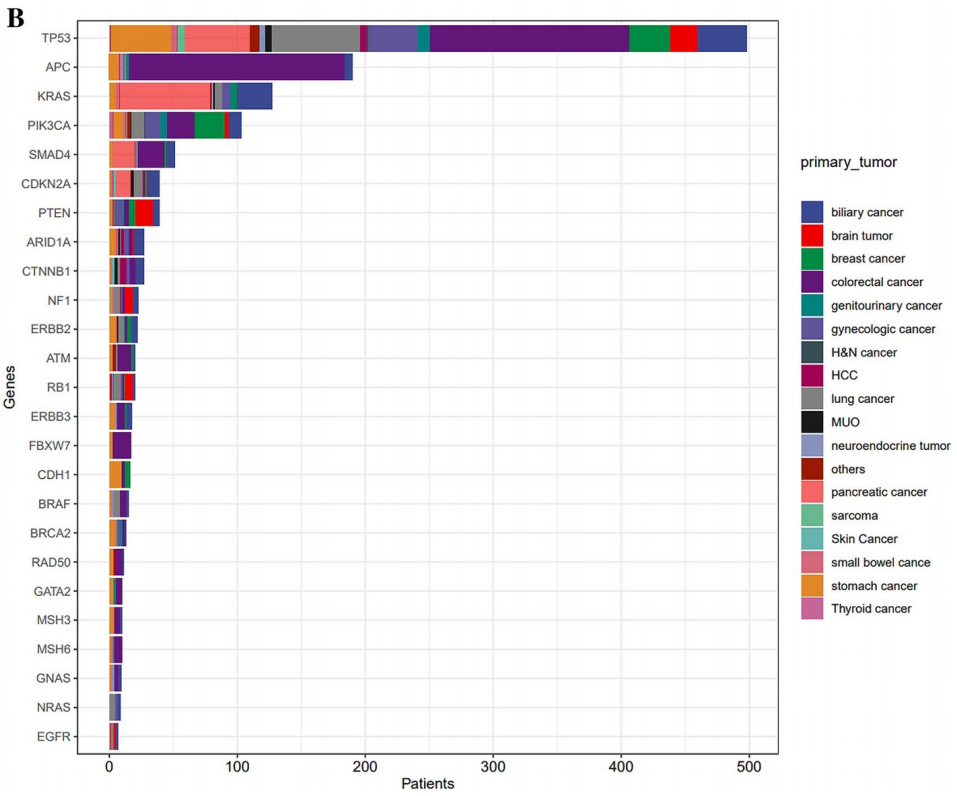
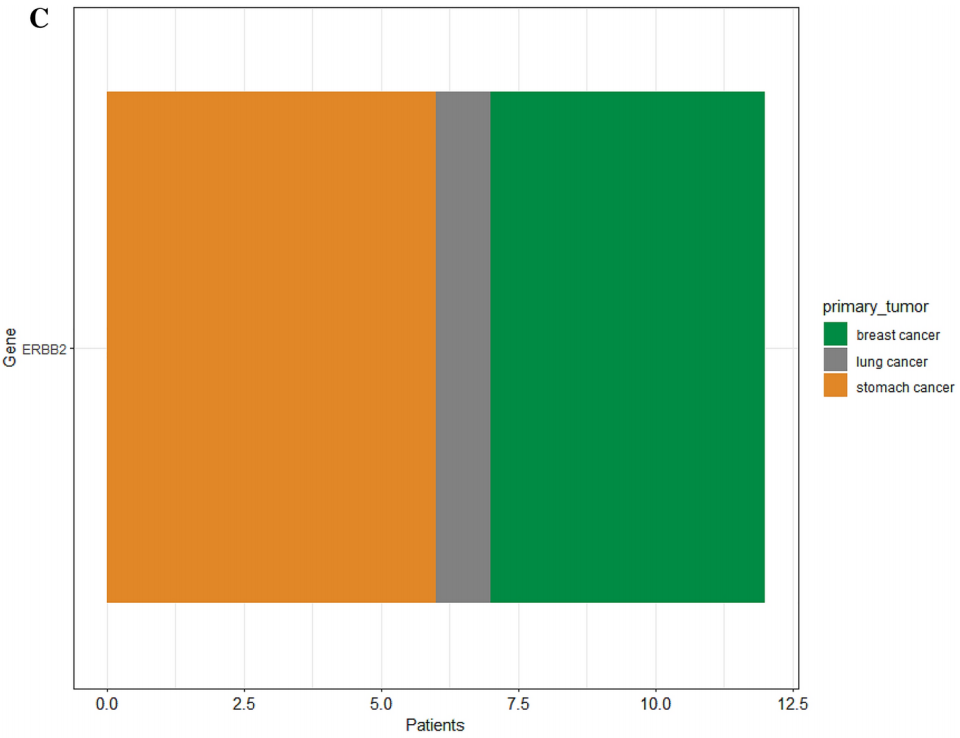
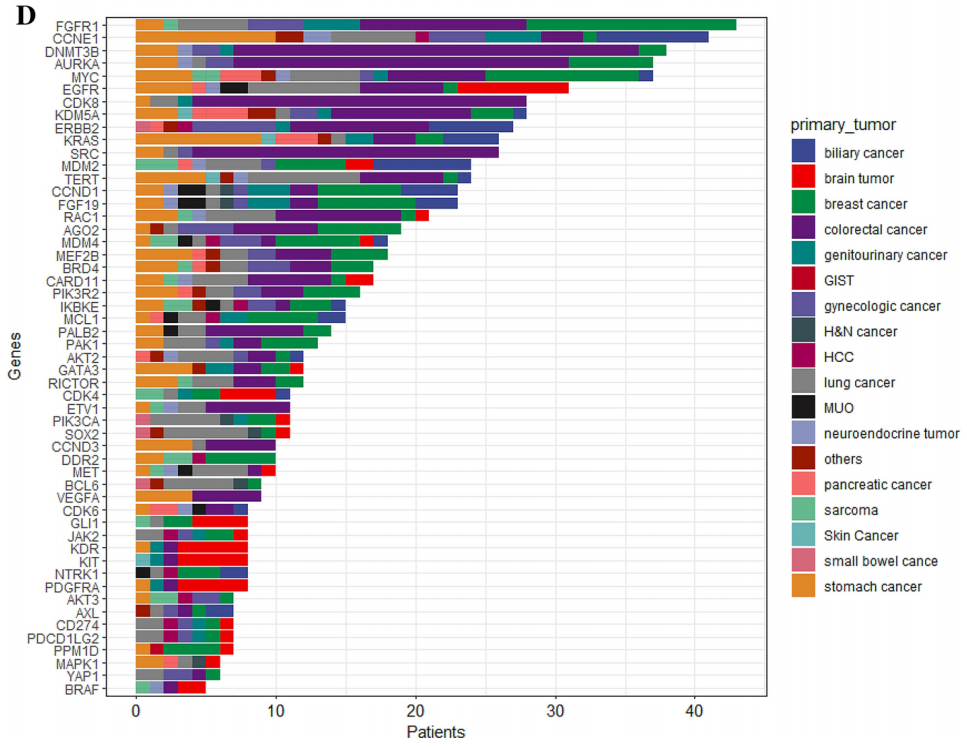
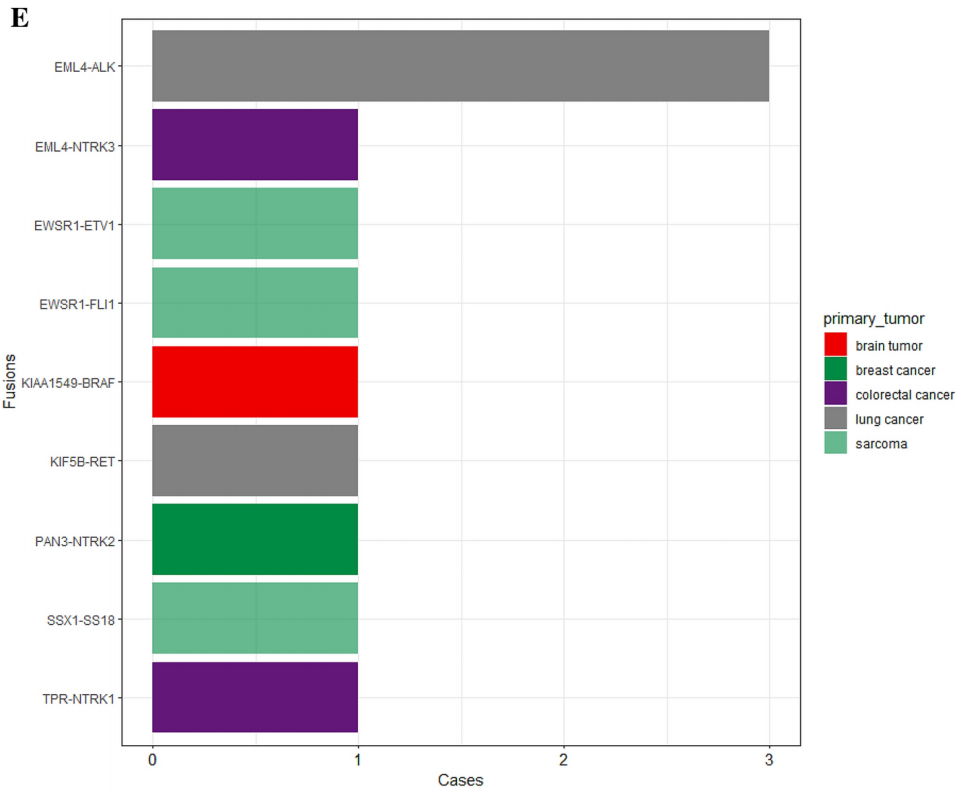
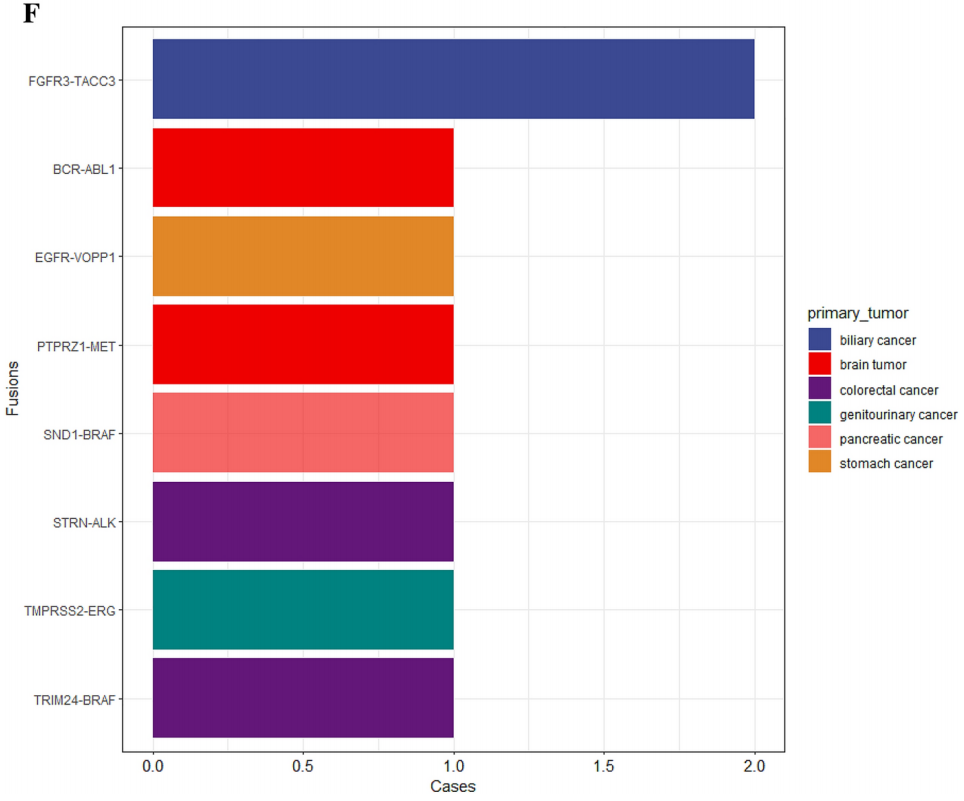

图1
在MSI状态方面,36例(3.6%)被检测为MSI - H,953例(96.3%)为MSS/MSI - L。有1例(0.1%)由于标本质量控制失败,无法评估MSI状态。MSI - H在不同癌症类型中的分布情况如下:结直肠癌13例(占36.1%)、胃癌11例(占30.6%)、胆胰癌6例(占16.7%)、小肠癌1例(占2.8%)、乳腺癌1例(占2.8%)、卵巢癌1例(占2.8%)、肺癌1例(占2.8%)、肉瘤1例(占2.8%)以及不明原发灶癌症1例(占2.8%)。
中位TMB为9.2 Mut/Mb(范围:0 - 221.9)。按MSI状态分析时,MSI - H病例的中位TMB为10.634(范围:0 - 53.2),MSS/MSI - L病例的中位TMB为9.216(范围:0.7 - 221.9)。MSI亚组之间的差异无统计学意义。检测到的最高TMB(221.9 Mut/Mb)出现在1例POLE突变的结直肠癌病例中。
NGS CN变异与HER2 IHC的一致性:
在990例成功进行NGS检测的患者中,有424例进行了HER2 IHC检测。HER2 IHC染色强度分类如下:阴性208例(49.1%),1+ 125例(29.5%),2+ 74例(17.4%),3+ 17例(4.0%)。在极少数病例中,NGS检测结果与HER2 IHC检测结果存在些许差异。在333例HER2染色强度为0或1+的标本中,通过NGS检测发现有3例(0.9%)存在HER2拷贝数增加。HER2银染原位杂交(SISH)分析证实,2例HER2染色强度为0的样本不存在扩增。1例HER2染色强度为1+的样本在SISH检测中显示扩增。在17例HER2染色强度为3+的样本中,有3例(17.6%)通过NGS未检测到HER2拷贝数增加。对这些样本进一步进行HER2 IHC分析发现,染色模式呈异质性,仅在用于NGS检测的肿瘤区域的一小部分观察到3+强度的染色。在HER2强度为2+的样本中,共有58例也进行了SISH分析,共发现了14例(24.1%)不一致病例。在HER2 SISH结果呈阳性(扩增和多体性)的样本中,当NGS结果报告为拷贝数无改变时,通过SISH测定的HER2拷贝数中位数为5.4(范围:3.5 - 8.1),显著低于NGS结果报告为拷贝数有改变时的10.7(范围:7.3 - 29.2)(p < 0.001)。
NGS与MSI PCR的一致性:
在总共990份患者样本中,有326份同时进行了MSI PCR分析。MSI PCR与NGS检测结果的一致性为99.1%,共有3例(0.9%)结果不一致。与MSI PCR检测相比,NGS检测的阳性预测值为100.0%(16/16),阴性预测值为99.0%(308/311)。
基于NGS结果的治疗应用:
在NGS检测的患者中,37例(3.7%)接受了基于NGS的治疗。对于有I级基因组变异的患者,13.7%接受了基于NGS的治疗。从NGS检测到接受NGS治疗的中位时间为4.3个月(0.8 ~ 11.7个月)。在接受基于NGS治疗的患者中,中位年龄为63岁(范围:36 ~ 85岁)(表2),40.5%为男性。在接受基于NGS治疗的患者中发现的主要癌症类型包括肺癌(32.4%)、妇科癌症(18.9%)、肝胆胰癌(13.5%)和结直肠癌(8.1%)。在不同的癌症类型中,应用基于NGS治疗最多的是肾上腺皮质癌(1/3,33.3%),其次是甲状腺癌(2/7,28.6%)、皮肤癌(2/8,25.0%)和妇科癌(7/56,10.8%)等。匹配的基于NGS的药物来自已批准的药物(67.6%)、临床试验(24.3%)和同情用药/扩大使用计划(8.1%)的日常实践(表2)。匹配的基于NGS治疗的所有基因变异被归类为I级或II级(图2)。在EGFR(9例)、BRCA1(6例)、BRAF(4例)、BRCA2(4例)、ATM(2例)、EML4-ALK融合(2例)、KIT(2例)和MET(2例)中检测到变异。根据ESCAT指南(ESMO分子靶点临床行动能力量表)对基于NGS治疗的基因变异进行分类时,IA和IB变异常见(分别为48.5%和13.5%)。研究还发现了IIIB和IVA变异(分别为13.5%和16.2%,表2)。
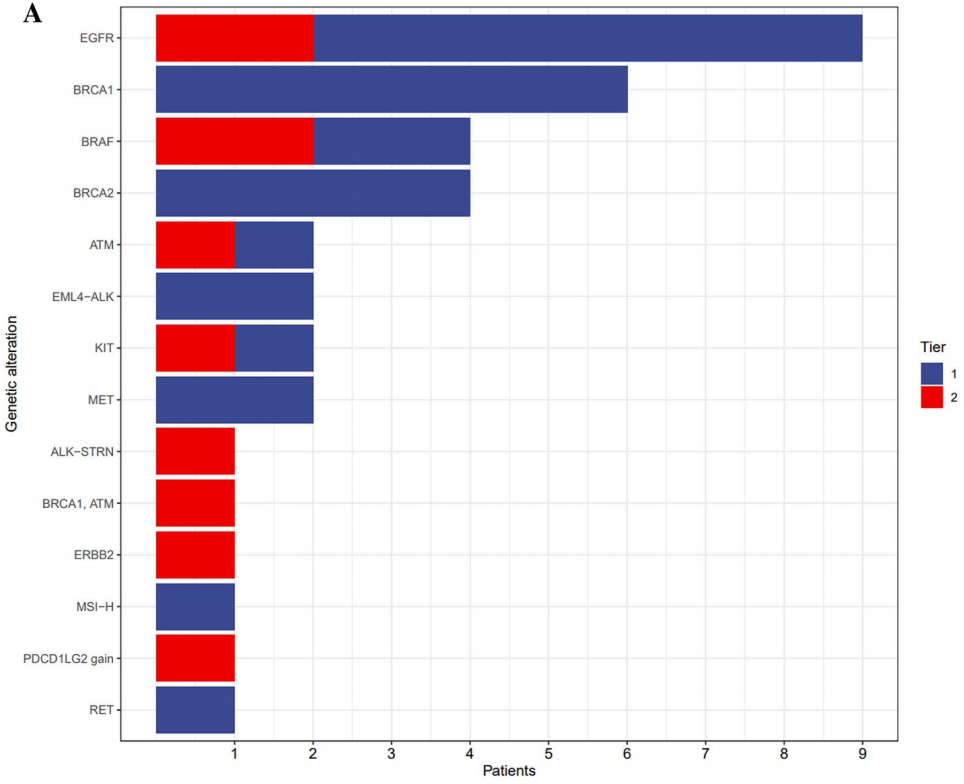
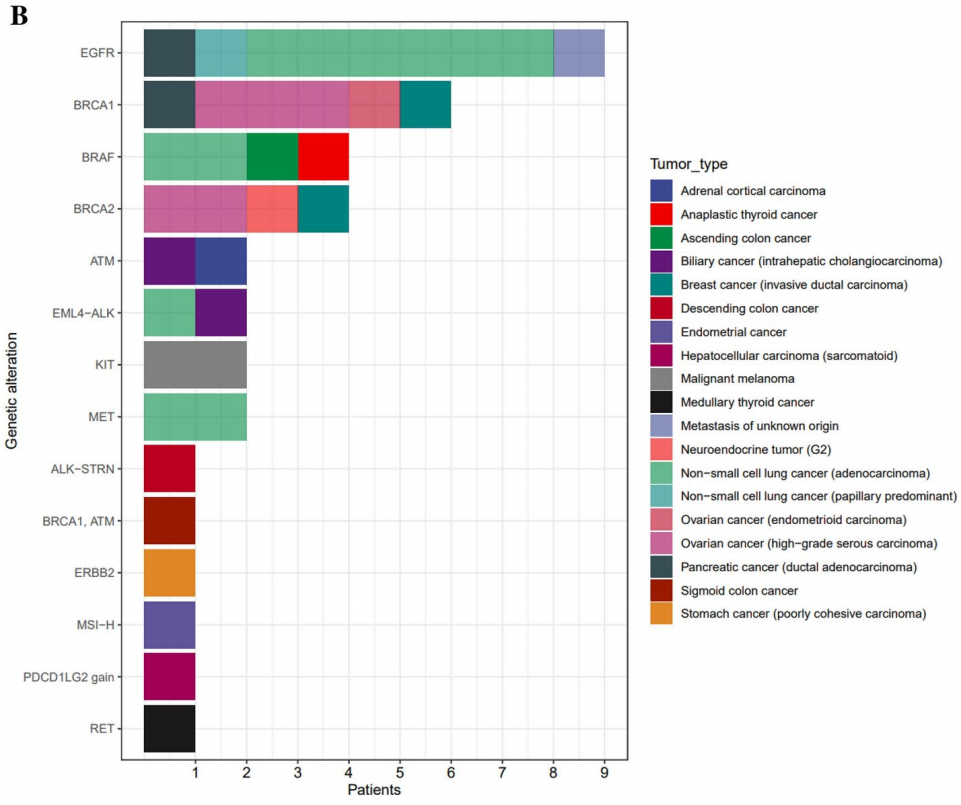
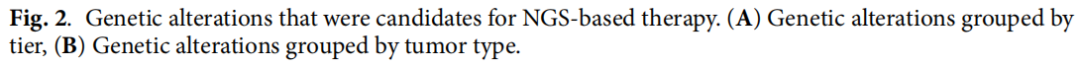
图2
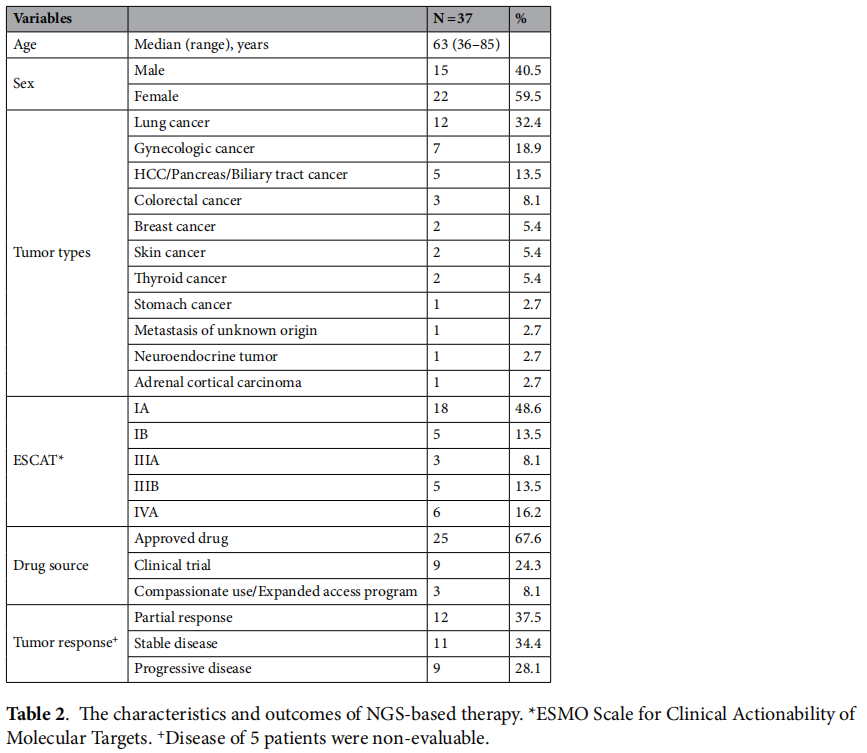
表2
与标准治疗相比,基于NGS的治疗方案带来了更高的缓解率,达37.5%。在32例有可测量病灶的患者中,12例(37.5%)达到部分缓解,11例(34.4%)病情稳定。中位随访时间为6.7个月(95%CI:4.3 - 9.1),中位治疗时间为6.4个月(95%CI:4.4 - 8.4)。在本研究过程中,基于NGS治疗后的中位总生存期尚未达到。所有基于NGS治疗的详细信息见表3。
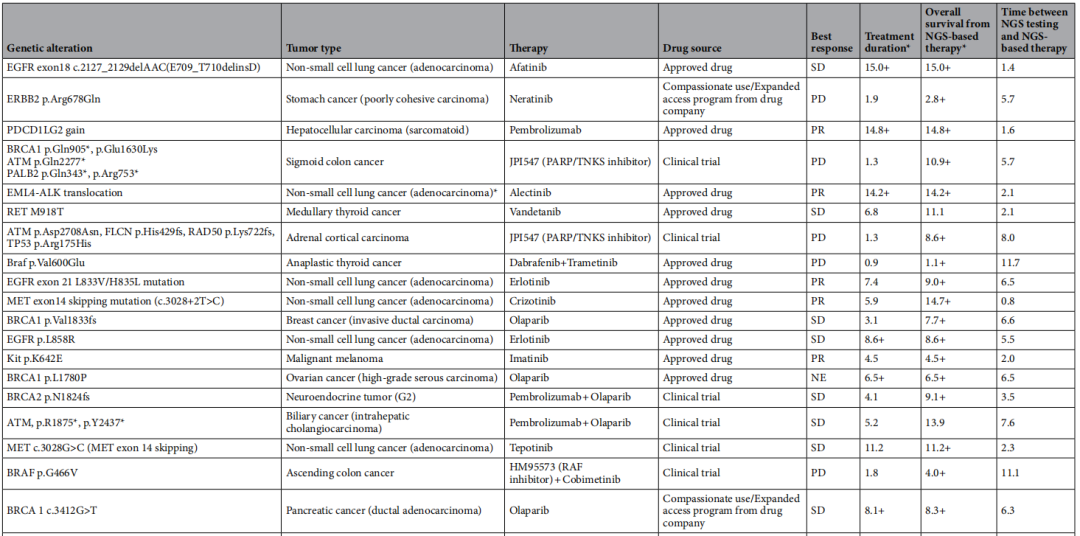
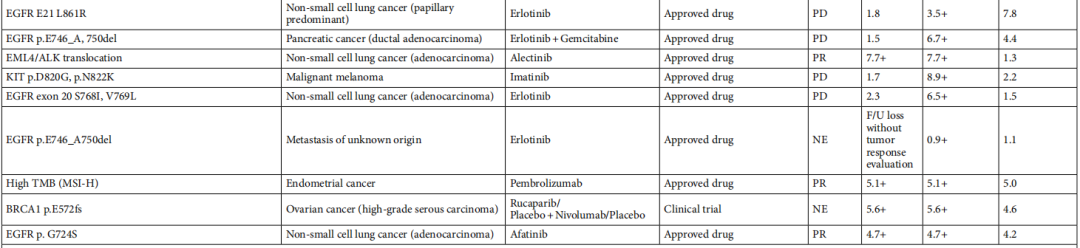

表3
NGS匹配治疗案例研究:
一名53岁男性患者被诊断为转移性腺癌,原发肿瘤位于降结肠,累及壁层腹膜,并伴有多处肝转移。确诊时进行了NGS,检测到ALK:STRN融合以及TP53和RNF43突变,这些变异被归类为II级。未检测到BRAF和RAS突变,MSI状态为MSS/MSI-L。IHC显示其肿瘤中ALK呈强表达。在接受17个周期的贝伐单抗联合FOLFOX方案治疗后,通过药企的同情用药/扩大使用项目,患者接受口服布格替尼180 mg,每日一次作为二线治疗。根据RECIST 1.1,CT扫描显示肝转移灶部分缓解,CEA和糖CA 19 - 9等肿瘤标志物下降。然而,在服用布格替尼11.5个月后,确诊疾病进展。随后,通过药企的同情用药/扩大使用项目,将治疗药物从布格替尼更换为洛拉替尼。系列CT扫描显示病情稳定,但3个月后疾病迅速进展。更换为洛拉替尼后取活检样本进行ALK免疫组化检测,结果显示样本ALK阴性。该患者参加了一项免疫治疗临床试验,之后又接受了包括贝伐单抗联合FOLFIRI方案在内的额外化疗,但均无疗效。
讨 论
这项研究旨在证实NGS检测在发现实体瘤患者致病基因变异方面的真实世界应用价值,以及后续实施匹配治疗的意义。肿瘤的NGS基因谱分析和基于NGS的匹配治疗有望彻底改变癌症的诊断和治疗方式。这项技术推动的精准医学转型已经在日常临床实践中使患者受益。此前的临床试验已显示出NGS基因谱分析方法具有显著疗效。然而,NGS检测仍处于起步阶段,并非所有接受NGS检测的患者都能接受匹配治疗。在NCI - MATCH试验中,37.6%的病例发现了可干预变异,其中17.8%的患者被分配到临床试验中。在K - MASTER项目中,10.9%的患者入组临床试验。
先前有关实施NGS的研究主要聚焦于NGS技术的潜力和早期临床应用,主要集中在特定肿瘤类型,以及在严格控制的临床试验环境中基于组织的NGS检测的实用性。尽管这些研究展示了NGS技术的潜力,但它们缺乏对该技术在常规临床实践中实际适用性的评估。相比之下,本研究利用从韩国一家三级医院收集的大型数据集,评估了基于NGS的治疗在真实世界临床环境中的应用情况。本研究深入揭示了NGS技术在韩国医疗体系中的临床实用性,通过在常规实践中实际验证其实施情况和有效性,做出了独特的贡献。这是与先前研究的显著区别。
在本研究中,肺癌(32.4%)是接受基于NGS治疗最主要的癌症类型。然而,考虑到肺癌通常具有较高的基因突变率,但接受基于NGS治疗的肺癌患者数量相对较少,这一现象值得关注。这一发现可能是因为肺癌治疗已有完善的靶向EGFR、ALK和ROS1突变的治疗方案,携带这些突变的患者通常会按照标准治疗方案接受靶向治疗。如果这些患者是通过传统分子检测发现的突变,可能不会被纳入本研究基于NGS治疗的统计范畴。就每种癌症类型而言,肾上腺皮质癌是应用基于NGS治疗最常见的癌症类型(1/3,33.3%),其次是甲状腺癌(2/7,28.6%)、皮肤癌(2/8,25.0%)和妇科癌症(7/56,10.8%)等。在本研究中,接受基于NGS治疗的肿瘤类型呈现出意外的分布情况,这可能归因于多种因素,包括肿瘤生物学特性、临床实践指南、治疗手段的可及性、转诊模式以及本研究患者群体的特定特征。了解这些因素有助于解读本研究结果,并突显了在不同肿瘤类型中实施基于NGS治疗的复杂性。
本研究评估了在非临床试验背景下NGS检测的成效,重点关注韩国一家三级医院的患者。在研究队列中,257名(26.0%)患者携带I级变异,859名(86.8%)患者携带II级变异。检测到这些变异可能会指导基于NGS的治疗。然而,研究者发现在这家三级医院接受NGS检测的患者中,仅有3.7%接受了基于NGS的治疗。尽管本研究排除了基于传统分子检测发现的分子变异所采用的治疗方法,如靶向HER2或已知EGFR突变的治疗,但接受基于NGS治疗的患者比例仍显著低于先前临床试验报告的10.9% - 17.8%。在NCI - MATCH试验中,37.6%的患者存在可干预突变,17.8%的患者被分配到临床试验中。临床试验环境中基于NGS治疗比例较高,可归因于试验有结构化的框架以及可获取靶向治疗药物。同样,K - MASTER项目报告称,基于NGS检测结果,10.9%的患者参与了临床试验,这得益于与临床试验的整合。相比之下,本研究中基于NGS治疗比例低(3.7%)的主要原因是难以获取临床试验之外的匹配药物。在常规临床实践中,与NGS确定的可干预突变范围相比,获得批准的靶向治疗的可用性是有限的。监管障碍和经济限制通常会限制在常规实践中使用超说明书的靶向治疗。此外,并非所有患者都符合现有临床试验的严格标准,这进一步限制了基于NGS治疗的可及性。为了获取基于NGS治疗的证据并扩大其在日常临床实践中的应用,必须开展更多设计为“篮子”研究的临床试验,其入组标准基于NGS检测发现的变异情况。为了让患者能够获得分子指导的治疗,还应更多地灵活使用超说明书治疗。
NGS基因谱分析因其诊断和预后价值,也是临床中的重要工具。事实证明,识别特定的基因变异对于几种癌症的诊断和亚组分类至关重要,这些癌症包括脑癌、肉瘤和肾癌。一些基因变异,如结直肠癌中的BRAF突变,能够有力地预测预后。其他变异,如结直肠癌中的RAS突变,可以预测对抗EGFR治疗的反应。本研究通过NGS在胃肠道间质瘤中检测到了PDGFRA D842V突变,这是一种已知的可预测对伊马替尼治疗耐药的基因变异。在识别出该突变后,患者停止了伊马替尼辅助治疗。
由于NGS数据的复杂性,以及生物信息学家、病理学家和医生各自不同的关注点,NGS检测结果的报告方式仍存在争议。目前已开发出多种报告系统,如ESCAT、KSCAT和ONcoKB,这些系统都有各自对基因变异进行分类的标准。在本机构,研究者采用了AMP分级系统,该系统根据临床意义对基因变异进行分类——I级:具有显著临床意义的变异;II级:具有潜在临床意义的变异;III级:临床意义未知的变异;IV级:良性或可能良性的变异。AMP分级系统中的临床意义涵盖了治疗、预后和诊断等所有方面。然而,ESCAT和KSCAT系统则专门聚焦于分子靶点的临床可干预性,能够直接指导基于NGS的治疗应用。在本研究中被报告为AMP I级的标本中,只有34%会被归类为ESCAT I级(IA:30%,IB:4%),而47%的病例会被归类为ESCAT ⅣA。因此,通过临床医生和病理医生达成共识来实现NGS报告系统的标准化,将极大地有益于未来的研究。
在本研究中,患者队列包含了多种不同类型的癌症。每种癌症类型的基因变异发生率与公开数据相近。尽管使用的是储存的FFPE标本,但NGS检测的整体质量不合格率非常低(2.4%)。从下达NGS检测医嘱到得出诊断结果的周转时间为30天,这在日常实践中是可以接受的。因此,本机构开展临床NGS检测取得了成功。
为验证本研究NGS结果的准确性,研究者将NGS结果与HER2 IHC和SISH检测结果,以及MSI PCR检测结果进行了对比。HER2状态的一致性性达到95.3%(404/424),这一比例很高,与先前的研究结果相当。尽管存在少数假阳性或假阴性病例,但NGS检测在一例肝内胆管癌病例中检测到了HER2基因扩增,而该病例的HER2 IHC强度为1+。后续的SISH检测结果证实了该基因扩增情况。如果不进行NGS检测,就不可能发现这一潜在的可靶向治疗的变异。特别地,对于HER2 IHC评分为2+的病例,由于NGS检测CN结果与SISH检测相比阈值更高,NGS检测的CN结果在确定适合HER2靶向治疗的候选患者方面可能存在一定局限性。对于HER2 CN较低的病例,则需要进行SISH检测。MSI状态的一致性性为99.1%(323/326),这一比例也高于或相似于既往研究结果。本研究的NGS结果与传统分子检测结果也显示出较高的一致性,例如对KRAS或NRAS的焦磷酸测序,或对EGFR的PANAMutyper™(数据未显示)。综上所述,这些数据表明本研究的定制NGS检测panel得出的结果是可靠的。尽管所有的NGS检测均使用储存的FFPE肿瘤标本进行,但无论临床情况和组织状态如何,检测结果都是可靠的。NGS检测出的基因变异的临床意义有时并不明确。因此,研究者每月召开一次分子肿瘤委员会会议,参会人员包括生物信息学家、病理学家和临床医生,共同解读并详细分享那些大家愿意深入探讨的NGS检测结果。
本研究存在一些局限性。首先,本机构仅使用肿瘤组织进行NGS检测,这妨碍了对胚系变异的精准筛选。其次,由于NGS检测panel仅包含DNA样本,与同时包含DNA和RNA的其他检测panel相比,检测融合变异的准确性可能较低。随着可靶向治疗的融合变异数量增多,本机构最近开始采用基于RNA的检测方法,以检测更多的基因变异,包括融合变异。
总之,在这家三级医院,针对实体瘤患者,NGS基因谱分析已成功应用于日常临床实践。研究者发现,与传统分子检测相比,NGS检测能提供有价值的额外信息,从而实现分子谱分析指导下的治疗,使部分患者受益。
参考文献:
Kim JW, Na HY, Lee S, et al. Clinical implementation of next-generation sequencing testing and genomically-matched therapy: a real-world data in a tertiary hospital. Sci Rep. 2025;15(1):2171. Published 2025 Jan 16. doi:10.1038/s41598-024-84909-9

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)