首页 > 医疗资讯/ 正文
铁死亡是一种新发现的由铁驱动的脂质过氧化诱导的程序性细胞死亡,被认为是一种潜在的肿瘤治疗方法。然而,新出现的证据表明,肝细胞癌(HCC)细胞通常对铁死亡具有抵抗力,并且其潜在的分子机制知之甚少。
2025年1月8日,山东大学基础医学院初波、韩丽辉共同通讯在Nature communications 上在线发表题为“S100P is a ferroptosis suppressor to facilitate hepatocellular carcinoma development by rewiring lipid metabolism”的研究论文。研究证实了S100钙结合蛋白P(S100P)在铁死亡抵抗的肝癌细胞中显著上调,并有效抑制铁死亡。
机制上,S100P可促进溶酶体降解乙酰辅酶a羧化酶α (ACC1),而ACC1是脂质从头生物合成必不可少的酶。S100P缺失可上调ACC1表达,促进肝癌细胞对铁死亡的敏感性。s100p介导的ACC1降解依赖于RAB5C, RAB5C通过p62依赖的选择性自噬将ACC1导向溶酶体。敲低RAB5C或P62可以消除s100p诱导的ACC1溶酶体降解,恢复肝癌细胞对铁死亡的抗性。研究揭示了另一种抗铁死亡的途径,并提示S100P可作为肝细胞癌铁死亡相关治疗的一个有前景的药物靶点。

HCC是世界上死亡率最高的恶性肿瘤之一。尽管包括靶向治疗、免疫治疗或联合治疗的治疗策略在过去十年中得到了显着改善,但内在性和获得性耐药性阻碍了治疗效果,导致大多数晚期HCC患者的结局不佳。因此,迫切需要阐明HCC的发病机制并开发新的治疗方案,以改善HCC患者的发病率和死亡率。
铁死亡是新近发现的一种不同于凋亡和坏死的细胞程序性死亡,其特征是含有长链多不饱和脂肪酸(PUFA-PLs)的过氧化物磷脂以铁依赖的方式累积。虽然铁死亡的作用和机制尚未完全清楚,但最近的研究表明,铁死亡可以阻碍多种肿瘤的发生,包括HCC。然而,与RCC等其他肿瘤相比,HCC对铁死亡更具抗性。其分子机制尚不清楚。因此,更好地理解肝癌细胞铁死亡抵抗的机制将有助于肝癌铁死亡靶向治疗的进展。
S100P首先从胎盘中纯化,是小钙结合蛋白S100家族的成员。S100P最初在细胞质中产生,也可以通过晚期糖基化终末产物受体(RAGE)分泌并发挥作用。尽管现有文献表明S100蛋白表达失调与不同癌症的发生和发展有关,S100P在癌症中的确切作用和分子机制仍有待完全了解。S100P基因特别位于人类4q16染色体上,而所有其他S100基因都位于人类1号染色体上,表明其与其他成员不同的独特潜在作用。在这里,研究确定了S100P作为代谢重编程调节因子在重塑HCC细胞中铁死亡易感性的意想不到的作用。
在本研究中,揭示了S100P-RAB5C-P62-ACC1轴是独立于RAGE驱动肝癌细胞铁死亡易感性的中枢通路。S100P通过RAB5C和p62介导的ACC1溶酶体降解降低了PUFA-PLs的水平,而S100P的缺乏恢复了ACC1的活性并使肝癌细胞对铁死亡敏感。敲除RAB5C或P62可逆转s100p诱导的ACC1下调,使细胞对铁死亡敏感。此外,在s100p缺失的肝癌细胞中,敲除ACC1可恢复铁死亡抗性,表明s100p介导的铁死亡抑制依赖于ACC1的失活。研究结果揭示了肝细胞癌中脂质合成介导的铁死亡的机制,并提示靶向S100P可能是克服肝细胞癌中铁死亡靶向治疗耐药性的可行方法。
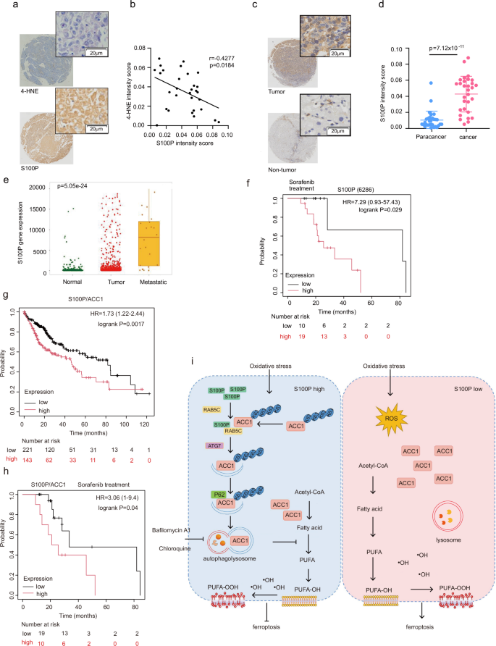
图1 S100P介导HCC患者的铁死亡(摘自Nature communications )
参考消息:
https://doi.org/10.1038/s41467-024-55785-8
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)