首页 > 医疗资讯/ 正文
摘要
目的 评价缺氧预处理(HPC)对在缺氧状态下人脐静脉血管内皮细胞(HUVECs)细胞水平(细胞形态学变化、细胞活力、细胞凋亡率)、分子水平[细胞内血管内皮生长因子(VEGF)和血管生成素2(Ang-2)表达]及基因水平(相应mRNA的表达)的影响,探讨缺氧预处理对HUVECs缺氧损伤的保护作用机制。方法 常规进行人脐静脉血管内皮细胞株的培养,建立HUVECs缺氧模型,分为3组:正常对照(CON)组、缺氧(HYP)组及HPC组。在显微镜下观察各组细胞形态,分别采用CCK-8法、Hoechst 33258荧光染色和Western blotting法、RT-PCR法检测各组细胞活性、细胞凋亡率和细胞内VEGF、Ang-2及相应mRNA的表达水平。结果 与CON组相比,HYP组细胞明显受损、细胞活性明显减低,细胞凋亡率明显增加,细胞内VEGF、Ang-2及相应mRNA水平明显升高;而HPC组细胞形态接近正常,细胞活性及细胞凋亡率较CON组减低、但较HYP组高,细胞内VEGF、Ang-2及相应mRNA的表达水平较CON组及HYP组明显升高。结论 HPC通过上调细胞内VEGF、Ang-2及相应mRNA的表达对VEC缺氧损伤起到保护作用。
急性缺血性卒中是最常见的卒中类型,占我国新发卒中的69.6%~72.8%,住院期间(中位住院时间11 d)病死率为0.5%,并发症发生率为12.8%,病后3个月的病死率为1.5%~3.2%,1年病死率为3.4%~6.0%,因此缺血性卒中的防治备受关注。缺血性卒中的发病风险随动脉血管粥样硬化(atherosclerosis,AS)的加重而增加,而血管内皮细胞(vascular endothelial cell,VEC)功能障碍是AS发生发展的始动因素,VEC在维持血管稳态、调节动脉血管收缩方面发挥着重要作用,保护VEC正常功能对缺血性卒中的防治尤为重要。而血管内皮生长因子(vascular endothelial growth factor,VEGF)和血管生成素2(angiogenin-2,Ang-2)对内皮细胞活化、迁移、增殖过程中起重要作用。而缺氧预处理(hypoxic preconditioning,HPC)可以促进细胞因子的生成,增强组织细胞的缺氧耐受力,具有神经保护作用。本研究拟采用人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)作为研究对象,建立体外VEC缺氧模型,分别在细胞水平、分子水平及基因水平观察HPC对HUVECs缺氧损伤的影响,探讨HPC对HUVECs缺氧损伤保护机制。
1 材料与方法
1.1 试剂与仪器
试剂:DEPC(罗氏公司),Tris碱(北京鼎国),Hoechest 33258(美国Sigma),CCK-8试剂盒(上海贝博公司Cell Counting Kit-8),SYBRGreen(TOYOBO公司),Rever Tre Ace-a-逆转录试剂盒,TRNzol(北京天根),VEGF、Ang-2、GAPDH引物(生工生物上海有限公司),蛋白marker(美国BIO-RAD),多克隆兔抗Ang-2(Abcam公司),单克隆鼠抗VEGF(Abcam公司)。仪器:CO2培养箱、三气厌氧培养箱(美国Thermo公司),全自动酶标读数仪、SDS-PAGE蛋白电泳仪(Cat.No VE-180)、GelDoc 2000凝胶成像分析系统、WB专用扫描仪、Quantity One图像分析软件(美国BIO-RAD),PCR System (applied biosy stems)等。
1.2 细胞培养
选取由重庆医科大学病理研究所提供的HUVECs细胞株。细胞株常规复苏和传代在95%空气,5% CO2,37 ℃和饱和湿度的培养箱中进行。细胞黏附在培养瓶壁的表面生长,当达到80%细胞融合后,挑选增殖状况良好的细胞,进行传代。以细胞生长密度为105个/ml密度传代,36~72 h后,细胞分裂加速,进入指数生长期。此时,将培养基更换为无血清DMEM培养液,并继续培养细胞24 h,使其进入静止期。
1.3 细胞缺氧模型的建立和分组
随机将细胞分为3组。(1)对照组(CON):细胞在5%CO2、37 ℃的常氧培养箱中培养至实验结束。(2)缺氧组(HYP):根据参考文献,细胞在厌氧培养箱(1% O2+94% N2+5% CO2)中培养8 h直至实验结束。(3)HPC组:细胞在厌氧培养箱(1% O2+94% N2+5% CO2)中培养2 h,然后在常氧培养箱中继续培养12 h,后同第2组操作方法,每组重复3个样本。
1.4 CCK-8法检测细胞存活率
将细胞悬液调整到5×104个/孔细胞的浓度,然后接种到96孔板中,每组都有5个重复孔,同时还有一个空白孔,孔中没有加入细胞。正常培养36 h直到细胞扩散到平板底部后,换用无血清培养基继续培养12 h。实验随机分组,按每组操作要求结束后,取出96孔板,避光加入10 μl的CCK-8,在正常氧气条件下孵育1 h,测量450 nm处的吸光度(optieal densit,OD),此过程重复5次。细胞活力(%)=(处理组OD值-空白组OD值)/(对照细胞OD值-空白组OD值)×100%。
1.5 Hochest 33258检测细胞凋亡
细胞以105个的密度种植在3个24孔板中,正常培养36 h,细胞80%融合用于实验。按照各组的条件处理和固定细胞后,在避光条件下,立即使用浓度为10 μg/ml的Hochest 33258染色剂在37 ℃孵育细胞10 min,用PBS冲洗并停止染色,应用倒置荧光显微镜,观察细胞形态并拍照采集照片。在高倍放大镜下,每组随机选取10个不同的视野区域,使用US Image-Pro Plus图像分析系统进行分析,并且计算出细胞的凋亡率。
1.6 Western blotting法检测VEGF、Ang-2蛋白的表达
用25 cm2的培养瓶种植细胞,并且依各组的要求将细胞进行处理。然后提取蛋白质,使用考马斯亮蓝G-250染色法测定样本的蛋白质浓度,Western印迹蛋白质上样量根据蛋白质浓度确定。使用常规PCR设备,99 ℃,变性5 min;VEGF和Ang-2蛋白表达检测通过标准聚丙烯酰胺凝胶电泳(SDS-Polyacrylamide gelelectrophoresis,SDS-PAGE或PAGE)。蛋白表达采用ECL化学发光成像检测,并使用Bio-Rad凝胶成像系统捕获。使用Quantity One软件分析条带的灰度值。直到获得满意的结果,每组样品进行3次电泳,用于重复验证结果。
1.7 RT-PCR检测缺氧诱导基因VEGF、Ang-2 mRNA的表达
根据试剂盒提供的说明步骤进行RT-PCR检测。cDNA的制备总体积为20 µl,逆转录产物保存在-80 ℃。引物由上海生工生物有限公司合成,根据GenBank中该基因的mRNA序列设计。上下游引物序列如表1所示,反应条件:94 ℃-5 min→(94 ℃-30 s→57 ℃-30 s→72 ℃-30 s)×32 cycles→72 ℃-10 min。为消除每次操作误差对实验结果的影响,应用GAPDH为内参照物,把电泳曲线中VEGF及Ang-2的吸光度与内参的吸光度比值作为目的基因的相对浓度。计算相对数:相对系数=目的带表达强度/内参表达强度。

1.8 统计学分析
使用SPSS 20.0软件对实验数据进行统计分析处理,并且进行方差齐性检验后,各组间比较应用单因素方差分析,用χ2检验处理细胞凋亡率,实验结果以(x±s)表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞形态
倒置相差显微镜(见图1)显示,CON组的细胞,细胞质清晰,胞体透明,分界明确,有少量颗粒状代谢物沉积;HYP组的细胞,细胞皱缩,胞体较小,间距较大,细胞质有许多颗粒状沉积,细胞损伤明显;HPC组的细胞形态基本正常。荧光显微镜(见图1)显示,CON组细胞核染色呈均匀蓝色,细胞形态正常;HYP组和HPC组观察到细胞形态呈圆形、皱缩并与邻近细胞分离,部分细胞凋亡,细胞质凝结,可见凋亡小泡,核染色质以块状、新月形、碎裂状堆积在核膜边缘。
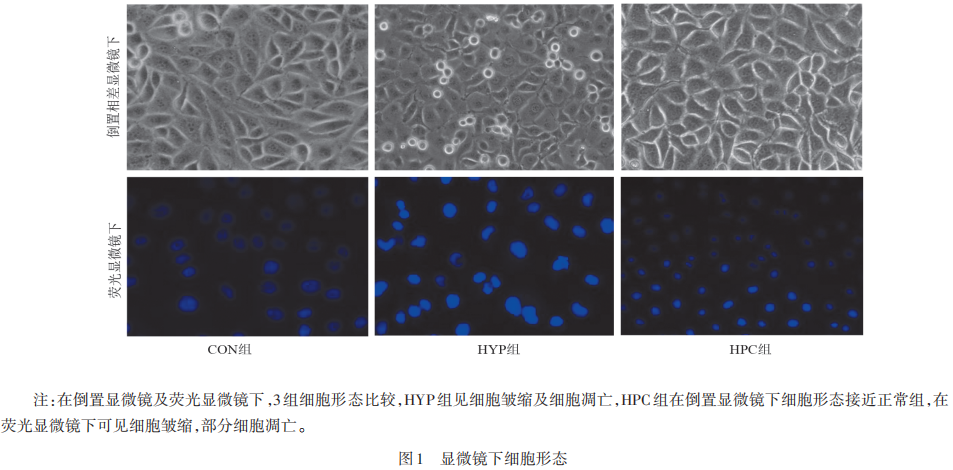
2.2 细胞存活率及凋亡率
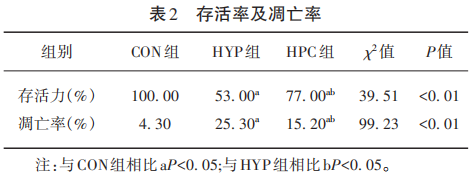
CCK-8法检测及Hochest 33258检测显示不同处理对HUVECs存活力及凋亡率的影响(见表2)。
2.3 VEGF、Ang-2蛋白的表达
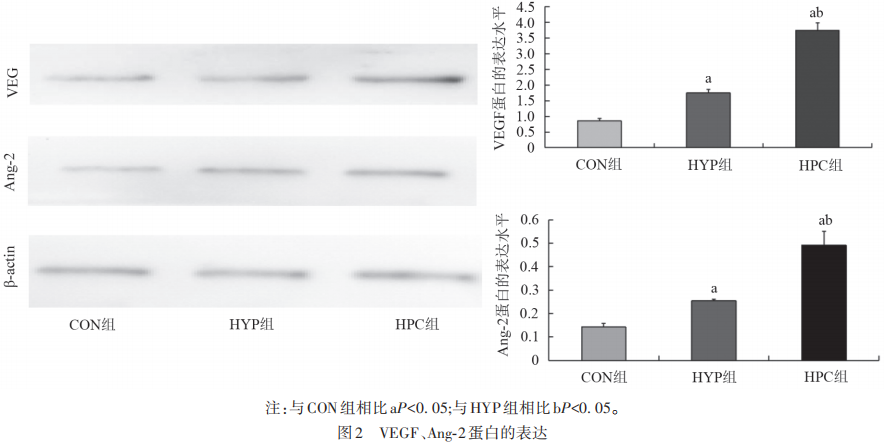
Western blotting检测显示不同处理对VEGF及Ang-2蛋白表达影响(见图2)。
2.4 RT-PCR检测VEGF、Ang-2 mRNA的表达
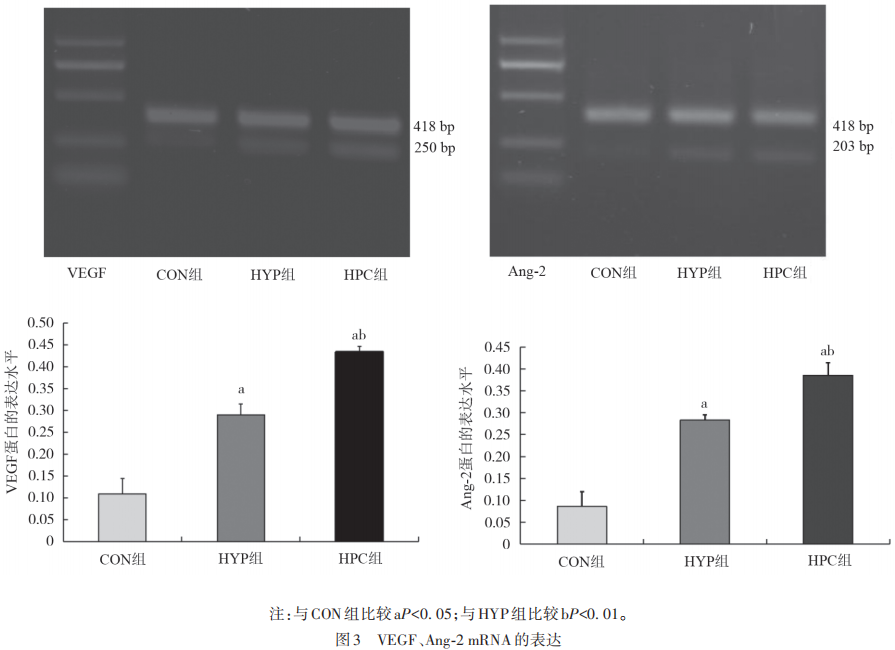
RT-PCR检测不同处理对VEGF、Ang-2 mRNA的表达影响(见图3)。
3 讨 论
本实验建立了模拟脑血管内皮细胞缺氧损伤的HUVECs体外培养系统,研究了缺氧预处理对HUVECs缺氧损伤的保护作用,并且研究其对Ang-2和VEGF表达的影响。缺氧预处理是机体经历反复的短暂性缺氧适应,机体自身或细胞的内源性防御机制可以被激活,使得组织和细胞防御及承受随后更加严重的缺氧或缺血损伤,这是一种强大的内源性防御机制。缺氧预处理可诱导细胞和组织发生表型和功能变化,对多种致死性应激产生防御和抵抗,这种现象存在于多个种属动物的体外和体内的防御和抗性诱导已经证实。此外,还有研究认为,缺氧预处理可促进骨髓间充质干细胞生存和血管再生。
在缺氧条件下,新生血管生成迅速启动,VEC的激活是第一步反应,VEGF是目前公认的最强大的促血管生成因子,也是最主要的启动因子。在大脑的神经元、星形胶质细胞和小胶质细胞中均有VEGF的表达,可参与调控新生血管的再生,通过与VEC上的VEGF受体结合促进VEC增殖,增加缺氧缺血部位的毛细血管密度和通透性,促使组织发挥“自身搭桥”作用,减轻缺氧缺血引起的神经损伤。
Ang贯穿于血管生成的全过程,促血管生成能力强大,Ang/Tie2信号通路是血管生成和血管完整性的重要调节剂,并在一定程度上弥补了VEGF的不足。张明亮等在血管瘤干细胞的研究中发现Ang-2上调可以增加VEGF等血管生成调控蛋白的表达,从而增强血管瘤干细胞的血管生成的能力。研究也表明,VEGF可上调Ang-2表达进而促进血管增生,证实了两者的协同作用。实验通过建立HUVECs体外培养体系,模拟VEC缺氧损伤,应用RT-PCR法和Western blotting法检测缺氧状态下细胞内Ang-2、VEGF蛋白水平的表达。结果显示,在正常血管内皮细胞中VEGF和Ang-2蛋白呈较低水平表达,在缺氧状态下,VEGF和Ang-2蛋白水平有所增加,在缺氧预处理状态下再缺氧处理VEGF和Ang-2蛋白水平则显著增加。
综上所述,通过HPC,使缺氧VEC中VEGF、Ang-2蛋白的表达明显上调,说明HPC可减轻HUVECs缺氧损伤,对VEC有保护作用。这为HPC成为缺血性卒中的防治措施奠定了部分理论基础。但HPC保护或对抗VEC功能障碍的具体机制及HPC在临床应用具体实施方案还需进一步探讨和研究。
参考文献
[1]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国急性缺血性卒中诊治指南2023[J]. 中华神经科杂志,2024,57(6):523-559.
[2]Arderiu G,Espinosa S,Peña E,et al. Tissue factor variants induce monocyte transformation and transdifferentiation into endothelial cell-like cells[J]. J Thromb Haemost,2017,15(8):1689-1703.
[3]宋光兰,陈俊,鲜文. 曲美他嗪对缺氧状态下血管内皮细胞线粒体损伤的保护作用[J]. 临床和实验医学杂志,2020,19(2):148-151.
[4]Davis S,Papadopoulos N,Aldrich TH,et al. Angiopoietins have distinct modular domains essential for receptor binding,dimerization and superclustering[J]. Nat Struct Biol,2003,10(1):38-44.
[5]Li S,Hafeez A,Noorulla F,et al. Preconditioning in neuroprotection:From hypoxia to ischemia[J]. Prog Neurobiol,2017,157:79-91.
[6]Wang D,Liu Y,Yang X,et al. Hypoxic preconditioning enhances cell hypoxia tolerance and correlated lncRNA and mRNA analysis[J]. Life Sci,2018,208:46-54.
[7]李婧静,吴世政,薛孟周,等. 经典瞬时受体电位通道3与缺氧预处理大鼠脑梗死的关系[J]. 郑州大学学报(医学版),2020,55(6):806-810.
[8]Huang L,Wu S,Li H,et al. Hypoxic preconditioning relieved ischemic cerebral injury by promoting immunomodulation and microglia polarization after middle cerebral artery occlusion in rats[J]. Brain Res,2019,1723:146388.
[9]Webster KA,Discher DJ,Bishopric NH. Cardioprotection in an in vitro model of hypoxic preconditioning[J]. J Mol Cell Cardiol,1995,27(1):453-458.
[10]Hu Y,Chen W,Wu L,et al. Hypoxic preconditioning improves the survival and neural effects of transplanted mesenchymal stem cells via CXCL12/CXCR4 signalling in a rat model of cerebral infarction[J]. Cell Biochem Funct,2019,37(7):504-515.
[11]吴世政. 高原脑科学研究进展[J]. 高原医学杂志,2019,29(1):47-53.
[12]杨鹏,吴世政,侯倩,等. 缺氧预处理对缺血性脑卒中大鼠的脑保护作用及H3R17me2表达的影响[J]. 中风与神经疾病杂志,2018,35(2):119-122.
[13]侯婧瑛,于萌蕾,郭天柱,等. 缺氧预处理激活HIF-1α/MALAT1/VEGFA通路促进骨髓间充质干细胞生存和血管再生[J]. 中国组织工程研究,2021,25(7):985-990.
[14]张瓅方,李梦华,刘暖,等. 黄芪丹参配伍提取物经VEGF、Ang1/Tie2通路对心肌梗死大鼠血管新生的病理影响[J]. 科学技术与工程,2020,20(1):104-108.
[15]张珉. 血管内皮细胞生长抑制因子(VEGI)的结构与功能关系及作用机理研究[D]. 上海:第二军医大学,2003.
[16]Apte RS,Chen DS,Ferrara N. VEGF in signaling and disease:beyond discovery and development[J]. Cell,2019,176(6):1248-1264.
[17]Moritz F,Schniering J,Distler JHW,et al. Tie2 as a novel key factor of microangiopathy in systemic sclerosis[J]. Arthritis Res Ther,2017,19(1):105.
[18]张明亮,吴杉英,王彪,等. 血管生成素-2上调增强血管瘤干细胞血管形成能力的研究[J]. 中国美容医学,2020,29(9):89-91.
[19]Zong X,Wu S,Li F,et al. Transplantation of VEGF-mediated bone marrow mesenchymal stem cells promotes functional improvement in a rat acute cerebral infarction model[J]. Brain Res,2017,1676:9-18.
[20]González-González A,González A,Alonso-González C,et al. Complementary actions of melatonin on angiogenic factors,the angiopoietin/Tie2 axis and VEGF,in co-cultures of human endothelial and breast cancer cells[J]. Oncol Rep,2018,39(1):433-441.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)